Анотація
Зебра (Taeniopygia guttata) стає все більш важливим модельним організмом у багатьох областях досліджень, включаючи токсикологію 1, 2, 3 поведінку, а також пам'ять та навчання 4,5,6. Як єдиний співочий птах з секвенированним геномом, зебра-зяблик має великий потенціал для використання в дослідженнях розвитку; Однак ранні стадії розвитку зебрового зяблика вивчені недостатньо. Відсутність досліджень у розвитку зебрових зябликів можна пояснити труднощами розтину малого яйцеклітини та зародка. Наступний метод дисекції мінімізує пошкодження ембріональної тканини, дозволяючи досліджувати морфологію та експресію генів на всіх стадіях ембріонального розвитку. Це забезпечує як візуалізацію ембріонів у яскравому полі, так і флуоресцентну якість, їх використання в молекулярних процедурах, таких як in situ гібридизація (ISH), аналізи проліферації клітин та екстракція РНК для кількісних аналізів, таких як REA. ). Ця методика дозволяє дослідникам вивчати ранні стадії розвитку, які раніше були важко доступними.
Вступ
Загальною метою цієї методики є отримання ембріонів зебри (Taeniopygia guttata) з ранніх стадій ембріогенезу для використання в широкому діапазоні досліджень розвитку. Зеброві зяблики стали переважною моделлю співочих птахів і широко використовувались у різних галузях, включаючи токсикологію 1,2, поведінку 3, пам’ять та навчання 4,5,6, порівняльну нейроанатомію 7,8 та розвиток мови 9,10. Як єдиний співочий птах з секвенированним геномом, зебровий зяблик дозволяє проводити генетичне та молекулярне вивчення порядку Passeriformes, який представляє понад 50% відомих видів птахів.
Незважаючи на використання дорослих та неповнолітніх зебрових зябликів у широкому діапазоні областей, мало досліджень проводилось на ембріонах зебрових зябликів, особливо на ранніх стадіях розвитку. Це можна пояснити малим розміром її яєць та ембріонів, а також його недавнім статусом 14,15,16 модельного організму для досліджень, в яких курка (Gallus gallus domesticus) раніше використовувалася як 17.18.19.20 .21 переважна модельна система. Однак, як неголосні студенти, кури не є придатною модельною системою для вивчення генетичних основ вокального навчання, розвитку голосового навчання, спадковості, поведінки та базальних гангліо-коркових ланцюгів, що беруть участь у навчанні. Двигун 10.
Важливо зазначити, що ембріони зебрових в’юрків набагато делікатніші і легше пошкоджуються, ніж курячі ембріони під час розтину та молекулярних процедур. Зокрема, необхідна більша обережність при виконанні етапів проникнення в ембріони зебрових зябликів. Сильні миючі засоби та ферменти, які не зашкодять курячому ембріону, можуть завдати шкоди ембріонам зебрових зябликів. З точки зору загального догляду, перед закладкою в інкубатор необхідно відкладати яйця зебрових зябликів у маленькі чашки, щоб запобігти їх розбиванню при прокатці під час інкубації.
Зебра-зяблики піддаються поведінковим дослідженням, легко та плідно розмножуються протягом усього року в неволі і є учнями, що навчаються голосу. Ці характеристики дозволяють використовувати зебрового зяблика для задоволення потреби в модельному організмі, який інтегрує аспекти розвитку, генетичні та поведінкові аспекти мови. Детально описані нижче методи розтину, а також нещодавно розроблений специфічний посібник 22 щодо проведення зебри, роблять зебра в’юнком все кориснішою стандартизованою моделлю розвитку організму. Однак отримання ембріонів на ранніх стадіях може бути страшним. Цей протокол дозволяє дослідникам легко отримувати ембріони на ранніх стадіях. Дослідження, що вивчають ранній розвиток та основи молекулярного розвитку складної поведінки у зебрового вьюрка, або токсикологічні ефекти розвитку на інших дрібних, ворожих птахів, виявлять корисною цю методологію дисекції.
Протокол
Заява з етики: Методи проводились на одомашнених зебрових зябликів із племінної колонії в коледжі Вільяма та Мері. Усі процедури відповідали рекомендаціям RSPCA 23 і були затверджені Коледжем Вільяма та Мері OLAW (Управління лабораторного захисту тварин) Забезпечення добробуту тварин (# A3713-01) та мали схвалення Інституційного комітету з догляду та використання тварин (IACUC) (# 2013-06 -02-8721-dacris).
1. Збір яєць та інкубація
2. Видалення ембріона з яйцеклітини
3. Відділення ембріонів від позазародкової тканини
4. Аналіз розмноження клітин EdU. Включення та виявлення EdU в ембріонах Zebra Finch.
5. EdU "клацніть" Протокол реакцій
Наступні кроки виконуються на скляних флаконах.
Репрезентативні результати
Перед розсіченням EdU вводять у яйце на 2 день і дають інкубувати протягом ночі. Після розтину та фіксації зародка 16 22 стадії EdU візуалізували за допомогою хімічної хімії, що дозволяє виявляти проліферуючі клітини, як видно на Малюнок 6 (A, B, C). Важливо ретельно контролювати часові моменти під час розміщення яєць в інкубаторі та під час дисекцій, оскільки вплив метилртуті або проведення аналізу EdU може перервати розвиток. Ін'єкцію робили на початку 0-го дня, який був днем збору врожаю, як зазначено на кроці 1.3. Цей ембріон розрізали приблизно через 38 годин (стадія 7-22). Встановлено, що рівень виживання становить приблизно 90% (така ж швидкість, як контрольні ембріони), якщо кількість ін'єкції була менше 478 нл.
Ця методологія також дозволяє проводити дисекцію для вилучення високоякісної РНК. Після розтину ембріонів 22 стадії 16, екстракцію РНК проводили згідно з протоколом виробника без необхідності оптимізації, як видно з Малюнок 7. Видалення жовткової мембрани було непотрібним для вилучення РНК та подальших додатків QRT-PCR.
Примітка: Усі фігури ембріонів орієнтовані так, що передня та задня області знаходяться у верхній та нижній частині зображень відповідно.
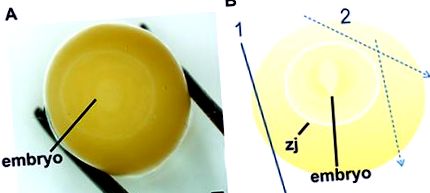
Рисунок 1. Процедура визначення та розкриття ембріонів зебрових в’юрків, стадії 1-10 22. Знайдіть ембріон, обережно розкачуючи жовток, доки не буде видно слабкий білий диск (ДО). Після того, як ембріон опиниться в центрі яєчного жовтка, його жовток розсікають в шаховому порядку (B) при якому перший зріз зменшує тиск мембрани вітелліну (1), а наступні зрізи (2) межують із зоною з'єднання (zj), яка прилипає до мембрани вітелліну. Шкала масштабу являє собою 1 мм.
Рисунок 2. Видалення мембрани вітелліну та видимість ембріональних структур. Після видалення ембріона з яєчного жовтка помістіть ембріон у чашку Петрі, що містить 4% PFA. Якщо потрібно провести гібридизацію in situ, видимість ембріональних структур є дуже важливою і може бути досягнута шляхом видалення жовткової оболонки. (ДО). Візьміть жовткову мембрану надто дрібними загостреними щипцями та обережно видаліть її від ембріона, маніпулюючи ембріоном безпосередньо на крайньому краї, якщо це необхідно(B). Видалення жовткової оболонки підвищує чіткість ембріональних структур і дозволяє зображувати або обробляти ембріони за допомогою гібридизації in situ (C). Масштабні смуги представляють 1 мм. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Рисунок 3. Цілісна гібридизація in situ, що проводиться у розвитку ембріонів зебрових зябликів, що зазнали дії метилртуті. Схеми експресії ортодентикульного гомеобоксу 2 (Otx2) характеризувались у ембріонів, що зазнавали дії 0,0 ppm метилртуті (А, А ') і 2,4 ppm метилртуті (B, B ') через дієту батьків. Експресія doRsaI (A) та вентральна (A ') Otx2 видно через зорові та середні мізки везикул на стадії 12-22. Ембріони групи лікування розсікали одночасно, але затримувались у розвитку, як видно на спині частина (B) та черевний вигляд (B ') структур голови, які характерні для стадії 11 22 Скорочення:. мб, середній мозок; оп, зоровий пухирець. Масштабні смуги представляють 1 мм.
Малюнок 4. Ціла збірка на місці Гібридизацію проводять у розвитку ембріонів зебрових зябликів, що зазнають дії метилртуті. Схеми експресії ортодентикульного гомеобоксу 2 (Otx2) характеризувались на стадії 6 22 ембріонів, що зазнали дії 0,0 ppm метилртуті (А, А ') і стадія 5 - 22 ембріони, що зазнають впливу 2,4 м.д. метилртуті (B, B ') через дієту батьків. Скорочення: am, передній край мезодерми; Ні, нотохорд, нотохордова мезодерма; по, проамніон, передній бластопор; ps, примітивна лінія 22. Масштабні смуги представляють 1 мм.
Рисунок 5. Весь монтаж на місці Гібридизація, проведена в ембріонах зебрових зябликів за допомогою сенсорного зонда. (ДО) 5 етап 22 ембріони. (B) Рання стадія 6 22 ембріони. (C) 11 стадія 22 ембріони. Масштабні смуги представляють 1 мм.
6 "src ="/files/ftp_upload/51596/51596fig6highres.jpg "/>
Рисунок 6. Включення та захист Edu в ембріонах зебрових зябликів. EdU "click" хімія була використана для виявлення клітин, що проліферують на ембріональній стадії 16 22 (A, B, C). EdU вбудовується в ДНК на тимідиновій ділянці 26, 27 і виявляється за допомогою хімії, клацання 27. Проліферація добре видно на бічних краях сомітів і на хвостовій частині. Панель ДО показує, що проліферація відбувається виключно в задній частині ембріона, а також показує окремі проліферуючі клітини. Панель B показані місця розповсюдження по всьому зародку. Панель C. показує передню область та більш детально показує сильно проліферативний теленцефалон (TE). Скорочення: af, амніотична складка; FLB, контур крила; hlb, брунька задньої кінцівки; le, пухирець кришталика; мс, середній мозок; mt, Metencephalon; опт, оптична чашка; па, глоткова дуга; см, сомітова мезодерма; tb, задній колод; тенцефалон. Масштабні смуги представляють 1 мм. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Рисунок 7. Якість РНК, вилученої з розсічених зародків зебрових в’юрків. Контроль (0,0 ppm) та 1,2 ppm зародків метилртуті розтинали та заморожували, як описано на етапі 3.8. Кожна смуга показує РНК, вилучену з двох гомогенізованих ембріонів з кожної обробленої групи.
Обговорення
Нещодавня розробка ембріологічного керівництва 22 та анотація геному зебрових зябликів роблять його бажаним модельним організмом для досліджень розвитку. Однак невеликі розміри та крихкість ембріонів зебрових в'юрків, що складають від 3 до 7 мм на етапах 1 - 10 22, можуть ускладнити розсічення 11, 14. Розміщення та чисте видалення ембріонів з поверхні жовтка може бути складним завданням. Цей протокол надає достатньо деталей, щоб виконати процедуру з легкістю. Цей протокол демонструє важливі кроки, які зазвичай не відомі, але необхідні для забезпечення успішної дисекції. Наприклад, важливо залишити невеликий шар жовтка між ембріоном та ваговим аркушем паперу, щоб запобігти злипанню.
Ідентифікація та видалення ембріона можуть бути складними. Щоб вирішити проблему ідентифікації зародка на поверхні жовтка, освітліть світло безпосередньо на жовток після того, як його витягнули з яйцеклітини, і подивіться на жовток під кутом 45 °, щоб знайти зародок. Коли ембріон знайдено, виріжте жовток на ваговому папері, обережно, щоб не розірвати ембріон.
Якщо інші додатки включають зображення анатомічних відмінностей, in situ гібридизацію або аналізи проліферації клітин, важливо видалити жовткову мембрану на етапі 1-8 22 для кращої візуалізації структур. Якщо у вас виникають труднощі з видаленням жовтка або жовткової оболонки на ранніх стадіях, зафіксуйте ембріон у 4% PFA перед тим, як промити його в 1X PBS, щоб зменшити крихкість ембріона. Спочатку видаливши жовткову мембрану під час розтину, як описано, структури добре помітні та цілі в ембріонах зебрових в’юрків після гібридизації in situ.
Обмеженням освіти є те, що введення обсягу дози понад 478 NL веде до ембріональної смертності. Однак широкий діапазон дозувань дозволяє змінювати рівні проліферативного мічення клітин.
Реакцією "клацання", яка використовується в цьому наборі, є каталізований мідний (I) -алкін-азид-циклоприєднання (Cu (I) AAC). У цій специфічній реакції молекула, що містить аналоги тимідин-алкіну (UDE), включається в клітини, що активно діляться. Алкінова група в UDE виступає з гвинтової структури ДНК і виявляється під впливом азидної молекули, кон'югованої із зеленою флуоресцентною молекулою, яка зв'язується із вільною алкіновою групою. Зелена флуоресценція показує щойно розмножуються клітини ембріона. Біоортогональність азидних та алкінових груп запобігає неспецифічному фарбуванню, оскільки ці реакційноздатні види в природі не присутні в організмах. Крім того, оскільки ДНК не потрібно денатурувати, щоб відбулася реакція, можна легко провести більш детальний ДНК-залежний аналіз 27.
Розкриття інформації
Авторам нічого розкривати.
Подяка
Автори дякують своїм джерелам фінансування - Програмі бакалаврської наукової освіти Медінституту Говарда Хьюза в Університеті Вільяма та Мері; Спонсор пожертв: NIH (SMS); Номер гранту: R15NS067566. Вони також визнають підтримку Коледжу Вільгельма та Мері, Департаменту біології та Коледжу мистецтв і наук щодо допомоги у догляді за тваринами.
- КОМУНІКАЦІЯ Paramount Pictures та Coke Zero представляють ПРОТОКОЛ МІСІЇ НЕМОЖЛИВО-ПРИВАТНИЙ (1)
- ПОРІВНЯЛЬНИЙ АНАЛІЗ ДОТРИМАННЯ СРЕДИЗЕЙНОЇ ДІЄТИ СЕРЕД ДІВЧАТОК І ПІДЛІТКІВ, ЯКІ ВИКОНАЮТЬ
- Створіть програму для Android Android Blackberry iPhone Mobile App Development Freelancer
- Кетогенна дієта іспанською мовою
- Документ BOE-A-2004-19313
