Що таке селенопротеїни?
Селенопротеїни - це ексклюзивна група білків, які включають у свою структуру деякий залишок селеноцистеїну (Sec), який вважається амінокислотою № 21 генетичного коду. Ця незвичайна амінокислота є аналогом цистеїну (Cys) і містить селен замість сірки. Селен є важливим мікроелементом у багатьох організмах, і його дефіцит пов'язаний з численними патофізіологічними станами, такими як серцево-судинні захворювання, нервово-м'язові розлади, рак або запалення (Вячеслав М та співавт., 2014).
Залишки Sec та Cys займають гомологічні позиції, однак Sec є більш реакційноздатною амінокислотою, ніж цистеїн, і є частиною каталітичного домену білка. У селенопротеїнах із відомою функцією він завжди бере участь у окисно-відновних реакціях. З еволюційної точки зору та через подібність їх хімічних властивостей відбувся специфічний розвиток лінії від Sec до Cys, і тому можна знайти гомологи селенопротеїдів, що містять Cys замість Sec, визначаючи себе як ортологічні або гени паралогу (Zhang Y et al, 2006).
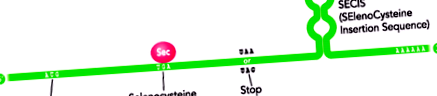
Включення Sec у поліпептидний ланцюг визначається його кодуванням кодоном UGA, кодоном, який зазвичай визначає припинення трансляції білка. Це відбувається, коли в 3'-UTR-області мРНК селенопротеїдів існує збережена структура стовбурової петлі, відома як елемент SECIS (SElenoCysteine Insertion Sequence) (Лобанов А.В., співавт., 2009) (Фігура 1).
Фігура 1. Схематичне зображення структури мРНК селенопротеїну. Спостерігається подвійність кодону UGA, кодуючи, з одного боку, амінокислоту Sec, а з іншого, вказуючи на завершення трансляції. В області 3 'UTR присутність елементу SECIS виділяється збереженою структурою циклу (змінено від Moghadaszadeh B et al, 2006).
Біосинтез селенопротеїдів
Характеризується тим, що селенопротеїни містять амінокислоту Sec. Цей залишок кодується кодоном UGA (зазвичай кодоном STOP), присутнім у відкритій рамці зчитування гена, який декодується як Sec під час синтезу рибосомного білка за механізмом, встановленим на канонічному поступальному апарат. Основним сигналом, який спрямовує на перекодування кодону UGA, є вторинна структура, присутня виключно в селенопротеїнових транскриптах, елементі SECIS. Тобто елемент SECIS - це той, який усуває значення кодону UGA і активує механізм вставки Sec.
Sec - єдина амінокислота, синтез якої відбувається у власній тРНК (синтезу вільних амінокислот не існує), що називається тРНК [Ser] Sec. Ця тРНК аміноацилюється із серином в реакції, що каталізується серил-тРНК-синтетазою (SerS), щоб створити базову структуру для біосинтезу Sec. Потім відбуватиметься фосфорилювання серину фосфосерил-тРНК-кіназою (PSTK). У свою чергу, селен форфорилюється селенофосфатсинтетазою 2 (SPS2) і додається до вже фосфорильованого серину. На цій структурі Sec-синтетаза (SecS) продукує залишок Sec, утворюючи таким чином Sec-тРНК [Ser] Sec (Bellinger FP et al, 2009) (Малюнок 2).
Малюнок 2. Механізм синтезу SeR. SerS аміноацилатів тРНК [Ser] Sec із серином з SerS, що дає початок Ser-tRNA [Ser] Sec. Останній фосфорилюється за допомогою PSTK, який забезпечує субстрат SecS разом з фосфорильованим селеном для синтезу Sec-тРНК [Ser] Sec (модифіковано від Labunskyy VM et al, 2014).
Для включення Sec-тРНК [Ser] Sec у рибосому його слід розпізнавати за специфічним фактором подовження, який називається EFSec. EFSec не взаємодіє безпосередньо з елементом SECIS, а скоріше через SECIS-зв’язуючий білок, відомий як SBP2. Крім того, інші фактори, такі як рибосомний білок L30 (який є фактором ініціації трансляції еукаріотів, також званий eIF4a3), беруть участь у процесі включення Sec у відповідь на присутність кодону UGA в рамці зчитування гена (Bellinger FP та ін, 2009) (Малюнок 3).
Малюнок 3. Механізм вставки Sec до поліпептидного ланцюга. Елемент SECIS є проміжним продуктом для збору факторів EFSec, SBP2 та L30 до мРНК селенопротеїдів, що дозволяє включити Sec у відповідь на присутність кодону UGA (змінено з Labunskyy VM et al, 2014).
Глобальна подібність механізму синтезу та включення Sec у три домени життя свідчить про те, що це явище з’явилося лише один раз в еволюції, до поділу цих доменів. Існування ліній, які не включають Sec, вказує на те, що в деяких випадках ця родова здатність була втрачена, і це підтверджує думку про те, що існують різні селективні тиски, що визначають підтримку або втрату включення Sec.
Родини селенопротеїнів
Біологічні ефекти селену в основному опосередковані селенопротеїнами, які присутні в археях, бактеріях та еукаріотах. За деякими винятками, амінокислота Sec знаходиться в активному центрі ферменту, де вона опосередковує реакції окислювально-відновного каталізу (Arnér ES, 2010). З цієї причини фізіологічні ролі, які приймають селенопротеїни, значною мірою залежать від присутності Sec, так що специфічні мутації, що впливають на згадану амінокислоту, можуть легко спровокувати її інактивацію.
Класифікація селенопротеїдів на сімейства залежить від розташування Sec в амінокислотному ланцюгу (рис. 4). З одного боку, перша група складається з тих сімей, які мають Sec біля С-кінцевого кінця білка. Він утворений, наприклад, тиоредоксинредуктазами (TrxRs) та селенопротеїнами S, I, O та K. З іншого боку, положення Sec на N-кінцевому кінці утворює другу групу, в якій глутатіонпероксидази (GPxs), йодотироніндеодинази (ДІО), селенопротеїни H, M, N, T, V і W та селенофосфат синтетаза 2 (SPS2) (Lu J and Holmgren A, 2009).
Хоча молекулярні шляхи, за допомогою яких селенопротеїни виконують свої різні біологічні ролі, дуже різноманітні і в багатьох випадках невідомі, більшість діють як надзвичайно ефективні антиоксидантні ферменти, що входять до системи тіоредоксину та глутатіону (Крюков Г.В. та ін., 2003). Ці системи підтримують окислювально-відновний гомеостаз клітин за рахунок зменшення потужності НАДФН і, серед інших фізіологічних процесів, беруть участь в метаболізмі гормонів щитовидної залози, дозріванні сперми та функції м’язів (Лабунський В.М. та ін., 2014).
Малюнок 4. Класифікація та функції різних сімейств селенопротеїнів. Діаграма відносної довжини кожного типу селенопротеїну показана праворуч, а розташування секцій позначено червоним (Лабунський В.М. та ін., 2014).
Еволюція селенопротеїдів
Селенопротеом - це сукупність селенопротеїдів організму, і його еволюція визначається умовами навколишнього середовища, в яких живуть організми, а також наявністю селену (Лобанов А.В., співавт., 2009). Наприклад, водні організми характеризуються тим, що мають найбільші селенопротеоми. Навпаки, у наземних організмах кількість селенопротеїдів помітно нижча. Однією з найважливіших гіпотез, що пояснюють цю ситуацію, є те, що антиоксидантна функція селенопротеїнів відіграє ключову роль у захисті клітин від високих концентрацій кисню (Jakupoglu C et al, 2005). Одним із наслідків переходу до наземного середовища існування є обмежений доступ кількох важливих елементів, таких як селен, який значно менший. В результаті багато наземних організмів, таких як вищі рослини, дріжджі, гриби та певні види тварин, втрачають сімейства селенопротеїнів або замінюють їх гомологами, що містять цистеїн (Лобанов А.В. та ін., 2009).
Більшість виявлених селенопротеїдів мають родове походження і в основному генеруються протягом еволюції внаслідок дублювання генів. Анотація геномів, застосування біоінформаційних методів для прогнозування нових селенопротеїдів та моделі філогенетичної реконструкції дозволили охарактеризувати 45 сімейств селенопротеїдів у хребетних, 20 з яких генеруються внаслідок дублювання існуючого селенопротеїну та 6 є частиною родовий селенопротеом (Mariotti M et al., 2012) (Малюнок 5). Це ж дослідження робить висновок, що селенопротеом ссавців залишався відносно стабільним і складається загалом з 28 сімейств, до 25 генів, що кодують селенопротеїни для кожного виду ссавців. Подібним чином, 21 загальний селенопротеїн ідентифікований у всіх хребетних, тоді як решта зустрічаються лише у певних лініях. Це показує можливе походження селенопротеїдів, включаючи розмноження генів та заміщення цистеїном.
Малюнок 5. Еволюція селенопротеома хребетних. Родові селенопротеїни позначені червоним кольором, а їх еволюційні зміни відображаються філогенетичним деревом. Підкреслені селенопротеїни є унікальними для хребетних, тоді як зелений колір вказує на утворення нового селенопротеїну шляхом розмноження генів. Селенопротеїни, втрачені по всій лінії, позначені сірим кольором, а випадки, коли відбулося заміщення гомологом цистеїну, позначені синім кольором (Mariotti M et al, 2012).
Анотація та прогнозування
На закінчення, аналіз секвенсованих геномів, що дозволяють аналізувати присутність і розподіл селенопротеїнів разом із детальним вивченням їх філогенезу, призведе до кращого розуміння функції та значення селенопротеїдів у фізіології та патології людини.
Macaca nemestrina
Південна свиняча макака (Macaca nemestrina) - вид примару катарин із родини Cercopithecidae. Населяє Малайський півострів, Борнео, Суматру та острів Бангка. Це середня за розміром всеїдна макака, яка мешкає переважно в лісах, але з просуванням людини вона також зустрічається на плантаціях і в садах. Раніше підвидами цього таксону зараз є види: Макака леоніна (північна свиняча макака), Macaca pagensis (макака Пагай) і Макака сиберу (макака Сиберут). Для отримання додаткової інформації натисніть тут.