реферат
Головний
Останні дані свідчать про те, що запальні цитокіни відіграють певну роль у патогенезі НЕ. Підвищений рівень IL-6 та IL-8 у спинномозковій рідині у доношених новонароджених корелював із більш важкою енцефалопатією (1). У новонароджених, народжених від матерів із клінічним хоріоамніонітом, найвищий рівень IL-6, IL-8 та RANTES вимірювали у новонароджених, у яких були НЕ та/або судоми (2). Запальна реакція новонароджених може також впливати на результат неврологічного розвитку, оскільки підвищений вміст цитокінів у новонароджених з НЕ корелює з раннім результатом (1). Цитокіни новонароджених у сироватці крові (IL-1, IL-8, IL-9, TNF-α та RANTES) також були значно вищими у дітей, у яких пізніше розвинувся церебральний параліч (ХП) (3, 4).
Однак зв'язок цитокінів з метаболізмом головного мозку у новонароджених, травмами мозку та довгостроковими когнітивними та руховими наслідками при НЕ не встановлений. Метою цього когортного дослідження було визначити, чи пов'язані рівні новонароджених цитокінів у сироватці крові з 1) показниками метаболізму мозку, оціненими за допомогою 1H-MRS, 2) відхиленнями, що відповідають МРТ, та 3) неврологічними результатами розвитку, оціненими методами розвитку та нейромотора ... оцінка протягом 30 місяців.
методи
Предмети.
Ця когорта була отримана під час проспективного дослідження для визначення предикторів неврологічного розвитку МРТ у новонароджених із довгостроковим та короткочасним ризиком розвитку НЕ. Згодом новонароджених, які потрапили до розплідника інтенсивної терапії UCSF та асоційованої регіональної лікарні, обстежили в період з жовтня 1993 р. По січень 2000 р., Щоб зарахувати 125 новонароджених з принаймні одним із наступного: 1) артерія пуповини рН 10; 3) оцінка Апгара ≤ 5 на 5 хвилинах життя; або 4) очевидний NO за оцінкою неонатолога (рис. 1). Новонароджених виключали, якщо їхній термін вагітності був 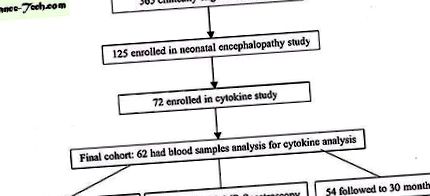
Блок-схема, що ілюструє формування когорти.
Повнорозмірне зображення
Цитокіни.
Стан новонароджених.
Огляд клінічного випробування включав інформацію, необхідну для аналізу рівня цитокінів: плацентарну або неонатальну інфекцію, переливання крові новонароджених, лікування ECMO або материнськими стероїдами, а також оцінки для гострої фізіології новонароджених - збільшення перинаталу (SNAP-PE) як загальний показник системного захворювання тяжкість протягом перших 24 годин прийому.
Дані магнітного резонансу.
З 62 новонароджених у дослідженні цитокінів 61 досліджували за допомогою МРТ головного мозку; 1 новонароджений був клінічно нестабільним для візуалізації. З цього 61 новонародженого також було проведено 42 H-MRS (1 H-MRS було включено до протоколу дослідження в 1995 р.) (Рис. 1). Той самий МР-сканер та методи були використані для всієї когорти. Новонароджених знімали із середнім рівнем життя 6 діб (діапазон 2-16 діб), коли вони були клінічно стабільними для безпечної передачі на МР-сканер та доступний час візуалізації.
МРТ головного мозку у всіх новонароджених включала сагітальне та аксіальне спінове відлуння 4 мм (1 мм зазору) [час повторення 500/11/2 (TR)/час ехо (TE)/збудження] та осьове спінове відлуння 4 мм (зазор 2 мм) ( 3000/60, 120/1) цілий мозок. Аномалії МРТ на Т1- і Т2-зважених послідовностях оцінювались за допомогою системи, описаної вище, для визначення результату нейромотора (6) в ДГН наступним чином: 0 = нормальний ДГН або ізольований вогнище інфаркту кори; 1 = аномальний сигнал в таламусі; 2 = аномальний сигнал у таламусі та ядрі сочевиці; 3 = аномальний сигнал у таламусі, сочевицеподібному ядрі та перилоландичній корі; і 4 = більш широке з'єднання. Висновки в WS оцінювались наступним чином: 0 = нормальний WS; 1 = одиночний вогнищевий інфаркт; 2 = ненормальний сигнал в передній або задній частині білої речовини; 3 = аномальний сигнал у передній або задній частині кори головного мозку та білої речовини; 4 = аномальний сигнал у передній та задній зонах басейну річки; і 5 = більш широке ураження кори. Для аналізу використовувались максимальні бали в будь-якій послідовності для обох регіонів.
1 H-MRS може бути використаний для виявлення підвищення рівня лактату (лактату/холіну), що вказує на порушення метаболічного метаболізму в окисному процесі мозку та зниження рівня NAA (NAA/холін), що свідчить про затримку дозрівання клітин, пошкодження клітин, дисфункція або смерть (7). Спектри протонів були отримані з DGN та фронтальної зони басейну (5 см 3 вокселя) (рис. 2), оскільки ці регіони особливо схильні до травм новонароджених (8). 1 H-MRS проводили з використанням методики точкової роздільної спектроскопії (PRESS) для отримання тривалих часових спектрів із луною PROBE (PROton Brain Exam; General Electric Medical Systems, Milwaukee, WI) за 5 хвилин з TR = 2 с, TE = 288 мс і загалом 128 придбань, як описано вище (9). Після отримання дані 1H-MRS були передані в автономному режимі та проаналізовані на робочій станції SPARC (Sun Microsystems, Mountain View, CA). Дані 1 H-MRS були перетворенням Фур'є та базовим рівнем. Пікові поверхні були інтегровані для холінового, креатинового, NAA та лактатного резонансів.
(A) Розташування вокселів 1H-MRS перекриває осьові зображення МР мозку Т2 терміна новонароджений (вікно). Voxel DGN містить сочевицеподібні ядра, вентролатеральний таламус і задню кінцівку внутрішньої капсули. Voxel WS містить переважно підкіркову білу речовину в області між розподілом передньої мозкової артерії та середньої мозкової артерії. (B) Репрезентативні протонні спектри новонародженого з нормальним неврологічним розвитком (вокселі, як показано, PRESS-методи TR 2 с, TE 288 мс та 128 придбань). Зверніть увагу на відсутність піку лактату, а також на тому, що амплітуда піку NAA знаходиться між зазорами піків холіну (Cho) та креатину (Cre). (C) Репрезентативні протонні спектри новонародженого з аномальним неврологічним розвитком (вокселі, як показано, PRESS-методи TR 2 с, TE 288 мс та 128 придбань). Зверніть увагу на наявність лактатного дублету та відносне зменшення піку NAA порівняно із спектром у B.
Повнорозмірне зображення
Експертизи розвитку.
Дитячі неврологи, засліплені інформацією щодо новонароджених, призначеною НМС при стандартизованих обстеженнях: 0 = нормальний; 1 = аномальний тон або рефлекси або примітивні рефлекси; 2 = аномальний тонус і рефлекси; 3 = зниження потужності та відхилення від тону; 4 = ураження черепно-мозкового нерва та будь-яка рухова аномалія; 5 = ураження черепного нерва та спастичний квадрипарез; і 6 = смерть (10). Когнітивний розвиток задовільно зафіксовано для кожної дитини за допомогою тесту MDI за шкалою Бейлі для розвитку дитини II (11). Дванадцятимісячні (n = 60) та 30-місячні (n = 54) результати нейророзвитку апріорі класифікувались як функціонально нормальні, якщо MDI> 70 та нейромоторні показники 0,5 (5). Хоча не можна було взяти зразки крові для 10 новонароджених, які брали участь у дослідженні цитокінів, ці новонароджені мали подібний розподіл пошкоджень на МРТ у порівнянні з 62 новонародженими, у яких були проаналізовані точки крові (усі р> 0,2).
Характеристика немовлят та матерів.
Цитокіни.
Кров відбирали для аналізу на цитокіни при середньому значенні 2d життя (діапазон 1-8 д). Тільки у одного новонародженого була взята кров через 8 днів (d 17); видалення цього новонародженого не змінило результатів подальших аналізів. Концентрації цитокінів не корелювали з днем життя, коли збирали кров (p> 0, 1). Рівні цитокінів у 12 новонароджених, яким переливали кров до отримання зразків п’яти, суттєво не відрізнялися від рівня, виміряного в решті когорти (р> 0,6). На додаток до IL-13, цитокіни суттєво корелювали між собою (табл. 1).
Стіл в натуральну величину
Дані МР.
Лактат/холін суттєво підвищувався при IL-1β, IL-6, IL-8 та TNF-α у DGN, але не в зоні WS, коригуючи день забору крові та виконуючи МР (табл. 2). ). Асоціація залишалася значною без змін (рис. 3). IL-9, IL-12 та IL-13 не були пов'язані з лактатом/холіном в жодній області. Виміряні цитокіни не асоціювались з NAA/холіном (табл. 2). Подібним чином рівні цитокінів не асоціювались зі структурними показниками МРТ (усі р> 0,05). Однак структурні показники МРТ суттєво корелювали з лактатом/холіном та NAA/холіном у кожній відповідній області (p
Асоціація між цитокінами новонароджених та сироватковим лактатом/холіном у ДГН. В односторонньому аналізі рівень лактату/холіну збільшувався із IL-1β (p = 0,05), IL-6 (p = 0,007), IL-8 (p = 0,01) та TNF-α (p = 0,01). Вилуплені області представляють 95% довірчий інтервал.
Повнорозмірне зображення
Нейророзвиток.
З 54 дітей з неврологічним розвитком через 30 місяців у 20 спостерігався аномальний результат (табл. 3): 3 померли від ускладнень від НЕ до досягнення 6-місячного віку, 4 мали поодинокі когнітивні порушення (усього 80 МДІ; = 3 у трьох і NMS = 5 у двох дітей) і 8 мали змішані когнітивні та рухові аномалії (загальний MDI ≤ 50; NMS = 3 в одного, NMS = 5 у семи). З 8 дітей, втрачених під час спостереження у віці 30 років, 5 показали нормальний та 1 ненормальний неврологічний розвиток у 12-місячному дослідженні, а 2 не були оцінені. Загалом спостерігалося зменшення середніх значень MDI з 12 до 30 міс, але не середніх показників нейромотора (табл. 4). Зокрема, у семи дітей із нормальним результатом через 12 місяців стан знизився: у трьох було ізольоване моторне русло, а у чотирьох - когнітивні аномалії через 30 місяців. Двоє дітей з ізольованими пошкодженнями мотора через 12 місяців не виявили пошкоджень через 30 місяців. З 10 дітей зі змішаними аномаліями через 12 місяців 1 мав ізольовану когнітивну функцію, 1 мав ізольоване рухове порушення та 8 все ще мав змішані аномалії через 30 місяців. Жодному з дітей зі змішаними відхиленнями у віці 12 місяців пізніше діагноз не був нормальним.
Стіл в натуральну величину
Стіл в натуральну величину
Діти з аномальним 30-кратним результатом захворювання мали більш важкий НЕ і частіше мали судоми новонароджених та кесарів розтин, ніж діти з нормальним результатом (табл. 3).
Одне новонароджене з доведеним неонатальним сепсисом мало аномальний результат. Рівні його цитокінів знаходились у нижньому діапазоні групи аномальних результатів, і його вилучення з аналізу не змінило результатів.
Рівні IL-1β, IL-6 та IL-8 у новонароджених були значно вищими у дітей з аномальними результатами через 30 міс порівняно з пацієнтами з нормальним неврологічним розвитком (табл. 5). На відміну від цього, рівень IL-12 був нижчим у новонароджених із пізнішим аномальним результатом.
Стіл в натуральну величину
ОБГОВОРЕННЯ
У разі НЕ збільшення запальних цитокінів у сироватці новонароджених було пов’язано з порушенням окисного метаболізму головного мозку новонароджених та аномальним неврологічним результатом у віці 30 місяців. Це узгоджується з нашим попереднім спостереженням у цій когорті, що рівень цитокінів у новонароджених був підвищений у дітей з аномальними нейромоторними наслідками у віці 12 місяців (3).
Подібним чином інші виявили, що рівні IL-6 та IL-8 у спинномозковій рідині (СМЖ) у новонароджених, що народилися, корелюють зі ступенем енцефалопатії, а рівні IL-6 - із результатами (1). Наші висновки підтверджують нещодавні дослідження новонароджених із NE, які показали високий рівень IL-6 у плазмі та високий рівень IL-6 та TNF-α порівняно з контролем. Високі співвідношення ліквору/плазми цих цитокінів свідчать про те, що вони виробляються в ЦНС на додаток до їх транспорту через гематоенцефалічний бар’єр (12). Терміни немовлята, народжені від матерів з клінічним хоріоамніонітом, досягали найвищих плазмових концентрацій IL-6, IL-8 та RANTES, коли вони виявляли НЕ та/або судоми (2).
Наскільки нам відомо, це перше дослідження, яке досліджувало зв'язок системних маркерів запалення з анаеробним метаболізмом мозку у новонароджених людей після гіпоксії-ішемії. На тваринних моделях бактеріального менінгіту, де анаеробний метаболізм також відбувається в ЦНС, TNF-α та IL-1β корелюють з рівнем лактату ліквору (26), а TNF-α збільшує лактоацидоз у спинномозковій рідині за рахунок зменшення мозкового споживання кисню та мозкової крові потік (27). Пов’язаність цитокінів з окислювальним стресом підтверджується нашими спостереженнями про те, що прозапальні цитокіни пов’язані з підвищеним вмістом лактату в ДГН, але не в зоні ЗЗ. Магнітно-резонансні дослідження у новонароджених із СЕ показують, що DGN є найбільш вразливою областю (8, 28, 29), що відповідає просторовому розподілу лактату, виміряному за допомогою 1H-MRS (9, 30). Виміряні цитокіни не були пов'язані зі структурними відхиленнями, виявленими за допомогою МРТ. Можливо, що ранні неонатальні дослідження МР недостатньо чутливі для виявлення легких структурних пошкоджень.
Наявність судом у новонароджених у новонароджених енцефалопатів є надійним показником поганого неврологічного результату (31, 32). Як було показано вище, збільшення тяжкості судом новонароджених було незалежно пов'язане зі структурними пошкодженнями та підвищенням рівня лактату/холіну в глибоких зонах сірої речовини та басейнів (33). Рівні цитокінів не були пов'язані з тяжкістю судом новонароджених, і тому зв'язок цитокінів із порушенням метаболізму мозку навряд чи може бути плутаною наявністю судом.
Наш висновок про те, що підвищені цитокіни новонароджених пов'язані з неврологічним розвитком, узгоджується з висновками Нельсона та співавт. (4) більш високий рівень IL-1β, IL-8, IL-9, TNF-α та RANTES у більшості новонароджених, у яких пізніше розвинувся церебральний параліч (ХП). Однак у дуже недоношених немовлят рівень цитокінів у новонароджених не диференціював ХП та немовлят (34). Нещодавнє дослідження 78 біомаркерів та недоношених дітей, виміряних термінами, яке згодом розвинулося, показало, що характер запальних маркерів відрізнявся у двох популяціях (35), припускаючи, що шляхи, що відповідають за зміну зрілості мозкової травми. Наше попереднє дослідження нинішньої 12-місячної когорти показало, що діти з аномальними нейромоторними наслідками мали підвищений рівень новонароджених IL-6, IL-8 та IL-9 порівняно з дітьми з нормальним руховим розвитком (3). Наше поточне дослідження у віці 30 років виявило зв'язок маркерів запалення новонароджених з нейророзвитком, які включають когнітивні результати на додаток до когнітивних результатів, оскільки НЕ може призвести до погіршення у кожній із цих областей.
Хоча точність і надійність вимірювання спектру речовин в архівних зразках крові новонароджених була визначена раніше (3, 4), недоліком цього методу є те, що він дає лише картину запального каскаду під час забору крові. Широке часове вікно забору крові (1 - 8 днів) та дослідження МР (2 - 16 днів) є обмеженням поточного дослідження, хоча це вимірювання вплинуло на наші результати щодо нульової гіпотези. Завдяки цьому відхиленню вимірювань ми можемо недооцінювати або не враховувати зв'язок між цитокінами сироватки крові та метаболізмом мозку або неврологічним розвитком. Враховуючи кількість виміряних цитокінів, важливо відзначити узгодженість асоціації рівнів цитокінів з лактатом/холіном у DGN, а не в регіоні WS. Через велике перекриття розподілу рівнів цитокінів між нормальними та аномальними вихідними групами, ці запальні маркери, окремо, не є сильними прогностичними предикторами результатів неврологічного розвитку. Подальше тестування за допомогою серійних біомаркерів та заходів МРТ необхідне для оцінки взаємозв'язку про- та протизапальних маркерів із часом пошкодження та як ці маркери взаємопов'язані та змінюються з часом.
У когортному дослідженні ми не можемо довести причинно-наслідковий зв’язок між запальним середовищем, НЕ та подальшим ураженням нервової системи. Взаємозв'язок між цими факторами може відрізнятися від системної неонатальної інфекції або хоріоамніоніту. Потрібні подальші дослідження, щоб вивчити, чи покращить модуляція цього шляху в терміні новонароджена людина когнітивні та рухові результати.
скорочення
глибокі сірі ядра
екстракорпоральне окислення мембрани
протонно-магнітно-резонансна спектроскопія
- Захоплюючі результати досліджень Печиво викликає більше звикання, ніж кокаїн
- Нормативне фінансування Міністерство освіти, науки, досліджень та спорту Словацької Республіки
- Вони знайшли м’ясо бразильського походження Подбрезован
- Алмазна шахта затоплена в Сибіру (Росія) Доля 9 гірників незрозуміла
- Захоплюючі знахідки вчених Цей напій дуже небезпечний для жінок!
