реферат
Ендоморфін-2 (Tyr-Pro-Phe-Phe-NH 2; EM-2) та ендоморфін-1 (Tyr-Pro-Trp-Phe-NH 2; EM-1) виділяють із великої рогатої худоби (Zadina et al, 1997) як і мозок людини (Hackler et al., 1997) і вважаються ендогенними лігандами для му-опіоїдного рецептора (Goldberg et al., 1998; Zadina et al., 1997). Імунореактивність EM-2 та EM-1 помітно присутня в районах, де зосереджені рецептори мю. Великі кількості EM-2-подібної імунореактивності (Schreff et al., 1998) та EM-1-подібної імунореактивності (Martin-Schild et al., 1999) були виявлені в nucleus accumbens (NAc), що містить різні підтипи опіатів . рецептори (му-, каппа та дельта-опіоїдні рецептори). Фармакологічно ці два ендоморфіни є потужними анальгетиками та мають подібні властивості (Goldberg et al., 1998). І EM-2, і EM-1 виробляють чутливі до налоксону антиноцицепції короткої дії під час тесту на хвостик (Stone та ін., 1997). Однак дослідження фармакологічного втручання також показали, що механізми дії двох ендоморфінів не є повністю ідентичними. Таким чином, антиноцицептивний ефект EM-2 більш чутливий до налоксоназину, ніж EM-1 (Sakurada et al, 1999, 2000, 2001, 2002). Дослідження Sakurada et al. Припустили, що EM-2 діє переважно як агоніст mu1-опіоїдного рецептора, а EM-1 як агоніст mu2-опіоїдного рецептора.
Активація му-опіоїдних рецепторів у NAc індукує велике і швидке збільшення викиду накопичувального дофаміну. Таким чином, фентаніл, агоніст мю-рецепторів, збільшує оборотний витік налоксону α-дофаміну дофаміну (Yoshida et al, 1999). Здатність EM-2 та EM-1 змінювати позаклітинну кількість накопиченого дофаміну у вільно рухаються щурів не вивчалась. Таким чином, ми проаналізували вплив EM-2 та EM-1 на позаклітинну кількість дофаміну в NAc вільно рухаються щурів, використовуючи нещодавно вдосконалену техніку мікродіалізу, що дозволяє здійснювати моніторинг дофаміну в режимі он-лайн з часовою роздільною здатністю 5 хв. 20 хв (Saigusa et al., 2001; пор. Fusa et al., 2002, 2005; Murai et al., 1994; Saigusa et al., 1997, 1999; Takada et al., 1993; Tomiyama et al., 1993 ., 1995).
ЕКСПЕРИМЕНТАЛЬНІ ПРОЦЕДУРИ
На початку експерименту використовували самців щурів Sprague-Dawley (NRC Haruna, Японія) вагою від 200 до 220 г. Їх поміщали в середовище з контрольованою температурою в 12-годинний цикл світло-темрява (період світла 0700-1900 год) із вільним доступом до їжі та води.
хірургія
Щурів знеболювали пентобарбітоном натрію (50 мг/кг, внутрішньочеревно (ip)). Знеболених тварин поміщали в стереотаксичний пристрій, а направляючу канюлю (AP 10,6 мм, ML 1,5 мм, DV 4,0 мм від інтерауральної лінії; Paxinos and Watson, 1998) імплантували трохи вище лівого NAc відповідно до описаних вище процедур (Fusa та ін., 2002, 2005; Сайгуса та ін., 1997, 1999, 2001). Щоб уникнути шлуночкової системи, канюлі, спрямовані на NAc, були нахилені на 18 ° від середньої сагітальної площини. В кінці операції щурам дозволяли відновлюватися за 7-10 днів до експериментів; направляючі канюлі були запатентовані за допомогою вставок з нержавіючої сталі. Кожну тварину використовували лише один раз. Експерименти проводились згідно з інституційними, національними та міжнародними рекомендаціями щодо догляду та добробуту тварин. Були зроблені всі зусилля, щоб мінімізувати страждання тварин і зменшити кількість тварин, що використовуються.
Діаліз та нейрохімічні вимірювання
наркотики
Використовувались препарати EM-2 (Peptide Institute Inc., Осака, Японія), EM-1 (Peptide Institute Inc., Осака, Японія), TTX (Sigma-RBI, St. Louis, MO, USA), CTOP (Sigma -RBI Сент-Луїс, Міссурі, США), налоксон (Sigma-RBI, Сент-Луїс, Міссурі, США) та налоксоназин (налоксоназин дигідрохлорид; Sigma-RBI, Сент-Луїс, Міссурі, США). EM-2, EM-1 і CTOP розчиняли у модифікованому розчині Рінгера. EM-2 та EM-1 вводили через діалізну мембрану протягом 25 хвилин, тоді як CTOP аналогічним чином вводили протягом 50 хвилин (починаючи за 25 хвилин до інфузії EM-2 та EM-1). Блокатор натрієвих каналів TTX також розчиняли у модифікованому розчині Рінгера для перфузії та вводили внутрішньомозково через діалізний зонд. Налоксон розчиняли у фізіологічному розчині. Налоксоназин суспендували у 2,5% розчині Твін-80 і вводили за 24 години до початку інфузії ЕМ-2. Використані дози базувались на результатах вищезазначених експериментів (EM-2 та EM-1: Sakurada et al., 2001; TTX: Fusa et al., 2002; Saigusa et al., 2001; Takada et al., 1993; Tomiyama et al. Та співавт., 1993, 1995, CTOP: Yoshida et al., 1999, налоксон: Yoshida et al., 1999, налоксоназин: Piepponen and Ahtee, 1995). Дозовані дози EM-2 та EM-1 являли собою кількість (нмоль) сполук за 25 хвилин перфузійної рідини (50 мкл), а доза CTOP - кількість сполуки за 50 хвилин перфузійної рідини (100 мкл).
гістологія
В кінці експерименту щурів глибоко знеболювали пентобарбітоном натрію (50 мг/кг, в/в) і промивали транскардально 10% розчином формальдегіду. Мозок видалили, розділили (50 мкм) і пофарбували крезилфіолетовим, щоб забезпечити розміщення зонда.
Статистичний аналіз
Всі значення були виражені у відсотках до базових рівнів. Порівняння даних курсу часу проводили за допомогою двостороннього ANOVA (дисперсійний аналіз) для повторних вимірювань із лікуванням та факторами часу (повторний). Статистичну значимість вважали P 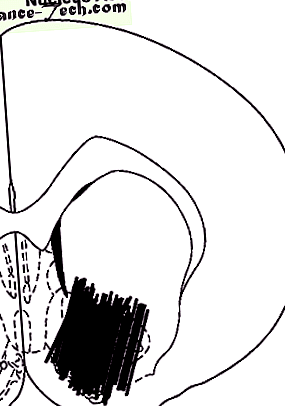
Схематичне зображення розташування зонда в NAc. Діаграма взята з Атласу Паксіноса та Ватсона; число представляє передню відстань (мм) від міжвушкової лінії.
Повнорозмірне зображення
Базальний рівень позаклітинного дофаміну в NAc
Початкова концентрація дофаміну в діалізатах NAc становила 1,0 ± 0,05 пг/5 хв (середнє значення ± SEM; n = 159).
Вплив перфузії EM-2 та EM-1 на позаклітинний рівень дофаміну в NAc
25-хвилинна інфузія або EM-2 (малюнок 2a; 5 нмоль (n = 7), 25 нмоль (n = 6) і 50 нмоль (n = 6)) або EM-1 (малюнок 2b; 5 нмоль (n = 6 )), 25 нмоль (n = 6) і 50 нмоль (n = 6) до NAc викликали дозозалежне збільшення рівня позаклітинного дофаміну залежно від дози: ці ефекти тривали приблизно 10–35 хвилин (EM-2 - лікування F (2, 96) = 84, 92, P
а) Ефекти інфузійного введення (n = 6, заповнені діамантами), 5 нмоль ЕМ-2 (n = 7, відкриті квадрати), 25 нмоль ЕМ-2 (n = 6, заповнені трикутники) і 50 нмоль ЕМ-2 2 (n = 6, відкриті кола) до NAc на базальному рівні позаклітинного дофаміну (DA) у NAc. Дані виражаються як середня зміна протягом 5-хвилинних періодів спостереження після початку 25-хвилинної інфузії ЕМ-2. Вертикальні лінії позначають SEM. Заповнений стовпчик над віссю х позначає час вливання транспортного засобу або EM-2. б) Ефекти інфузійного введення (n = 6, заповнені діамантами), 5 нмоль ЕМ-1 (n = 6, відкриті квадрати), 25 нмоль ЕМ-1 (n = 6, заповнені трикутники) і 50 нмоль ЕМ-1 1 (n = 6, відкриті кола) до NAc на базальному рівні позаклітинного дофаміну (DA) у NAc. Дані виражаються як середня зміна 5-хвилинних періодів спостереження після початку 25-хвилинної інфузії ЕМ-1. Вертикальні лінії позначають SEM. Заповнений стовпчик над віссю х позначає час вливання транспортного засобу або EM-1.
Повнорозмірне зображення
Нейрональна залежність перехідного збільшення EM-2 та EM-1 перехідного збільшення викиду дофаміну в NAc
TTX (2 мкМ), що вводився протягом 2 годин через діалізний зонд, знижував базальний рівень DA приблизно на 70%. Ця інфузія ТТХ майже повністю скасувала ЕМ-2 (50 нмоль; n = 6; Малюнок 3a; лікування F (1, 60) = 421, 58: P
(а) Вплив перфузії 2 мкМ TTX на 25-хвилинну інфузію 50 нмоль ЕМ-2, спричинене підвищенням рівня DA (дофаміну) в NAc (n = 6, відкриті трикутники). Дані виражаються як середня зміна протягом 5-хвилинних періодів спостереження після початку 25-хвилинної інфузії ЕМ-2. Вертикальні лінії позначають SEM. Відкритий стрижень над віссю х показує період перфузії ТТХ, який розпочався за 120 хвилин до початку інфузії EM-2. Заповнений рядок вказує час інфузії ЕМ-2. (b) Вплив перфузії 2 мкМ TTX на 25-хвилинну інфузію 50 нмоль ЕМ-1, спричинене підвищенням рівня DA (дофаміну) в NAc (n = 6, відкриті трикутники). Дані виражаються як середня зміна 5-хвилинних періодів спостереження після початку 25-хвилинної інфузії ЕМ-1. Вертикальні лінії позначають SEM. Відкритий стрижень над віссю х показує період перфузії ТТХ, який розпочався за 120 хвилин до початку інфузії EM-1. Заповнений рядок вказує час інфузії ЕМ-1.
Повнорозмірне зображення
Вплив антагоніста Mu-опіоїдного рецептора на транзиторне збільшення витоку дофаміну, викликаного EM-2- та EM-1 у NAc
Перфузія NAc з антагоністом мю-опіоїдних рецепторів CTOP (3 нмоль; n = 6) не впливала на внутрішньо накопичену інфузію збільшення збільшення накопичення дофаміну, викликаного EM-2 (50 нмоль; n = 6). (Рисунок 4a; обробка F (1, 57) = 3, 28, P = 0,08; час F (5, 57) = 5, 30, P
Повнорозмірне зображення
Вплив налоксону на тимчасове збільшення потоку дофаміну, викликане EM-2- та EM-1 у NAc
Як показано на малюнку 5а, налоксон (1 мг/кг, в/в, вводиться за 20 хвилин до внутрішньомозкової перфузії), який сам по собі суттєво не впливав на базальний рівень накопиченого дофаміну (дані не показані), не впливав на EM-2 (50 нмоль ) - індуковане підвищення рівня дофаміну в NAc (n = 6). Для збільшення очікуваної ефективності налоксону налоксон вводили 10 замість 20 хвилин до введення ЕМ-2; Налоксон знову був повністю здатний пригнічувати вплив EM-2 (50 нмоль) на рівень дофаміну в NAc (рис. 5b, n = 9). Як згадувалося вище, 25 нмоль ЕМ-1 дає ефекти більш-менш порівнянні з ефектами 50 нмоль ЕМ-2. Тому ми спочатку перевірили здатність налоксону (1 мг/кг, внутрішньовенно, внутрішньовенно, що вводиться за 10 хвилин до внутрішньомозкової перфузії), яка сама по собі не суттєво впливала на базальний рівень накопиченого дофаміну (дані не показані), антагонізувати 25 нмоль ЕМ -1 . Це лікування значно зменшило індуковане ЕМ-1 підвищення рівня дофаміну (25 нмоль) у NAc, особливо в початковий період від 10 до 30 хвилин (n = 9; Рисунок 5c; лікування F (1, 78) = 42, 49, P
Повнорозмірне зображення
ОБГОВОРЕННЯ
Раніше ми показали, що базові рівні дофаміну в NAc значною мірою залежать від активності нейронів, оскільки понад 70% вивільнення дофаміну чутливе до ТТХ (Saigusa et al, 2001). Отже, вважається, що базальний дофамін, виміряний у цьому дослідженні, головним чином обумовлений вивільненням дофаміну нейронами.
Внутрішньоакральна інфузія ЕМ-2 та ЕМ-1 дозозалежно підвищувала рівень дофаміну-діалізату у щурів NAc. Кількісна різниця спостерігалась між ефектами EM-2 та EM-1 на індукцію збільшення збільшення накопичення дофаміну. Таким чином, здатність EM-2 підвищувати накопичений рівень позаклітинного дофаміну була набагато меншою, ніж здатність EM-1 при тестуванні на широкий діапазон доз (5, 25 і 50 нмоль). Максимальні ефекти інфузії ЕМ-2 та ЕМ-1 з найвищою дозою (50 нмоль) були майже повністю придушені внутрішньо накопиченою інфузією ТТХ (2 мкМ), що свідчить про те, що в сучасних експериментальних умовах збільшення рівня накопиченого дофаміну, спричиненого ЕМ-2 і ЕМ-1 повністю залежали від активності нейронів. Як обговорюється нижче, ефекти EM-1 опосередковувались механізмами, які повністю відрізняються від механізмів, що опосередковують ефекти EM-2. Отже, відмінності в ефективності між EM-1 та EM-2 не можна просто пояснити різницею в спорідненості та/або власній активності, а різницею у механізмах.
У сукупності це дослідження показує, що внутрішньо накопичена інфузія EM-2 та EM-1 збільшує витік дофаміну в NAc за абсолютно різними механізмами. Хоча ефекти як EM-2, так і EM-1 залежать від активності нейронів, ефекти EM-2 не можуть бути заблоковані за допомогою ефективної дози селективного антагоніста муопіоїдних рецепторів CTOP або специфічного антагоніста опіоїдного рецептора налоксону, на відміну від ефекти EM-1, які були дуже ефективно придушені. CTOP, налоксоназин та налоксон. Було зроблено висновок, що ефекти EM-2 не опосередковуються через чутливі до налоксону опіоїдні рецептори, на відміну від ефектів EM-1, які опосередковуються mu1-опіоїдними рецепторами в NAc.
Дякую
Це дослідження було підтримано науковими грантами Фонду Сато (TS, NK) та Стоматологічного дослідницького центру (NK), стоматологічної школи університету Ніхон; Мультидисциплінарний дослідницький грант університету Ніхон 2005/2006 (TS, NK, ARC); грант на підтримку мультидисциплінарного дослідницького проекту (NK, ARC) та допомога на підтримку наукових досліджень (# 14 370 609 для NK та # 16 591 897 для TS) від Міністерства освіти, культури, спорту, науки та технологій, Японія; та Товариство підтримки та взаємодопомоги приватній школі Японії (SW, IT, YA, NK).
