1 лікарня НДІ 12 жовтня (i + 12) - Медичний факультет - Мадридський університет Комплютенсе (Іспанія)
З іншого боку, частота диференційованого раку щитовидної залози, експериментальної моделі пригнічення гормонів щитовидної залози шляхом профілактичної терапії рецидивів, значно зросла. Існують клінічні вказівки щодо його лікування, але очевидно, що можливі вторинні ефекти, отримані від нього, потребують точного вказівки з урахуванням співвідношення ризик-користь дозування гормонів щитовидної залози, призначених у довгостроковій перспективі, особливо у випадках низької пухлини агресивність, похилий вік і навіть у тендітних пацієнтів. Слід направити пацієнтів з високим ризиком на денситометрію кісток, щоб розглянути можливість лікування майбутніх переломів. Профілактика остеопорозу, особливо у жінок в постменопаузі, є дуже бажаною і повинна включати адекватну дієту з кальцієм та добавки вітаміну D, якщо це необхідно. Поки немає єдиної думки щодо лікування остеопорозу у пацієнта з раком щитовидної залози та супресивного лікування, але критерії, зазначені для постменопаузального остеопорозу, загалом здаються застосовними.
Ключові слова диференційований рак щитовидної залози; подвійна фотонна денситометрія; мінеральна щільність кісток; оцінка трабекулярної кістки; гіпертиреоз та субклінічний гіпотиреоз; тиреотропний гормон
За останні роки було досягнуто прогресу в регулюванні розвитку скелета та підтримці кісткової маси дорослої людини по осі гіпоталамус-гіпофіз-щитовидна залоза. Були проведені дослідження впливу гормонів щитовидної залози на остеобласти, остеокласт та хондроцити. Це дослідження призвело до кращих генетичних знань щодо фізіології клітинної дії цих гормонів. Нещодавно були запропоновані можливі втручання дезодинази D2 при остеопорозі. Зв'язок між мінеральною гідністю кісток, якістю кісток та ризиком переломів гормонами щитовидної залози у нормальних жінок у постменопаузі свідчить про роль цих гормонів, навіть у межах нормальної щитовидної залози, у цих захворюваннях.
З іншого боку, частота диференційованого раку щитовидної залози, експериментальне пригнічення гормонів щитовидної залози терапією, рецидивуючі захворювання, значно зросла. Існують посібники з управління, але очевидно, що вторинні похідні вимагають точних показників, скоригованих на баланс, співвідношення ризик-користь дозування гормонів щитовидної залози, призначених на тривалий термін, особливо у випадках низької агресивності пухлини, похилого віку та навіть у неміцних пацієнтів. Пацієнтів з високим ризиком слід направити на денситометрію кісток, щоб розглянути можливість лікування майбутніх переломів. Профілактика остеопорозу, особливо у жінок в постменопаузі, є надзвичайно бажаною і повинна включати адекватну дієту з добавками кальцію та вітаміну D, якщо це необхідно. Досі немає єдиної думки щодо лікування остеопорозу у пацієнта з раком щитовидної залози та супресивного лікування, але вказані критерії постменопаузального остеопорозу, як видається, застосовні загалом.
Ключові слова рак щитовидної залози; двофотонна денситометрія; мінеральна щільність кісток; оцінка трабекулярної кістки; гіпертиреоз та субклінічний гіпотиреоз; тиреотропний гормон
Гормони щитовидної залози (НТ) втручаються у розвиток скелета, набуття піку кісткової маси та підтримку ремоделювання кісток. Клініко-епідеміологічні дослідження показують, що як дефіцит, так і надлишок ГТ пов'язані з ризиком переломів, враховуючи, що еутиреоз необхідний для нормального функціонування кісткового ремоделювання [1].
У цій роботі ми розглянемо клітинну дію НТ на кістку, і особливо експериментальну модель in vivo надлишку та пригнічення тиреотропного гормону (ТТГ) у пацієнтів з диференційованою карциномою щитовидної залози у жінок до і після менопаузи. У чоловіків з CDT відсутні якісні поздовжні дослідження для їх аналізу.
Гормони щитовидної залози та кістки
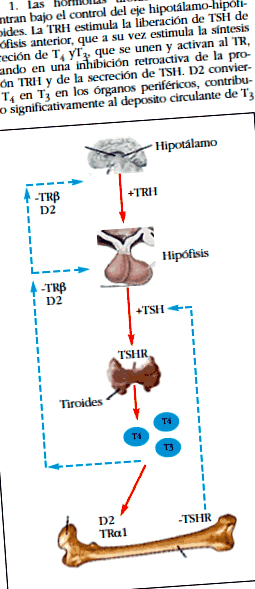
HT і кістка тісно пов'язані між собою, оскільки HT є ключовими регуляторами ремоделювання кісток. HT мають фундаментальну роль у зростанні та розвитку хребетних. HT - це йодотироніни, синтезовані в щитовидній залозі, постійна секреція яких забезпечується двома механізмами: 1) секреція HT, контрольована зворотно-активним механізмом, від осі гіпоталамус-гіпофіз-щитовидна залоза (рис. 1 і рис. 2) шляхом внутрішньоклітинної активації, регульованої Іодтироніндейодинази тканин [2].
Fig2В T3 діяв би опосередковано на остеокласт дією, опосередкованою остеобластом, можливо, індукуючи вивільнення RANKL та інтерлейкінів 6 та 8 та PGE2 на ранніх стадіях на попередників або сприяючи диференціації преостеокластів. Т3 діяв би на користь диференціації остеобласта та фаз мінералізації матриці. Можливо, що індукція транскрипції IGF-1 та його білків-транспортерів та інших факторів стимулює проліферацію та диференціацію остеобласту. На хондроцитах наявність TRО ± 1 і TRОІ1 у цій клітинній лінії дозволяє Т3 стимулювати його дозрівання, а отже, процес окостеніння ендохондральної системи. (Змінено з Wojcika et al. 4) В
Рецептори для HT
Ці три функціональні рецептори для НТ (TRО ± 1, TRОІ1 та TRОІ2) кодуються генами THRО ± і THRОІ, які регулюють їх експресію та транскрипційні реакції на TR. У кістці описана експресія TRО ± 1 і TRОІ1, перша з яких знаходиться у переважній концентрації 10: 1. Отже, вважається, що TRО ± є основним медіатором дії Т3 на кістку [6].
HT, TSH та розвиток кісток
І рецептори TRО ± 1, і TRОІ1 експресуються на хондроцитах пластини росту, припускаючи, що вони є мішенями для дії Т3. Проліферація та диференціація хондроцитів контролюється індійським їжаком, PTHrp, BMP-R1A, IGF1, Wnt та FGF. Перші три за допомогою негативного зворотного зв’язку, який індукує ріст зубного нальоту та гальмує його диференціацію, контролюючи його лінійний ріст. НТ втручаються в це регулювання, чутливе до наявності Т3, який стимулює експресію генів для синтезу хрящового матриксу та подальшої його мінералізації.
Нещодавно описана гетерозиготна мутація гена THRО ± у 6-річної дівчинки, яка, незважаючи на наявність НТ у нижній або нормальній межі та нормальний рівень ТТГ, мала затримку росту та гістологічне ураження кісток, подібне до гіпотиреозу, що передбачає важливий роль цих TRО ± рецепторів у розвитку кісток людини [10].
HT і TSH стосовно мінеральної щільності кісток та переломів у нормальній популяції
Гіпертиреоз в анамнезі є фактором ризику. У дослідженні SOF (Дослідження остеопоротичних переломів), проведеному у 192 жінок похилого віку з подальшим спостереженням 4,1 року, найвища частота остеопоротичних переломів була зафіксована у пацієнтів, які в анамнезі мали переломи та/або гіпертиреоз [п'ятнадцять]. У цьому дослідженні не було знайдено жодних доказів, що пов'язують низький рівень ТТГ з низьким МЩКТ. Автори дійшли висновку, що гіпертиреоз може або не може зменшити кісткову масу, але в їх дослідженні зменшення МЩКТ не було відповідальним за сильний зв'язок між попереднім гіпертиреозом та ризиком переломів стегна.
HT і TSH: взаємозв'язок з мінеральною щільністю кісток та переломами у жінок із порушеннями функції щитовидної залози
Таким чином, опубліковані дані вказують на те, що для демонстрації чіткої причинно-наслідкової зв’язки необхідні рандомізовані та контрольовані дослідження зі значною кількістю пацієнтів та оцінка того, чи нормалізація рівня ТТГ при субклінічному гіпертиреозі пов’язана з ризиком переломів. Дані свідчать про те, що субклінічний гіпертиреоз пов’язаний із підвищеним ризиком переломів стегна та нехребетних кісток, проте слід проаналізувати інші фактори та провести більш якісні дослідження.
HT і кісткова трабекулярна мікроархітектура
Критерії придушення ТТГ при диференційованому раку щитовидної залози
Диференційована карцинома щитовидної залози (DTC) - найпоширеніша ендокринна неоплазія (на неї припадає 1% усіх видів раку). 85-90% раків щитовидної залози - це CDT, що включає два варіанти - папілярну карциному (найпоширенішу) та фолікулярну. Захворюваність зростає протягом останніх 10 років, але смертність залишається незмінною [29]. Це збільшення значною мірою зумовлене збільшенням та покращенням роздільної здатності діагностичних тестів із більшим виявленням випадкової мікрокарциноми.
Tab1В TSH націлені на тривалу терапію гормонами щитовидної залози при диференційованій карциномі щитовидної залози. За даними Haugen BR та співавт.32В
Примітка2tab1 ** Цільовий рівень ТТГ для пацієнтів з неповною біохімічною реакцією може змінюватися залежно від початкового ризику ATA, рівнів Tg, тенденції Tg з часом та ризику придушення.
Хоча немає загального консенсусу щодо оптимальних рівнів ТТГ для зменшення рецидивів та хоча мінімізують несприятливі наслідки субклінічного гіпертиреозу, нещодавно Американська асоціація тиреоїдів (АТА) визначила вплив придушення ТТГ у пацієнтів із ЦДТ. Характеризується низьким, середнім та високим ризик рецидиву з урахуванням різних клінічних факторів [32].
Tab2В Перелік лонгітюдних досліджень щодо впливу придушення ТТГ левотироксином на мінеральну щільність кісткової тканини (МЩКТ) у жінок з раком щитовидної залози до та після менопаузи
Супресивне лікування ГТ при диференційованому раку щитовидної залози та кісток. Поздовжній проти. перерізи
п »ЇДруге розглянуте поздовжнє дослідження - дослідження Мюллера та ін. [57] Вони вивчали 15 жінок до менопаузи та 10 жінок після менопаузи на супресивному лікуванні Т4 протягом варіативного періоду 1,5 року. З цієї групи у них опинилося 24 пацієнти з DTC, переоцінені DXA з інтервалом спостереження 1,5 ± 0,5 року. Вони відібрали 15 контрольних суб'єктів, які відповідали статі, менопаузальному статусу, віку та ІМТ. Вони дійшли висновку, що придушення ТТГ супроводжувалось незначним зниженням (2-5%) МПК поперекового відділу та МЩКТ шийки стегна, без випадкових переломів. Виявлене зниження МЩКТ нижче, ніж класичне, описане Mazess, при якому підвищений ризик переломів хребців збільшується в 1,5-2 рази для кожного стандартного відхилення (SD), що зменшує МЩКТ [58], що свідчить про відсутність ефекту на цьому рівні.
З нашого досвіду [55] ми вивчили 14 жінок до менопаузи та 13 жінок до менопаузи з придушенням CDT та TSH, які спостерігались у нашій Службі після їхньої тотальної тиреоїдектомії з повторною подвійною фотонною денситометрією протягом двох років. У 50% наших пацієнтів рівень ТТГ був нижче 0,1 мМО/л. Доза LT4 показала позитивну прогностичну цінність на кожному досліджуваному місці кістки, яка майже не була описана. Жоден з досліджених кісткових та мінеральних параметрів не корелював з кістковою масою, за винятком лужної фосфатази на рівні трикутника Уорда та ультрадистального радіуса. Це узгоджується з нормальними показниками МЩКТ та ремоделювання кісток у цих пацієнтів при тривалому супресивному лікуванні. Пригнічені пацієнти продемонстрували незначне зниження МЩКТ у дистальній 1/3 променевої кістки (Z-бал = -0,77 В ± 0,98; 95 ДІ: -1,11; -0,44), без різниці між менопаузою до та після.
У вибірковій і досить великій групі пацієнтів у постменопаузі з папілярним CDT Сугітані та ін. [63] проаналізували вплив, який післяопераційна супресивна терапія ТТГ призводить до виживання без захворювань та його впливу на МЩКТ. Вони проаналізували дві групи: 140 пацієнтів із супресією (середній рівень ТТГ: 0,07 ± 0,10 мМО/л та 127 без супресії (середній рівень ТТГ: 3,14 ± 1,60 мМО/л). З групи, що не пригнічується, 120 пацієнтів жінок у постменопаузі спостерігалося протягом 5 років, демонструючи зниження поперекового МЩКТ у підгрупі жінок у постменопаузі у віці понад 50 років. більшість їх пацієнтів мали низький ризик. Зрештою вони рекомендують придушення ТТГ, особливо у пацієнтів з низьким ризиком та в пацієнтам літнього віку не слід вказувати, додатково беручи до уваги, що не було доведено зменшення рецидивів навіть у пацієнтів високого ризику.
Поздовжнє дослідження Karner та співавт. [64] проводили у жінок в пременопаузі з CDT протягом одного року. Тривалість придушення ТТГ на початку дослідження становила 9,4 ± 6,4 року, а отже, тривала. Вимірювання МЩКТ проводили двічі протягом одного року. Використовуючи SPA (однофотонна абсорбціометрія) для кінцівок та DXA, вони не виявили зниження МЩКТ на дистальному рівні радіуса, а також поперекового та/або стегна МЩКТ. Це коротке тривале дослідження з невеликою кількістю випробовуваних (19 пременопауз). Його основна рекомендація - провести дослідження денситометрії кісток перед початком супресивного лікування ТТГ для виявлення пацієнтів з високим ризиком розвитку остеопорозу.
Фактори ризику у пацієнтів із супресивним лікуванням CDT та TSH
- Через 25 років ожиріння спричинить більше раку, ніж сигарети у жінок
- Експерти зазначають, що ожиріння пов’язане з диференційованим типом раку щитовидної залози
- Гістеректомія - це варіант для жінок із ожирінням, які страждають на рак матки Diario Público
- Ефективність гормонального лікування у жінок в клімаксі, хворих на рак молочної залози, залежить від ваги
- Ожиріння подвоює ризик раку товстої кишки у жінок CuidatePlus