- Предмети
- Резюме
- Вступ
- Результати
- Раціональне проектування нового ліганду для структурних досліджень.
- Загальна архітектура багатодоменного SMO людини
- Унікальна багатодоменна взаємодія
- Порівняння SMO людини з іншими рецепторами класу завивки
- Обговорення
- Методи
- Синтез TC114
- Плавкова конструкція SMO-FLA, призначена для структурних досліджень
- Експресія та очищення злитого білка SMO-FLA
- Кристалізація в LCP для збору синхротронних даних
- Синхротронний збір даних та визначення структури
- Кристалізація в LCP для збору даних XFEL
- Збір даних XFEL та визначення структури
- Воднево-дейтерієвий обмінний мас-спектрометричний аналіз
- MD моделювання
- Підготовка білка та побудова системи.
- Молекулярно-динамічне моделювання та аналіз даних.
- Тест на сигналізацію їжака
- Вестерн-блот-аналіз
- Наявність даних
- Додаткова інформація
- Файли PDF
- Додаткова інформація
- Файл експертної перевірки
- Коментарі
Предмети
- Біологія розвитку
- Нанокристалографія
Резюме
Згладжений рецептор (SMO) належить до класу Frizzled суперсімейства рецепторів, пов'язаних з G-білками (GPCR), складаючи ключовий компонент сигнального шляху Їжачка. Тут ми представляємо кристалічну структуру багатодоменного SMO людини, зв’язаного та стабілізованого за допомогою розробленого інструмента ліганду TC114, використовуючи джерело рентгенівського лазера з вільним електроном 2,9 Å. Структура виявляє чітке розташування трьох різних доменів: семи трансмембранного домену спіралі (TMD), шарнірного домену (HD) та інтактного позаклітинного багатого цистеїном домену (CRD). Ця архітектура дозволяє аллостеричні взаємодії між доменами, які важливі для розпізнавання лігандів та активації рецепторів. Поєднуючи структурні дані, моделювання молекулярної динаміки та аналіз обміну воднем та дейтерієм, ми демонструємо, що трансмембранна спіраль VI, позаклітинна петля 3 та HD відіграють центральну роль у передачі сигналу за допомогою спускового механізму. GPCR.
Вступ
Результати
Раціональне проектування нового ліганду для структурних досліджень.
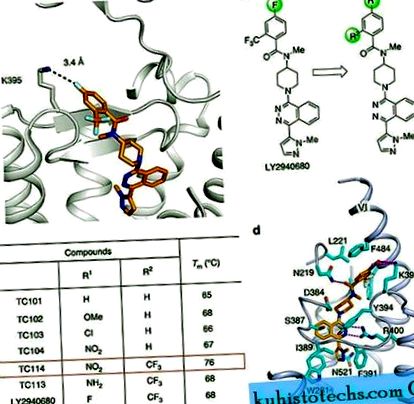
Зрізаний SMD CRD (ΔCRD-SMO) раніше був кокристалізований кількома дрібними молекулами, включаючи антагоністи та агоністи 3, 8, 9. Ці ліганди та інші не утворювали кристалів багатодоменного SMO, що містили інтактний CRD без стабілізуючих мутацій. Аналіз попередніх структур ΔCRD-SMO 3, 8, 9 дозволяє припустити, що для кристалізації багатодоменного SMO може знадобитися стабілізація деяких конкретних гнучких частин структури. Наприклад, ми виявили, що K395, розташований у верхній частині β шпильки у позаклітинній петлі 2, може брати участь у взаємодії із сусідніми залишками або лігандами 3, і тому, ймовірно, приймає динамічний конформаційний стан (рис. 1а). Тому ми висуваємо гіпотезу, що подальша стабілізація цього регіону шляхом встановлення визначеної та сильнішої взаємодії може зменшити конформаційну неоднорідність.
( до ) Збільшений вид кишенькової підшивки LY2940680 у структурі ΔCRD - SMO (PBD ID: 4JKV). ( b ) Розробка та еволюція аналогів LY2940680 для дослідження кристалізації шляхом варіації заступників на ароматичному кільці. ( c ) Репрезентативні значення Tm для LY2940680 та його аналогів згідно з тестом теплообміну CPM. ( d ) Крупний вид кишенькової палітурки TC114. TC114 (помаранчеві вуглеці) та залишки SMO (блакитні вуглеці), що беруть участь у зв’язуванні лігандів, показані у вигляді стовпчика. Приймач зображений у блакитному блакитному мультфільмі. Інші елементи забарвлені наступним чином: кисень, червоний; азот, темно-синій; сірка, жовта. Водневі зв’язки показані штриховими пурпуровими лініями.
Повнорозмірне зображення
Аналіз наших багатодоменних SMO-структур показав, що нітрогрупа, введена в ліганд TC114, сильно взаємодіє з K395 в SMO, як було розроблено, та покращує укладання π - π між бензоїльною групою та F484 у спіралі VI (рис. 1г). Отже, ми робимо висновок, що TC114 стабілізує багатодоменний SMO, підтримуючи спіраль VI у стабільній конформації, що, у свою чергу, посилює гідрофобну взаємодію між розширеною ECL3 та гідрофобною канавкою CRD. Отже, розроблений ліганд TC114 досягнув бажаної мети, діючи як суперстабілізуючий агент у тесті на термостабільність і дозволяючи вивчати багатодоменну кокристалізацію SMO.
Загальна архітектура багатодоменного SMO людини
Загальна структура SMO (рис. 2а; додаткова рис. 4) має спільну канонічну складку GPCR 7TM з амфіпатичною спіраллю VIII, яка проходить паралельно площині мембрани. CRD сидить вертикально зверху TMD і підтримується позаклітинною петлею 3 (ECL3) з одного боку та сполучною петлею (залишки 181–190) з іншого. CRD і TMD з'єднані HD (залишки 191–220). Крім того, на позаклітинній стороні конструкції (рис. 2б) спіраль VI виходить за мембранну поверхню в чотири α-гвинтові повороти, а вершина спіралі VI схиляється в непроліновому повороті до CRD, виступаючи в його гідрофобна канавка і приєднання ключового з'єднання між CRD і TMD. CRD (залишки V107, L108, L112), HD (залишок V210) та ECL3 (залишки V494, I496) утворюють гідрофобну кишеню (рис. 2в). Раніше повідомлялося, що ця кишеня являє собою ділянку зв'язування оксистеролу 7, 19 .
( до ) Глобальна структура SMO людини в комплексі з TC114 визначена в XFEL. TC114 зображений у вигляді апельсинових паличок. CRD, Linker, HD та TMD позначаються як мультфільм помаранчевий, темно-синій, блакитно-зелений та світло-блакитний відповідно. Межа мембрани позначена як помаранчева пунктирна лінія. N-пов'язані глікани (NAGs) показані зеленими смужками. ( b ) Вид зверху SMO з позаклітинної сторони. Гідрофобна кишеня утворена гідрофобною канавкою CRD та ECL3 (морська ручка). ( c ) Ключові залишки в CRD та ECL3, що визначають гідрофобну кишеню, відображаються блакитними та світло-блакитними смужками відповідно.
Повнорозмірне зображення
Унікальна багатодоменна взаємодія
Повнорозмірне зображення
Порівняння SMO людини з іншими рецепторами класу завивки
( до ) Вид збоку накладених структур людського CRD SMO (hSMO) з CRD hFzd-4 (PDB ID: 5CL1) та mFzd-8 (PDB ID: 4F0A). SMO, hFzd-4 та mFzd-8 показані як мультфільми відповідно світло-блакитним, салатовим зеленим та помаранчевим. Wnt та Norrin показані як темно-сірі та оранжево-жовті мультфільми відповідно. Пальмітоїльна група в CRF mFzd-8 показана в морських сферах. ( b ) Місце 1: крупним планом пальмітоїлова група з взаємодіючими залишками, такими як апельсинові палички. Пальмітоїлова група зображена на морських паличках. Залишки SMO, що складають гідрофобну кишеню, позначені світло-блакитними смужками, mFzd-8 - помаранчевими смужками. ( c ) Ділянка 2: Поверхня SMO та CRF hFzd-4. Норрін показаний у світло-оранжевому мультфільмі. Колірний градієнт від світло-червоного до темно-червоного відповідає зміні властивостей поверхні з гідрофільної на гідрофобну. Місце зв'язування Норріна на поверхні hFzd-4 CRD позначене чорним пунктирним кружком з відповідним місцем, також позначеним на поверхні SMO.
Повнорозмірне зображення
Обговорення
Методи
Синтез TC114
Розчин 4-нітро-2- (трифторметил) бензойної кислоти (80 мг, 0,34 ммоль), вторинного аміну N-метил-1- (4- (1-метил-1Н-піразол-5-іл) фталазин-1- іл) піперидин-4-амін (100 мг, 0,31 ммоль) і N, N-диізопропілетиламін (DIPEA, 60 мг, 80 мкл, 0,46 ммоль) у 3 мл CH2Cl2 обробляють 1- [біс (диметиламіно)) метиленом] -1H-1,2,3-триазоло [4,5-b] піридину гексафторфосфат 3-оксидів (HATU, 153 мг, 0,40 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 1 години, перш ніж гасити додаванням розсолу. Реакційну суміш екстрагували тричі CH2Cl2. Об'єднаний органічний шар послідовно промивали насиченим розчином NaHCO 3 і розсолом, потім сушили над Na 2 SO 4. Після фільтрування розчин концентрували у вакуумі, а неочищений продукт очищали флеш-колонковою хроматографією на силікагелі, отримуючи TC114 у вигляді безбарвного твердого речовини (82 мг, 49%). Ядерно-магнітно-резонансна томографія показала суміш ротамерів.
Плавкова конструкція SMO-FLA, призначена для структурних досліджень
Ген SMO людського дикого типу (WT) був синтезований Genescript, а потім клонований у модифікований вектор pTT5, що містить експресійну касету з сигнальною послідовністю HA, після якої мітка FLAG, мітка 10 × His та вірус тютюнового травлення ( TEV)) місце розпізнавання протеази на кінці N перед рецепторною послідовністю і ще 10 міток His на кінці C. Невеликий білок флаводоксину (FLA, MW 16KD) 16 був злитий з ICL3 між P434 і S443, використовуючи шарувату ПЛР. N-термінал 1-52 і C термінал 559-787 були усічені. Для побудови в HD була введена одна мутація E194M, кристали якої використовувались для збору даних у XFEL. Конструкція, яка використовується для визначення структури синхротронів, не містить точкової мутації і була дещо змінена шляхом подальшого усічення N-кінця на п'ять залишків. Усі послідовності праймерів, використані в цьому дослідженні, наведені в додатковій таблиці 1.
Експресія та очищення злитого білка SMO-FLA
Кристалізація в LCP для збору синхротронних даних
Зразки білка рецептора SMO у комплексі з TC114 відновлювали в ліпідно-кубічній фазі (LCP) шляхом змішування з розплавленими ліпідами (10% (мас./Мас.) Холестерину, 90% (мас./Мас.) Моноолеїну) у співвідношенні 2/Білок розчин 3 (об/об)/ліпіди за допомогою механічного шприцевого змішувача 29. Аналізи кристалізації LCP проводили за допомогою робота кристалізації NT8-LCP (Formulatrix) у 96-лункових скляних сендвіч-пластинах (Nova). Після налаштування пластини інкубували і знімали зображення при 20 ° C за допомогою автоматизованої камери для зображення/інкубатора (RockImager 1000, Formulatrix). Вихідні кристалічні висновки були знайдені в осаджуваному стані, що містив 100 мМ цитрату натрію трихосновного дигідрату, рН 5,0, 30% (об/об) PEG400, 100 мМ аміачної селітри. Після оптимізації кристали вирощували в 100 мМ трициклічному дигідраті цитрату натрію, рН 5,0, 36% (об/об) PEG400, 50–200 мМ аміачній селітрі до середнього розміру 47 × 23 × 8 мкм 3 протягом 7 днів. Кристали SMO збирали безпосередньо з LCP з використанням мікромонтів 30 мкм (MiTeGen) та заморожували у рідкому азоті для збору даних.
Синхротронний збір даних та визначення структури
Повний розмір таблиці
Кристалізація в LCP для збору даних XFEL
Кристали для LCP-XFEL отримували в газонепроникних шприцах Гамільтона, як описано вище 38, вводячи µ5 мкл навантаженого білком LCP у вигляді безперервної колонки діаметром 400 мкм у шприц на 100 мкл, наповнений 60 мкл осаджуваного розчину, що містить 100 мМ. триосновний дигідрат цитрату натрію, рН 5,0, 36% (об/об) PEG400, 150 мМ хлориду амонію та інкубують принаймні 24 год при 20 ° C.Після утворення кристалів (розмір середовища 5 × 5 × 2 мкм 3), зразки від 2 до 3 шприців об'єднували разом і видаляли надлишок осаджувального розчину. Залишковий осад для осадження поглинали, додаючи кілька мікролітрів розплавленого ліпіду MAG 7,9 39. Отриманий кристалічний зразок LCP перевіряли під візуальним мікроскопом і завантажували в інжектор LCP 9 для збору даних LCP-SFX.
Збір даних XFEL та визначення структури
Воднево-дейтерієвий обмінний мас-спектрометричний аналіз
MD моделювання
Підготовка білка та побудова системи.
Кристалічну структуру холестеринового SMO-рецептора було отримано з бази даних PDB (код PDB: 5L7D 20). Для побудови моделі було обрано ланцюг A структури. Prime 45 був використаний у випуску Шредінгера 2015-3, а ICL3 був побудований за моделлю гомології, використовуючи іншу кристалічну структуру із Smo (код PDB: 4JKV (посилання 3)), і Prime передбачив петлю ICL2. Модель була вдосконалена Prepwizard 46 при рН 7,0, а термінал C або N обмежений ACT та NME.
Мембрана навколо трансмембранного домену SMO-рецептора була сконструйована 135 молекулами POPC та 48 холестеролами за допомогою веб-сервера CHARMM-GUI 47. Коробка остаточної періодичної системи обмежень становить 84,75 × 84,75 × 139,85 Å, а 20881 води TIP3P та 62 іони Na + та 68 Cl - (0,15 моль л −1 NaCl) були використані для сольватації та нейтралізації боксу. У системі було в цілому 93 475 атомів на періодичну клітинку.
Молекулярно-динамічне моделювання та аналіз даних.
Представлена сила Amber99sb-ILDN 48 була застосована до рецептора SMO, води та іонів TIP3P, а поле сили Slipids 49 - до холестерину та POPC. Для моделювання було використано Gromacs 5.1.2 (посилання 50), а протокол релаксації був отриманий із CHARMM-GUI та описаний на його папері та веб-сервері. По-перше, система мінімізована на 10000 кроків за допомогою процедури найкрутішого спуску і збалансована при постійній температурі (303,15 K) і постійному тиску (1,0 бар) при 50 п.с. NVT та 125 п.с. NPT при сильних обмеженнях на білки та ліпіди та незв’язаному межа обмеження 10–12 Å. Згодом було проведено рівновагу 2 нс NPT у тому самому стані зі слабкими обмеженнями білка та ліпідів для отримання збалансованої фази. Нарешті, було проведено два однакових симуляції MD продукту 1000 нс у рецепторі SMO та холестерині як ліганді в ліпідній та водній системі.
Результат MD-моделювання продукту було проаналізовано за допомогою Gromacs 5.1.2. Кут, визначений трьома атомами (C-альфа P69, V210 та W535), був обраний для опису нахилу SMO CRD щодо SMO TMD.
Тест на сигналізацію їжака
Клітини світла II (ATCC; Роквілл, Меріленд) зі стабільною ектопічною експресією 8 х люциферази світлячка світлячка в місці зв'язування Gli та конструктивних репортерних конструкцій люніферази Renilla висівали в 96-лункові планшети. Після трансфекції згладженими або чіткими гладкими мутантними плазмідами дикого типу, як зазначено, клітини піддавали різній обробці, як зазначено, протягом 36 годин. Активність люциферази у світлих клітинах II вимірювали за допомогою системного набору для вимірювання подвійної люциферази Promega (відповідно до вказівок виробника на люмінометрі (Molecular Devices; Sunnyvale, CA)) (Madison, WI), і її нормалізували до значень Ренілли. Дані будували на графіку та визначали значення IC50 за допомогою GraphPad Prism. Кожна точка даних представляє середнє значення ± sd, повторене в трьох примірниках.
Вестерн-блот-аналіз
Клітини після різних трансфекцій, як зазначено, збирали і піддавали буферу лізису (50 мМ Tris, рН 7,4, 150 мМ NaCl, 1% NP-40, 1 мМ ванадат натрію, 1 мМ PMSF, DTT 1 мМ, 10 мг мл -1 лейпептину і апротинін) з подальшим імуноблот-аналізом. Первинні антитіла проти SMO та GAPDH (Санта Круз Біотехнологія, Санта Круз, Каліфорнія, США) використовували для імуноблот-аналізу згідно рутинної процедури 51. Антитіла проти SMO та GAPDH розбавляються відповідно 1: 200 та 1: 5000 відповідно до інструкцій виробника.
Наявність даних
Координати та структурні фактори були депоновані в Банку білкових даних для SMO-TC114, вирішеного у XFEL (PDB: 5V56) та синхротроні (PDB: 5V57). У цьому дослідженні використовували коди доступу PDB 4JKV, 5L7D, 5L7I, 4QIM, 4QIN, 4N4W, 4O9R, 5KZZ, 5KZV, 5KZY, 5CL1, 4F0A. У цьому дослідженні були використані коди доступу UniProt Q99835 для SMO людини. Усі інші дані можна отримати у відповідних авторів за обґрунтованим запитом.
Додаткова інформація
Файли PDF
Додаткова інформація
Додаткові рисунки, додаткова таблиця, додаткові методи та додаткові посилання.
Файл експертної перевірки
Коментарі
Надсилаючи коментар, ви погоджуєтесь дотримуватись наших Умов та правил спільноти. Якщо ви виявите щось образливе або не відповідає нашим умовам чи інструкціям, позначте це як неприйнятне.
- Фамагуста відновлює свій підконтрольний Туреччині курорт, незважаючи на спротив Кіпру
- Гербесан Біо Гуарана Жиросжигающий Комплекс 20 Ампул по 15 мл
- Гербалайф запустив полівітамінний комплекс із 22 необхідними вітамінами та мінералами - Новини
- Вітамінно-мінеральний комплекс Формули 2 - це веб-сайт члена Herbalife
- Ін’єкційний гормон росту гормону росту для свіжого сухого зберігання Melanotan 2