Архів бронхонемології - це науковий журнал, який публікує оригінальні проспективні дослідження з високим пріоритетом, де представлені результати, що стосуються різних епідеміологічних, патофізіологічних, клінічних, хірургічних та основних аспектів респіраторних захворювань. Також публікуються інші типи статей, такі як огляди, редакційні статті, деякі спеціальні статті, що цікавлять суспільство та журнал, наукові листи, листи до редактора та клінічні зображення. Щороку він видає 12 регулярних випусків та деякі додатки, які більшою чи меншою мірою містять такі типи статей. Отримані рукописи спочатку оцінюються редакторами, потім вони надсилаються на огляд експертам (процес рецензування або "експертна оцінка") і редагуються одним із редакторів команди.
Журнал виходить щомісяця іспанською та англійською мовами. Тому надсилання рукописів, написаних іспанською та англійською мовами, приймається нечітко. Бюро перекладачів здійснює відповідний переклад.
Рукописи завжди надсилатимуться в електронному вигляді через веб-сайт: https://www.editorialmanager.com/ARBR/, посилання також доступне через головну сторінку Архівів бронкопневмології.
Доступ до будь-якої статті, опублікованої в журналі, будь-якою з мов, можливий через його веб-сайт, а також через PubMed, Science Direct та інших міжнародних баз даних. Крім того, Журнал присутній у Twitter та Facebook.
Архів бронхонемології Це офіційний орган висловлювання Іспанського товариства пульмонології та торакальної хірургії (SEPAR) та інших наукових товариств, таких як Латиноамериканське товариство грудної клітки (ALAT) та Іберо-Американська асоціація торакальної хірургії (AICT).
Автори також можуть подавати свої статті до Відкрити респіраторний архів, Додаткова назва журналу з відкритим доступом.
Індексується у:
Поточний зміст/Клінічна медицина, JCR SCI-Expanded, Index Medicus/Medline, Excerpta Medica/EMBASE, IBECS, IME, SCOPUS, IBECS
Слідкуй за нами на:
Фактор впливу вимірює середню кількість цитат, отриманих за рік за твори, опубліковані у виданні протягом попередніх двох років.
CiteScore вимірює середню кількість цитат, отриманих за опубліковану статтю. Читати далі
SJR - це престижна метрика, заснована на ідеї, що всі цитати не рівні. SJR використовує алгоритм, подібний до рейтингу сторінок Google; є кількісним та якісним показником впливу публікації.
SNIP дозволяє порівняти вплив журналів з різних предметних областей, виправляючи відмінності у ймовірності цитування, які існують між журналами різних тем.
Імунологічні основи ХОЗЛ. Запалення
Рис. 2. Режим дії металопротеаз (ММП). ММР вивільняються неактивно у формі проферменту або у вигляді ферменту, зв’язаного з тканинними інгібіторами (ТІМП). Його активація відбувається через окислення проферменту або через розпад інгібіторів. Після активації його функція протеази руйнує інші білки, як структурні (позаклітинний матрикс), так і регуляторні (альфа-1 антитрипсин, інші ММР та інші інгібітори білка).
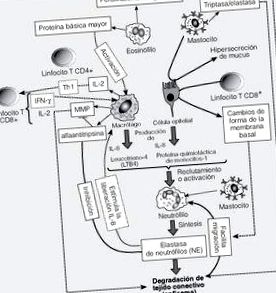
Доречність еозинофілів при ХОЗЛ обговорюється через розбіжності між даними, які вказують на їх збільшення на 19,20 чи ні, або тим, що вони присутні в неактивній формі 14. Примітно, що кількість еозинофілів можна спостерігати в збільшенні стінки дихальних шляхів під час загострень ХОЗЛ у неатопічних суб'єктів, поряд з підвищеною експресією цитокінів інтерлейкінів (ІЛ) 4 і 5 та еозинофільних атракторів хемокінів Т-клітини, що експресуються та секретуються), еотаксин та MCP (білок хемоаттрактантів моноцитів) 4 21. Наявність еозинофілів представлено як предиктор реакції на лікування стероїдами 22,23. При ХОЗЛ також описано збільшення рівня тучних клітин, 24 які можуть брати участь у вербуванні нейтрофілів за рахунок вивільнення хемотаксичних факторів, пошкодження тканин внаслідок дії різних ферментів (триптази, хімази та еластази) та гіперсекреції слизу. під дією хімази 25 .
Рис. 3. Окислювальний стрес та його наслідки. Окислювальні вільні радикали присутні в тютюновому димі, а також виробляються клітинами імунної відповіді. Якщо його вантаж перевантажує антиоксидантні системи детоксикації, виникає окислювальний стрес, який спричиняє пряме пошкодження структурних клітин, змінює вироблення цитокінів та протеаз нейтрофілами та макрофагами та гальмує антипротеазні системи. Це також впливає на дію деацетилаз гістону (HDAC) та ацетилаз (HAT), що є частиною механізму ремоделювання хроматину, блокуючи HDAC, сприяючи ацетилюванню та розвиненій конфігурації хроматину. Ця конфігурація полегшує зв'язування з ДНК регуляторних факторів механізму транскрипції та індукує експресію прозапальних генів. Подібним чином він блокує терапевтичну дію кортикостероїдів, одним із механізмів яких є набір HDAC до клітинного ядра.
Існує безліч накопичених доказів існування окисного стресу у курців та хворих на ХОЗЛ в легенях та за системною шкалою 45-47, а також даних, що пов’язують збільшення непрямих маркерів оксидативного стресу з розвитком обструктивного потоку повітря обмеження 48.49. Сигаретний дим викликає диференційовану експресію різних генів, що беруть участь у реакції на окислювальний стрес в бронхіальному епітелії, і ці відмінності посилюються у курців, у яких розвивається ХОЗЛ 50. Окислювачі сигаретного диму можуть брати участь у системних проявах ХОЗЛ, таких як дисфункція скелетних та дихальних м'язів та втрата ваги. Окислювальний стрес у цих суб'єктів викликають різні вільні радикали, включаючи супероксидні аніони (O 2), що виділяються альвеолярними макрофагами або походять від реакцій ксантину/ксантиноксидази 51, оксиду азоту (NO) 52, окису вуглецю (CO), етану 53 та ліпідів продукти перекисного окислення, включаючи похідні перекисного окислення арахідонової кислоти (ізопростани) 54,55 .
Легеневі структурні зміни при ХОЗЛ. Дослідження ремоделювання
Структурні зміни дихальних шляхів
Рис. 4. Бронхіальна біопсія пацієнта з хронічною обструктивною хворобою легень. А) У гістологічному розрізі видно: рясні слизові залозисті ацинуси (Gl) і гладкі м’язи (РС) і дуже близько до епітелію, ознака, що відображає ріст цих структур; Ділянки фіброзу субепітеліального розташування (Fb), які спостерігаються як практично безклітинні гіалінові відкладення, так і рясні келихоподібні клітини (Cal), що мають гіпертрофічний вигляд. Ці структурні зміни супроводжуються запаленням з мононуклеарною інфільтрацією (B), наявністю нейтрофілів (C) та еозинофілів (D). Також спостерігаються зони деструкції війок бронхіального епітелію (Е). Стрижні шкали: 50 мкм в А; 10 мкм в B-E. Пляма: гематоксилін-еозин.
Плоска метаплазія, втрата війок в епітелії бронхів, гіперплазія келихоподібних клітин, гіпертрофія плюс протокова гіперплазія та розширення підслизових залоз, а також збільшення маси гладких м’язів описані в центральних дихальних шляхах 83-89. Традиційним виміром збільшення бронхіального залози є показник Рейда 90 або відношення товщини залози до товщини стінки. Хоча субепітеліальний фіброз або збільшення товщини базальної мембрани класично не вважався характерною зміною ХОЗЛ, він спостерігався у підгрупи пацієнтів з еозинофільною запальною інфільтрацією. Окрім цієї групи, зокрема, наявність субепітеліального фіброзу описана в ХОЗЛ 91, хоча кількісні дані про його значущість відсутні.
Структурні зміни легеневої паренхіми
При ХОЗЛ емфізема сприяє обмеженню потоку повітря за допомогою спільної дії 2 механізмів: зменшення еластичної ретракції легені, що впливає на здатність виробляти тиск, що генерує потік, і зменшення навантаження, яке протистоїть закриттю дихальних шляхів, руйнуючи анкери альвеолярної стінки. Laennec 96, мабуть, першим припустив на початку 19 століття, що периферичні дихальні шляхи були основним місцем обструкції емфіземи, і що знижена еластична ретракція легені сприяла обмеженню потоку повітря. Механічні зміни в обох формах емфіземи відрізняються 97. При панацинарній емфіземі відповідність легенів вища, і її збільшення корелює зі зменшенням потоку повітря, що, здається, відбувається переважно як функція втрати еластичної ретракції паренхіми. При центрилобулярній емфіземі запальний компонент периферичних дихальних шляхів більший і може бути головним фактором, що визначає втрату потоку повітря, з чим він корелює.
Короткий зміст та висновки