Іспанська асоціація педіатрії має одним з головних завдань розповсюдження суворої та сучасної наукової інформації з різних областей педіатрії. Anales de Pediatría є Науковим висловлювальним органом Асоціації і є засобом, за допомогою якого співробітники спілкуються. У ньому публікуються оригінальні роботи з клінічних досліджень у педіатрії з Іспанії та країн Латинської Америки, а також оглядові статті, підготовлені найкращими професіоналами кожної спеціальності, щорічні повідомлення про конгрес та щоденники Асоціації, а також посібники для дій, підготовлені різними товариствами/спеціалізованими Секції, інтегровані в Іспанську асоціацію педіатрії. Журнал, орієнтир для іспаномовної педіатрії, індексується у найважливіших міжнародних базах даних: Index Medicus/Medline, EMBASE/Excerpta Medica та Index Médico Español.
Індексується у:
Index Medicus/Medline IBECS, IME, SCOPUS, Індекс наукового цитування розширений, Звіт про цитування журналів, Embase/Excerpta, Medica
Слідкуй за нами на:
Фактор впливу вимірює середню кількість цитат, отриманих за рік за твори, опубліковані у виданні протягом попередніх двох років.
CiteScore вимірює середню кількість цитат, отриманих за опубліковану статтю. Читати далі
SJR - це престижна метрика, заснована на ідеї, що всі цитати не рівні. SJR використовує алгоритм, подібний до рейтингу сторінок Google; є кількісним та якісним показником впливу публікації.
SNIP дозволяє порівняти вплив журналів з різних предметних областей, виправляючи відмінності у ймовірності цитування, які існують між журналами різних тем.
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Бібліографія
Щотижневе домашнє підшкірне введення підшкірного гамма-глобуліну (GGSC) є альтернативою для лікування первинних імунодефіцитів з дефіцитом продукції антитіл. Мета - порівняти та оцінити ефективність, безпеку, якість життя та річну вартість GGSC та внутрішньовенного гамма-глобуліну (IVGM) у наших умовах.
Матеріал і методи
спостережне та описове дослідження педіатричних пацієнтів із загальним змінним імунодефіцитом (CVID), які отримують GGSC у нашому центрі (листопад 2006 - квітень 2008), порівняно з минулим роком GGIV.
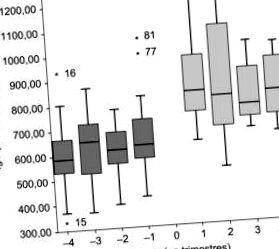
Було включено 11 пацієнтів з CVID. Середній вік, 15 років. Медіана мінімального IgG у плазмі крові з GGIV, 622 мг/дл. У пацієнтів, у яких доза GGSC підтримувалась або зменшувалась порівняно з попередньою GGIV (7/8), медіана IgG становила 850 мг/дл (p Висновки
підшкірна терапія є економічно ефективною альтернативою IVGN зі схожою ефективністю та підвищеною якістю життя у пацієнтів з CVID. Отримані мінімальні концентрації IgG у плазмі крові дорівнюють або перевищують. Місцеві побічні реакції є загальними, але легкими та самообмеженими.
Щотижнева домашня терапія підшкірного імуноглобуліну (SCIg) є альтернативою внутрішньовенному імуноглобуліну (IVIg) при лікуванні пацієнтів з первинною недостатністю антитіл. Завданням цього дослідження було дослідити ефективність, безпеку, якість життя та економічну ефективність SCIg у нашому районі.
Матеріали і методи
Спостережне та описове дослідження, яке включало педіатричних пацієнтів із загальним змінним імунодефіцитом (CVID), які отримували SCIg у нашій лікарні (листопад 2006 р. - квітень 2008 р.). Отримані дані порівнювали з даними минулого року з IVIg.
Були включені одинадцять пацієнтів з CVID. Середній вік становив 15 років. Середній мінімальний рівень IgG у сироватці крові становив 622 мг/дл при IVIg. У пацієнтів, у яких дозу SCIg підтримували або зменшували порівняно з IVIg, середній рівень сироваткового IgG становив 850 мг/дл (p Висновки
Ми прийшли до висновку, що підшкірне введення 16% SCIg є безпечною та економічно ефективною альтернативою IVIg для замісної терапії первинних дефіцитів антитіл. Середній мінімальний рівень IgG у сироватці крові був вищим при SCIg. Місцеві АЕ були поширеними, але помірними, і частота захворюваності зменшувалася з часом. Якість життя значно покращується.
Первинні імунодефіцити (ПІД) - це група генетично обумовлених захворювань, спричинених кількісними та/або функціональними змінами різних механізмів, що беруть участь у імунній відповіді. Вони вражають приблизно 1/10 000 новонароджених (НБ), а дефіцит імуноглобуліну А (IgA) є найбільш частим (1/700 НБ кавказької національності). Поширеність поширеного варіативного імунодефіциту (CVID) становить від 1,2 до 5/100000 жителів 1. Клінічно він характеризується підвищеною схильністю до інфекцій, головним чином дихальних шляхів, аутоімунних захворювань та новоутворень. Діагноз, згідно з критеріями Європейського товариства з імунодефіцитів (ESID, www.esid.org), встановлюється за рахунок зниження IgG, IgA та/або IgM нижче нормальних значень для кожного віку та через відсутність відповідь на вакцини, які раніше вводили пацієнтам старше 2 років, виключаючи інші причини гіпогаммаглобулінемії. Його лікування полягає у замісній терапії неспецифічним гамма-глобуліном людини (ГГ) для отримання концентрації IgG у плазмі крові, подібної до фізіологічних значень.
До цього часу внутрішньовенне введення гама-глобуліну (IVG) було стандартним лікуванням у цих пацієнтів. Режим прийому 200–600 мг/кг кожні 21–28 днів дозволяє досягти мінімальної концентрації IgG 600 мг/дл 3 у плазмі крові. Важкий венозний доступ та потенційно серйозні побічні ефекти іноді обмежують його використання 4 .
Починаючи з 1991 року, підшкірний гамма-глобулін (GGSC) почав застосовуватися в Європі та США. Введення 100 мг/кг/тиждень або 200 мг/кг/14 днів 5–11 дозволяє отримати концентрації IgG, подібні до концентрацій, отриманих при IVGG. Значення IgG, отримані за допомогою GGSC, є більш стабільними, оскільки щотижневе введення менших доз дозволяє уникнути максимальної концентрації та мінімальних концентрацій у плазмі крові через швидкий катаболізм введених доз 12 .
Ефективність GGSC оцінювали в кількох дослідженнях у дорослих 5,7,8,13,14 та дітей у віці до 13 років, не демонструючи статистично значущих відмінностей щодо кількості та тяжкості інфекцій під час лікування 7,13 .
Профіль безпеки GGSC різний, з меншим відсотком серйозних системних побічних реакцій (АР) (5,7,11,13,15,16. На відміну від місцевих АР (біль, еритема, ущільнення, свербіж тощо) проявляються у більшості пацієнтів на початку лікування; вони, як правило, легкі та самообмежені 5,7,8,13,15-18 .
GGSC також пропонує можливість звернення самого пацієнта в сімейний будинок, що означає поліпшення якості життя пацієнта та його сім'ї. Цей аспект оцінювали за допомогою різних перевірених покажчиків та опитувальників, таких як індекс якості життя (LQI), Анкета дитячого здоров’я - парентеральна форма 50 (CHQ-PF50) для педіатрії та її зведена версія для дорослих (SF-36) 3, 13,19–21 .
Різні економічні дослідження, проведені 6,8,15,22,23, показують, що лікування вдома за допомогою GGSC призводить до значної щорічної економії в порівнянні з попереднім лікуванням IVGG.
У листопаді 2006 року Іспанське агентство з лікарських засобів та товарів для здоров'я зареєструвало підшкірний гамма-глобулін (Vivaglobin ®; CSL Behring GmbH, Мальбург, Німеччина, Німеччина) для лікування ВІЛ, мієломи та хронічного лімфатичного лейкозу з важкою вторинною гіпогамаглобулінемією та рецидивуючими інфекціями 10 . З цього моменту розпочалося його введення у дитячих пацієнтів з діагнозом ПІД у нашому центрі.
Основними цілями дослідження були: порівняння мінімальних значень IgG із GGIV та GGSC, визначення частоти та тяжкості інфекцій та оцінка безпеки GGSC. Щодо другорядних цілей, ступінь задоволеності та якість життя оцінювали за допомогою GGSC вдома, а річні витрати на пацієнта порівнювали з GGIV та GGSC.
Матеріал і методи Вивчення дизайну
Спостережне, описове, поздовжнє ретроспективне дослідження. У кожного пацієнта оцінювали останній рік лікування GGIV і з самого початку GGSC до квітня 2008 року, з подальшими візитами через 1, 3, 6 та 12 місяців після переходу на GGSC протягом першого року. Демографічні, аналітичні та клінічні дані збирали ретроспективно через клінічну історію (СН). Після початку підшкірного лікування було проведено два опитування з пацієнтом та/або родичами.
Були включені пацієнти з GGSC з листопада 2006 року по квітень 2008 року, які отримували GGIV протягом останнього року. Критеріями включення були: а) пацієнти віком до 18 років і вага кг; b) підтверджений діагноз CVID та c) хороший соціокультурний рівень для розуміння процедур та належного управління у разі появи несприятливих наслідків з GGSC. Критерії виключення: а) пацієнти віком від 18 років; б) нездатність зрозуміти процедуру; в) важкі дискразії крові; г) шкірні зміни, що перешкоджають введенню GGSC; e) вагітність та f) відмова пацієнта та/або родичів від участі у дослідженні.
Члени сім'ї та сам пацієнт (якщо йому було більше 16 років) отримали усну та письмову інформацію про зміну терапії з GGIV на GGSC та підписали інформовану згоду на адміністрацію GGSC. Дослідження було схвалено Комітетом етики клінічних досліджень Центру.
Ліки GGIV та GGSC, доза та техніка введення
Усі пацієнти отримували Віваглобін ® 16% (160 мг/мл).
Загальну щомісячну дозу (MTD) GGIV (Endobulin ®) розраховували на основі дози та частоти введення останніх 3 отриманих доз GGIV та ділили на 4 для встановлення початкової дози GGSC на тиждень. Лікування щотижневим GGSC розпочали через тиждень після останньої дози GGIV.
GGSC вводили за допомогою портативного інфузійного насоса (модель Infusa T1, від Medis). Дози, що перевищували 20 мл, були розділені на два місця проколу. Місцем пункції була черевна стінка, а швидкість введення становила 10–22 мл/год 10 .
Перед початком терапії вдома в лікарні було проведено 8 тренувальних занять. Повідомлялося про поводження з насосом та інфузійну техніку, важливість ведення щоденника лікування та техніку внутрішньом’язового введення адреналіну у разі тяжкої АР. Подальші візити були здійснені через 1, 3, 6 та 12 місяців після початку GGSC.
Кожні 3 місяці проводили періодичні тести для визначення еволюції плазми IgG, IgA та IgM із використанням нефелометричних методів.
Будь-яка інфекція за останній рік IVG реєструвалась до квітня 2008 року. Інфекції класифікували за місцем їх розташування: а) інфекції верхніх дихальних шляхів (URI): риніт, фарингіт, ларингіт, катар верхніх дихальних шляхів (CVA), кон’юнктивіт, синусит та гострий середній отит (АОМ); b) інфекції нижніх дихальних шляхів (IRTI): бронхіт та пневмонія; в) шлунково-кишкові інфекції, і г) інші інфекції. Інфекції, що вимагають госпіталізації, вважалися серйозними (менінгіт, пневмонія, сепсис, остеомієліт та абсцеси внутрішніх органів).
Для оцінки біологічної безпеки GGSC, за 3 місяці до і за 3 місяці після початку GGSC, відсутність вірусної інфекції гепатитом B (HbsAg за EIA), гепатитом C (RNA-HCV за допомогою ПЛР у режимі реального часу, система Tacqman - Roche ®) та вірусне навантаження на ВІЛ (NASBA). Медсестринство, зареєстроване в HC, та пацієнт у своєму щоденнику, будь-які ознаки або симптоми, пов’язані із системним або місцевим АР, що походять від ліків. РА вважався серйозним, якщо він вимагав госпіталізації пацієнта.
Ступінь задоволеності та якості життя GGSC
Для оцінки ступеня прийняття GGSC для цієї процедури було розроблено два співбесіди (не адаптовані до анкет LQI або CHQ-PF50, затверджених для педіатрії). Перше співбесіду було проведено після закінчення періоду навчання пацієнтів у лікарні, а друге - через 4 місяці після запуску GGSC.
Щорічна економічна оцінка GGIV та GGSC
Порівнювались річні витрати за останній рік лікування GGIV (Ендобулін ®) та перший рік чи пізніше за допомогою GGSC (Віваглобін ®). Ціна продажу в лабораторію (ПВЛ) плюс ПДВ на ліки та аксесуари була отримана з виробничої лабораторії кожної фармацевтичної спеціальності (консультація, квітень 2008 р.).
Статистичний аналіз даних проводили за допомогою статистичної програми SPSS (V15.0) та Excel. Вивчались такі змінні: а) ефективність: плазмовий рівень IgG, вихід кожного GG, кількість інфекцій; б) безпека: місцеві та системні побічні реакції, вірусні інфекції (ВГВ, ВГС, ВІЛ); c) ступінь задоволення відповідно до введених анкет, і d) вартість: щорічні витрати на одного пацієнта.
Щоб визначити ефективність мінімальної концентрації IgG у плазмі крові, був отриманий термін ефективності для кожного використовуваного типу GG, розділивши мінімальну концентрацію IgG у плазмі крові (мг/дл) на отриману дозу GG [мг/(кг/тиждень) ] [одиниці врожаю: (кг/тиждень)/дл]. Порівняння показників між обома групами проводили із порівнянням засобів для неспарених зразків. Вплив змінних "вихідний рівень IgG на момент діагностики" та "шлях введення" на отриману концентрацію IgG у плазмі крові (мг/дл) оцінювали шляхом множинної лінійної регресії. Швидкість зараження та пропорції системних та місцевих АР на пацієнта під час лікування GGIV та GGSC порівнювали з непараметричним t-тестом Вількоксона. Значення змінних віку, ваги та плазмового IgG пацієнта, дози та частоти GG виражали із середнім та міжквартильним діапазоном.
Результати Дослідження сукупності
Були включені одинадцять пацієнтів (7 хлопчиків та 4 дівчинки), яким діагностовано CVID відповідно до критеріїв ESID, за винятком інших діагнозів відповідно до звичайної клінічної практики. Під час дослідження жоден предмет не був втрачений. У таблиці 1 наведено найважливіші демографічні та клінічні дані. У 3 пацієнтів, яким діагностовано вік до 2 років, були клінічні прояви та сімейний анамнез IDC, і у всіх випадках цей діагноз підтверджувався у старшому віці.
Демографічні та клінічні характеристики пацієнтів.