2.1: Ранні ідеї в атомній теорії
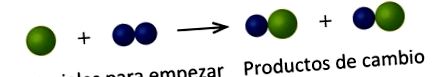
На наступному малюнку зелені кулі представляють атоми певного елемента. Блакитні сфери представляють атоми іншого елемента. Якщо сфери різних елементів стикаються, вони входять до єдиної одиниці сполуки. Наступні хімічні зміни, представлені цими сферами, можуть порушити одну з ідей атомної теорії Дальтона. Який?
Вихідні матеріали складаються із зеленої кулі та двох синіх куль. Вироби складаються з двох зелених сфер і двох синіх сфер. Це порушує постулат Далтона про те, що атоми не створюються під час хімічної зміни, а просто перерозподіляються.
Який постулат теорії Далтона узгоджується з наступним спостереженням щодо ваги реагентів та продуктів? При нагріванні 100 грам твердого карбонату кальцію утворюється 44 грами вуглекислого газу і 56 грамів оксиду кальцію.
Визначте постулат теорії Далтона, який порушується такими спостереженнями: 59,95% зразка діоксиду титану становить титан; 60,10% іншого зразка діоксиду титану становить титан.
Це твердження порушує четвертий постулат Далтона: у даній сполуці кількість атомів кожного типу (а отже, і відсоток) завжди має однакове співвідношення.
Зразки сполук X, Y та Z аналізуються, результати наведені тут.
| X | Прозора рідина, безбарвна, з сильним запахом. | 1776 г. | 0,148 г. |
| Y | Прозора рідина, безбарвна, з сильним запахом. | 1977 г. | 0,329 г. |
| Z | Прозора рідина, безбарвна, з сильним запахом. | 7,812 г. | 0,651 г. |
Чи дають ці дані приклад (и) закону певних пропорцій, закону кратних пропорцій, ні того, ні іншого? Що ці факти говорять вам про сполуки X, Y та Z?
2.2: Еволюція атомної теорії
Навчання
- Існування ізотопів порушує одну з вихідних ідей атомної теорії Дальтона. Який?
- Чим схожі електрони і протони? Яка різниця між ними?
- Чим схожі протони та нейтрони? Яка різниця між ними?
- Прогнозувати та перевіряти поведінку α-частинок, випущених проти модельного атома «сливового пудингу».
- Прогнозуйте шляхи проходження α-частинок, що вистрілюються в атоми, зі структурою моделі пудингу Томсона. Поясніть, чому ви очікуєте, що α-частинки підуть цими шляхами.
- Якщо α-частинки з більш високою енергією, ніж ті, що зазначені в (a), вистрілюють по атомах пудингової пудри, передбачте, як їхні шляхи будуть відрізнятися від шляхів α-частинок з меншою енергією. Поясніть свої міркування.
- Тепер перевірте свої прогнози щодо (а) та (б). Відкрийте Моделювання розсіювання Резерфорда і виберіть вкладку "Сливовий пудинг". Встановіть для «Енергія частинок альфа» значення «хв» і виберіть «показати сліди». Клацніть на пістолет, щоб розпочати зйомку α-частинок. Це відповідає вашим прогнозам з (а)? Якщо ні, поясніть, чому фактичний маршрут буде таким, як показано в моделюванні. Натисніть кнопку паузи або "Скинути все". Встановіть для "Енергія частинок альфа" значення "max" і починайте знімати α-частинки. Це відповідає вашим прогнозам з (b)? Якщо ні, поясніть вплив збільшення енергії на реальні маршрути, як показано в моделюванні.
- Прогнозувати та перевіряти поведінку випалених α-частинок в моделі атома Резерфорда.
- (а) Передбачити шляхи проходження α-частинок, які вистрілюються в атомах із структурою моделі атома Резерфорда. Поясніть, чому ви очікуєте, що α-частинки підуть цими шляхами.
- (b) Якщо α-частинки з більшою енергією, ніж ті, що зазначені в (a), вистрілюють по атомах Резерфорда, передбачіть, як їх траєкторії будуть відрізнятися від траєкторій α-частинок з нижчою енергією. Поясніть свої міркування.
- (в) Передбачіть, як будуть відрізнятися шляхи проходження α-частинок, якщо обстрілювати атоми Резерфорда елементів, відмінних від золота. Як ви сподіваєтесь, який фактор спричинить цю різницю у дорогах та чому?
- (d) Перевірте свої прогнози щодо (a), (b) та (c). Відкрийте Моделювання розсіювання Резерфорда і виберіть вкладку "Rutherford Atom". Через масштаб моделювання найкраще починати з малого ядра, тому для протонів і нейтронів виберіть «20», для енергії «хв», покажіть сліди, а потім починайте знімати α-частинки. Це відповідає вашим прогнозам з (а)? Якщо ні, поясніть, чому фактичний маршрут буде таким, як показано в моделюванні. Призупиніть або перезапустіть, встановіть енергію на «максимум» і починайте стріляти α-частинками. Це відповідає вашим прогнозам з (b)? Якщо ні, поясніть вплив збільшення енергії на реальний шлях, як показано в моделюванні. Призупиніть або перезапустіть, виберіть "40" для протонів і нейтронів, "хв" для енергії, покажіть сліди і зніміть. Це відповідає вашим прогнозам із (c)? Якщо ні, поясніть, чому фактичний маршрут буде таким, як показано в моделюванні. Повторіть це з більшою кількістю протонів та нейтронів. Яке узагальнення ви можете зробити щодо типу атома та впливу на шлях α-частинок? Будьте чіткими та конкретними у своїй відповіді.
Рішення
1 Далтон спочатку вважав, що всі атоми певного елемента мають однакові властивості, включаючи масу. Тому поняття ізотопів, в якому елемент має різні маси, було порушенням початкової ідеї. Щоб пояснити існування ізотопів, другий постулат його атомної теорії був змінений, щоб стверджувати, що атоми одного і того ж елемента повинні мати однакові хімічні властивості.
2 Обидва є субатомними частинками, що знаходяться в ядрі атома. Вони обидва мають приблизно однакову масу. Протони заряджені позитивно, тоді як нейтрони незаряджені.
3 Обидва - субатомні частинки, що знаходяться в ядрі атома. Вони обидва мають приблизно однакову масу. Протони заряджені позитивно, тоді як нейтрони незаряджені.
4. (а) Модель сливового пудингу вказує на те, що позитивний заряд рівномірно розподілений по всьому атому, тому ми очікуємо, що α-частинки (можливо) будуть трохи зменшені позитивно-позитивним відштовхуванням, але йтимуть по прямій лінії (тобто не відхилятися), коли вони проходять через атоми. (b) Частинки α з більшою енергією рухатимуться швидше (і, можливо, сповільняться), а також будуть прямими шляхами через атоми. (c) Частинки α йшли прямими лініями через атом пудингу сливи. Очевидного зменшення α-частинок при проходженні через атоми не спостерігалося.
5. (а) Атом Резерфорда має невелике, позитивно заряджене ядро, тому більшість α-частинок пройде через порожній простір подалі від ядра і не буде відхилятися. Частинки α, які проходять близько до ядра, будуть відхилятися від своїх шляхів через позитивно-позитивне відштовхування. Чим прямо до ядра спрямовані α-частинки, тим більший кут відхилення. (б) Частинки α з більшою енергією, які проходять близько до ядра, продовжуватимуть відхилятися, але чим швидше вони рухаються, тим кут відхилення буде менше, ніж очікувалося. (в) Якщо ядро менше, позитивний заряд менший, а очікувані відхилення менші, як з точки зору того, наскільки близько α-частинки проходять через ядро без відхилення, так і під кутом відхилення. Якщо ядро більше, позитивний заряд більший, а очікувані відхилення більші: більше α-частинок буде відхилятися, а кути відхилення будуть більшими. (d) Шляхи α-частинок збігаються з прогнозами (a), (b) і (c).
2.3: Атомна будова та символіка
Яким чином ізотопи даного елемента завжди відрізняються? Яким чином вони завжди однакові?
Напишіть символ для кожного з наступних іонів:
- (а) іон із зарядом 1+, атомний номер 55 і масове число 133
- (б) іон з 54 електронами, 53 протонами і 74 нейтронами
- (c) іон з атомним номером 15, масовим числом 31 і зарядом 3
- (d) іон з 24 електронами, 30 нейтронами і зарядом 3+
(a) 133 Cs +; (b) 127 I -; (c) 31 P 3-; (d) 57 Co 3+
Напишіть символ для кожного з наступних іонів:
- (а) іон із зарядом 3+, 28 електронів і масовим числом 71
- (б) іон з 36 електронами, 35 протонами і 45 нейтронами
- (c) іон з 86 електронами, 142 нейтронами і зарядом 4+
- (d) іон із зарядом 2+, атомний номер 38 і масовий номер 87
Відкрийте симуляцію побудови атома та натисніть на піктограму атома.
- (а) Виберіть будь-який із перших 10 елементів, який ви хотіли б побудувати, та вкажіть його символ.
- (b) Перетягніть протони, нейтрони та електрони на шаблон атома, щоб утворити атом його елемента. Вкажіть кількість протонів, нейтронів та електронів у вашому атомі, а також чистий заряд і масове число.
- (c) Клацніть на "Чисте навантаження" та "Масове число", перевірте свої відповіді в (b) та, якщо потрібно, виправте.
- (г) Передбачте, чи буде ваш атом стабільним чи нестійким. Будь ласка, повідомте свої міркування.
- (e) Установіть прапорець "Стабільний/Нестабільний". Чи була ваша відповідь на (d) правильною? Якщо ні, спочатку передбачте, що ви можете зробити, щоб створити стабільний атом вашого елемента, а потім продовжуйте і перевіряйте, чи він працює. Поясніть свої міркування.
(а) Вуглець-12, 12 С; (б) Цей атом містить шість протонів і шість нейтронів. В нейтральному атомі 12 С. є шість електронів. Чистий заряд цього нейтрального атома дорівнює нулю, а масове число - 12. (с) Наведені вище відповіді правильні. (d) Атом буде стабільним, оскільки С-12 є стабільним ізотопом вуглецю. (е) Попередня відповідь є правильною. Інші відповіді на цю вправу можливі, якщо обрано інший елемент ізотопу.
(а) Перетягніть протони, нейтрони та електрони на шаблон атома, щоб створити нейтральний атом Кисню-16 і дайте ізотопний символ для цього атома.
(б) Тепер додайте ще два електрони, щоб утворився іон, і дайте символ іона, який ви створили.
(а) Перетягніть протони, нейтрони та електрони на шаблон атома, щоб отримати нейтральний атом Літію-6 і дайте символ ізотопу для цього атома.
(б) Тепер вийміть електрон, щоб утворити іон, і дайте символ іона, який ви створили.
(а) Літій-6 містить три протони, три нейтрони та три електрони. Символом ізотопу є 6 Li або \ (\ ce<^6_3Li>\). (b) 6 Li + o \ (\ ce<^6_3Li+>\)
Визначте кількість протонів, нейтронів та електронів у таких ізотопах, які використовуються при медичних діагнозах:
(а) атомний номер 9, масове число 18, заряд 1−
(b) атомний номер 43, масовий номер 99, заряд 7+
(c) атомний номер 53, атомний масовий номер 131, заряд 1−
(d) атомний номер 81, атомний масовий номер 201, заряд 1+
(e) Назвіть елементи у частинах (a), (b), (c) та (d).
Далі наведено властивості ізотопів двох елементів, які є важливими для нашого харчування: Визначте кількість протонів, нейтронів та електронів у кожному та назвіть їх.
(а) атомний номер 26, масовий номер 58, заряд 2+
(b) атомний номер 53, масовий номер 127, заряд 1−
(а) Залізо, 26 протонів, 24 електрони та 32 нейтрони; (б) йод, 53 протони, 54 електрони і 74 нейтрони
Вкажіть кількість протонів, електронів та нейтронів у нейтральних атомах кожного з наступних ізотопів:
Вкажіть кількість протонів, електронів та нейтронів у нейтральних атомах кожного з наступних ізотопів:
(а) 3 протони, 3 електрони, 4 нейтрони; (б) 52 протони, 52 електрони, 73 нейтрони; (c) 47 протонів, 47 електронів, 62 нейтронів; (г) 7 протонів, 7 електронів, 8 нейтронів; (д) 15 протонів, 15 електронів, 16 нейтронів
Клацніть на сайт і виберіть вкладку "змішати ізотопи", приховайте поля "процентний склад" і "середня атомна маса", а потім виберіть елемент бор.
(а) Запишіть символи для ізотопів бору, які у значних кількостях відображаються як природні.
(b) Передбачити відносні кількості (відсотки) цих ізотопів бору, що знаходяться в природі. Поясніть аргументи, які стоять за вашим вибором.
(c) Додайте ізотопи до чорного ящика, щоб отримати суміш, яка відповідає вашим прогнозам у (b). Ви можете перетягнути ізотопи з лотків або натиснути "Більше", а потім перемістити повзунки до відповідної кількості.
(d) Розкрийте поля "Процентний склад" та "Середня атомна маса". Наскільки ваш мікс відповідає вашим прогнозам? За потреби відрегулюйте величину ізотопу відповідно до вашого прогнозу.
(е) Виберіть із «Природи» ізотопну суміш і порівняйте її зі своїм прогнозом. Наскільки ваш прогноз порівнюється із природною сумішшю? Поясніть. Якщо потрібно, скоригуйте свої суми, щоб вони максимально відповідали сумам "Природа".
Повторіть вправа з використанням елемента, який має три природні ізотопи.
Візьмемо неон як приклад. Неон має три ізотопи, і немає жодної можливості точно передбачити кількість, щоб загалом скласти 20,18 аму середньої атомної маси. Припустимо, що його кількість становить 9% Ne-22, 91% Ne-20 і лише сліди Ne-21. Середня маса склала б 20,18 аму. Перевірка природної суміші ізотопів показує, що його вміст становить 90,48% Ne-20, 9,25% Ne-22 та 0,27% Ne-21, тому наші оцінки потрібно трохи скорегувати.
Елемент має наступні природні достатки та ізотопні маси: 90,92% чисельності при 19,99 аму, 0,26% адекватності при 20,99 аму та 8,82% достатку при 21,99 аму. Обчисліть середню атомну масу цього елемента.
Середні атомні маси, перераховані IUPAC, базуються на дослідженні експериментальних результатів. Бром має два ізотопи 79 Br і 81 Br, маси яких (78,9183 та 80,9163 аму) та вміст (50,69% та 49,31%) були визначені в попередніх експериментах. На основі цих експериментів обчисліть середню атомну масу брому.
Зміни середньої атомної маси можна спостерігати для елементів, отриманих з різних джерел. Прикладом цього є літій. Ізотопний склад літію з природних мінералів становить 7,5% 6 Li та 92,5% 7 Li, що має масу 6,01512 аму та 7,01600 аму, відповідно. Комерційне джерело літію, що переробляється з військових джерел, становило 3,75% 6 Li (а решта 7 Li). Обчисліть середні значення атомної маси для кожного з цих двох джерел.
Середні атомні маси деяких елементів можуть змінюватися залежно від джерел їх мінералів. Природний бор складається з двох ізотопів з точно відомими масами (10 Б, 10,0129 аму та 11 Б, 11,0931 аму). Фактична атомна маса бору може коливатися від 10 807 до 10819, залежно від того, джерелом мінеральних речовин є Туреччина чи США. Обчисліть відсоток достатку, який веде до двох значень середніх атомних мас бору для цих двох країн.
Джерело в Туреччині: 0,2649 (від 10,0129 ізотопу аму); Джерело в США: 0,2537 (від 10,0129 ізотопу аму)
Коефіцієнт вмісту 18 O: 16 O в деяких метеоритах вищий, ніж той, який використовується для розрахунку середньої атомної маси кисню на землі. Чи середня маса атома кисню в цих метеоритах більша, менша або дорівнює масі земного атома кисню?
2.4: Хімічні формули
Поясніть, чому символ атома елемента кисень і формула молекули кисню відрізняються.
Символ елемента кисень, O, представляє як елемент, так і атом кисню. Молекула кисню, O2, містить два атоми кисню; Індекс 2 у формулі слід використовувати для розрізнення двоатомної молекули від двох окремих атомів кисню.
Поясніть, чому символ елемента сірка та формула молекули сірки відрізняються.
Напишіть молекулярні та емпіричні формули для таких сполук: