Перегляньте статті та зміст, опубліковані в цьому носії, а також електронні зведення наукових журналів на момент публікації
Будьте в курсі завжди, завдяки попередженням та новинам
Доступ до ексклюзивних рекламних акцій на підписки, запуски та акредитовані курси
Індексується у:
Excerpta Medica/EMBASE, IBECS, IME, SCOPUS та MEDLINE/PubMed
Слідуй за нами:
CiteScore вимірює середні цитати, отримані за опублікований документ. Читати далі
SRJ - це престижна метрика, заснована на ідеї, що не всі цитати однакові. SJR використовує подібний алгоритм, як рейтинг сторінки Google; він надає кількісний та якісний показник впливу журналу.
SNIP вимірює вплив контекстного цитування шляхом оцінки цитат на основі загальної кількості цитат у тематичному полі.
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Історична довідка про алопуринол
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Історична довідка про алопуринол
- Структура ферменту ксантиноксидоредуктази
- Роль ксантиноксидази у пошкодженні м’язів, пов’язаному з великими фізичними вправами
- Роль алопуринолу у лікуванні первинної та вторинної саркопенії
- Завершення
- Фінансування
- Конфлікт інтересів
- Бібліографія
Ксантиноксидаза (XO) - це фермент, який каталізує окислення гіпоксантину до ксантину, а від цього - до сечової кислоти, відіграючи таким чином важливу роль у катаболізмі пуринів. Аллопуринол, аналог пурину, є відомим інгібітором XO, який широко застосовується в клінічній практиці для лікування подагри.
Недавні дослідження показують, що алопуринол зменшує окислювальний стрес і покращує судинну функцію при різних кардіометаболічних захворюваннях, збільшує час фізичних вправ у пацієнтів із стенокардією та покращує ефективність скорочувальної здатності міокарда при серцевій недостатності. XO також відіграє важливу роль у виробленні вільних радикалів під час скорочення м’язів, і тому його пов’язують із пошкодженням м’язів, пов’язаним із великими фізичними вправами. Різні дослідницькі групи продемонстрували захисний ефект алопуринолу у запобіганні такого типу пошкодження.
Беручи до уваги ці попередні дані, в цій роботі ми розглянули можливість вивчення можливої ролі алопуринолу в лікуванні саркопенії, гериатричного синдрому, що характеризується прогресуючою та генералізованою втратою м’язової маси та сили, що означає підвищений ризик інвалідності та низької якості життя і смерті.
Ксантиноксидаза (XO) - це фермент, який каталізує окислення гіпоксантину до ксантину та сечової кислоти та відіграє важливу роль у катаболізмі пуринів. Пуриновий аналог, алопуринол, є добре відомим інгібітором XO, який широко застосовується у клінічному лікуванні подагри та станів, пов'язаних з гіперурикемією. Пізніші дані вказують на те, що алопуринол зменшує окислювальний стрес та покращує судинну функцію при ряді кардіометаболічних захворювань, подовжує час фізичних вправ при стенокардії та покращує ефективність серцевої скорочувальної здатності при серцевій недостатності. XO також відіграє важливу роль у генерації вільних радикалів під час скорочення скелетних м’язів, і, отже, це пов’язано з пошкодженням м’язів, пов’язаним із вичерпними фізичними вправами. Кілька дослідницьких груп продемонстрували захисний ефект алопуринолу в профілактиці цього типу пошкоджень.
Виходячи з цього, представлений критичний огляд можливої ролі алопуринолу у лікуванні саркопенії, гериатричного синдрому, що характеризується прогресуючою та генералізованою втратою маси та сили скелетних м’язів із ризиком несприятливих наслідків, таких як фізична інвалідність, поганий стан якість життя та смерті.
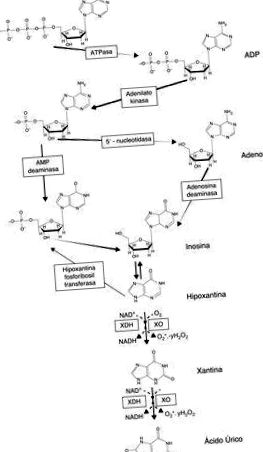
Шлях деградації пуринів та продукування вільних радикалів ксантиноксидазою.
По відношенню до його фармакокінетики, алопуринол швидко всмоктується і досягає пікових концентрацій у плазмі через 30-60 хв після перорального прийому. Оксипуринол має нижчу біодоступність для прийому всередину, ніж алопуринол. Період напіввиведення алопуринолу в плазмі становить 2-3 години, тоді як у оксипуринолу набагато більше, 14-30 годин, через реабсорбцію нирками. .
Все більше доказів демонструють роль XO при ішемії та інших типах судинних та запальних захворювань, а також при хронічній серцевій недостатності. Можлива роль, набагато новіша, у запобіганні втраті м’язової маси та сили, пов’язаній із віком (саркопенія) 6, або процесах іммобілізації 7, гальмуючи це, є предметом цього огляду.
Структура ферменту ксантиноксидоредуктази
Фермент ксантиноксидоредуктаза (XOR) - це фермент, спочатку описаний як альдегідоксидаза в 1902 р. 8. Цей фермент широко поширений серед живих істот різної складності, і його існування було продемонстровано в таких простих організмах, як бактерії, для найбільш сформованих ссавців, таких як людина 5. Цей фермент у різних видів каталізує гідроксилювання широкого спектра субстратів, таких як пурини, піримідини, птерини та альдегіди. XOR синтезується у вигляді ксантиндегідрогенази (XDH) і залишається здебільшого як такий у клітині, але його можна швидко перетворити у форму XO шляхом окислення сульфгідрильних залишків або шляхом протеолізу 9. Це перетворення відбувається лише в XOR ссавців, включаючи людину та щурів 10, на відміну від інших видів, таких як птахи, у яких не спостерігалося перетворення в XO. Обидві ферментні форми, XDH і XO, є продуктом одного і того ж гена, мають однаковий розмір, однакову кількість субодиниць і потребують однакових кофакторів 10 .
Подібно до того, як XO пов'язаний з різними патологічними процесами і спричинює окисне пошкодження тканин, XDH може бути важливим компонентом захисту організму від пошкоджень, спричинених вільними радикалами (RL) під дією сечової кислоти, яка є потужним антиоксидантом 11 .
Роль ксантиноксидази у пошкодженні м’язів, пов’язаному з великими фізичними вправами
Заняття фізичними вправами надають багато переваг для здоров'я, оскільки вони запобігають передчасній смертності та розвитку серцево-судинних захворювань, гіпертонії, раку, діабету, ожиріння та остеопорозу, серед інших 16. Однак одним із найважливіших аспектів призначення фізичних вправ є інтенсивність, з якою вона повинна виконуватися 17 .
У 1954 р. Була опублікована перша робота, в якій наявність RL було продемонстровано в скелетних м'язах за допомогою електронного парамагнітного резонансу 18. Однак його біологічне значення було очевидним лише через роки, коли було встановлено взаємозв'язок між функцією м'язів та біологією РЛ. У 1978 році фізичні вправи були пов'язані зі збільшенням перекисного окислення ліпідів 19. Через два роки Корен та ін. показали, що РЛ збільшуються в скелетних м'язах як наслідок скорочення м'язів 20. У 1982 р. Група Лестера Пакера опублікувала те, що вважається найвпливовішою роботою в цій області, і в якій вони показали, що вміст RL зростає в 2-3 рази в м'язах тварин, які вправляються до виснаження, і що вони пов'язані з м'язовою втомою 21 . П'ять років потому Джексон та ін. орієнтувати ефект RL на пошкодження м’язів, спричинені фізичними вправами, та продемонструвати захисну роль вітаміну Е 22 .
Шляхи виробництва RL різноманітні у скелетних м’язах під час скорочення м’язів 23 (рис. 2). Мітохондрії роками розглядалися як одне з основних джерел RL в скелетних м’язах завдяки своїй ролі у виробництві супероксиду в комплексах I та III електронного транспортного ланцюга 24,25. Однак останні результати свідчать про те, що мітохондрії можуть не відігравати критично важливу роль як джерело РЛ у вправі 26 .
Джерела вільних радикалів у скелетних м’язах.
Іншим джерелом RL є оксидази NAD (P) H. Різні дослідження виявили ці ферменти, пов’язані із саркоплазматичним ретикулумом, поперечними канальцями та плазматичною мембраною скелетних та серцевих м’язів 23. Цей фермент переважно використовує NADH як субстрат. Супероксид, що утворюється цими ферментами, впливає на вивільнення кальцію в саркоплазматичному ретикулумі шляхом окислення ріанодинового рецептора 27 .
Фосфоліпаза А2 - ще одне можливе джерело РЛ у скелетних м’язах. Цей фермент виробляє арахідонову кислоту, яка є субстратом для активації RL-генеруючих ферментів, таких як ліпоксигеназа, з мембранних фосфоліпідів 23. З іншого боку, активація фосфоліпази А2 може стимулювати NAD (P) H оксидази 23 .
Іншим важливим джерелом RL в скелетних м’язах є XO. Як ми коментували в попередніх розділах, є багато доказів, що демонструють роль XO при ішемії 5. Метаболічні умови скелетних м’язів під час напружених фізичних навантажень багато в чому імітують стан ішемізованої тканини 28, що сприятиме перетворенню XOR в його оксидазну форму в умовах метаболічного стресу, такого як ішемія 28. Під час вправ високої інтенсивності або на останніх фазах тривалих фізичних вправ виникає метаболічний стрес із зниженням рівня нуклеотидів аденіну та збільшенням утворення гіпоксантину 29, субстрату для XO. Отже, наявність високих рівнів субстрату гіпоксантину дозволило б виробляти високі рівні RL у м’язі за допомогою цього ферменту.
Інтерес до можливості того, що RL може брати участь у пошкодженні м’язів, яке виникає після важких фізичних вправ, виник через спостереження, що міопатія, пов’язана з дефіцитом вітаміну Е у тварин, прискорюється фізичними вправами 30. У 1982 р. ЛР, отримані під час напружених фізичних навантажень, вперше були пов’язані з пошкодженням тканин у експериментальних тварин 31. Через рік було показано, що дефіцит вітаміну Е спричиняє значне зниження аеробної витривалості 32, і це, в свою чергу, посилює пошкодження м’язів, яке виникає в стресових умовах як в дослідженнях in vivo, так і in vitro 33,34 .
Так само наша група показала, що окислювальний стрес, пов'язаний із фізичними вправами до виснаження, активує сигнальні шляхи, такі як MAP-кінази та запальний каскад NF-кB в скелетних м'язах, які інгібуються при введенні алопуринолу перед виконанням цього виду вправ 43 . Ці результати були частково підтверджені нещодавно 44 .
Помітивши, що введення алопуринолу позитивно впливає на запобігання пошкодженню м’язів, його застосування поширюється і на інші стани, при яких пошкодження або атрофія м’язів опосередковується окислювальним стресом, таких як описані нижче.
Роль алопуринолу у лікуванні первинної та вторинної саркопенії
Саркопенія - це гериатричний синдром, що характеризується прогресуючою та генералізованою втратою сили та маси скелетних м’язів, що супроводжується підвищеним ризиком таких несприятливих явищ, як інвалідність, низька якість життя та смерть 45,46. Саркопенію можна класифікувати як первинну (пов’язану з віком), коли немає жодної очевидної причини, яка б це пояснювала, крім старіння як такої. Він класифікується як вторинний, коли відповідає одна або кілька причин. У цьому сенсі вторинна саркопенія може бути пов’язана з низькою фізичною активністю (малорухливий спосіб життя, іммобілізація, невагомі стани), із захворюваннями (розвинена недостатність органів, запальні або ендокринні захворювання) або з харчовими аспектами (недостатнє споживання білка, погане всмоктування, шлунково-кишкові розлади) ) 45 .
Старіння людини пов’язане із втратою м’язової маси, яка починається в четвертому десятилітті життя з втратою сили на 1% на рік і яка прискорюється протягом 47 років. Функціональна слабкість, пов'язана з саркопенією, вражає приблизно 7% дорослих людей старше 70 років та 20% людей старше 80 років 48,49 років. Процес старіння пов'язаний не тільки зі зменшенням м'язової маси та максимальної сили, але і зі зменшенням здатності нервово-м'язової системи виробляти вибухову силу. Це зниження є навіть більш різким, ніж те, що спостерігається при виробленні максимальної сили для тієї ж групи м’язів, досягаючи приблизно 3,5% втрат на рік, між 65 і 84 роками 50. Подібним чином, зі старінням спостерігається більше зменшення частки площі, що займають м’язові волокна, що швидко смикаються (тип II), у порівнянні з площею, що займають м’язові волокна, що повільно смикаються (тип I) 51 .
Серед факторів, пов'язаних із втратою функціональності скелетних м'язів, можна виділити: зміни в синтезі та деградації білків, запалення, гормональні зміни та дисфункцію мітохондрій 6. Більшість цих змін пов'язані з окислювальним стресом 52,53 .
Різні дослідницькі групи, в тому числі наша 54, спостерігали збільшення активності XO у м’язах старих тварин (Lambertucci et al., 2007; Hofer et al., 2008; Ryan et al., 2011a). Ці дослідження пов’язали це збільшення активності XO з окислювальним стресом, зменшенням м’язової маси (Hofer et al., 2008), максимальною аеробною швидкістю (Lambertucci et al., 2007), а також м’язовою силою (Ryan et al., 2011).
Аналогічно недавньому дослідженню, проведеному серед людей похилого віку, було розглянуто зв'язок між використанням алопуринолу та функціональними результатами тесту Бартеля після реабілітації у 3593 прийнятих пацієнтів, з яких 3% (102 пацієнти) отримували лікування алопуринолом. Результати показали вищі показники Бартеля в групі, яка отримувала алопуринол (4,7 бала), порівняно з нелікованими (3,6 бала), вказуючи на те, що лікувані пацієнти були більш незалежними та мали більшу функціональність на момент виконання повсякденного життя 55. Ці результати дозволяють припустити, що застосування алопуринолу пов’язане з більшим ступенем поліпшення функції, як вимірюється за допомогою індексу Бареля під час реабілітації серед популяції літніх пацієнтів.
Стосовно вторинної саркопенії є дані, що лікування алопуринолом може її покращити. Перше дослідження, в якому алопуринол вводили як протираковий засіб, показало, що його використання різко індукує апоптоз у клітинах раку простати людини 56. Згодом його застосовували для зниження високого рівня сечової кислоти, що виробляється певними препаратами при лікуванні раку. Нещодавно алопуринол був розпочатий для лікування ракової асоційованої кахексії. Спрінгер та ін. індукуючи експериментальну кахексію шляхом ін'єкції ракових клітин гепатоми у експериментальних тварин, що інгібування активності XO суттєво знижує рівні окисного стресу та активність системи протеасом убіквітину. Це призвело до збереження м’язової маси і, отже, до зменшення кахексії у тварин, у яких розвинулися пухлини, оброблені алопуринолом або оксипуринолом, порівняно з необробленими 57,58 .
Вважається, що цих показань слід дотримуватися під час старіння 64. Якщо можливий терапевтичний моніторинг, дози слід відкоригувати до значень концентрації оксипуринолу в плазмі 5-8 мкг мл -1 (40-60 мкМ). Важливо зазначити, що рівні, набагато вищі за рівні, необхідні для пригнічення активності ХО, виявляються, коли концентрація оксипуринолу в плазмі крові визначається у пацієнтів, які хронічно отримують алопуринол. Тому здається, що загалом такі пацієнти отримують надмірні дози алопуринолу.
У літературі є безліч доказів про роль вільних радикалів, що походять від XO, у появі та розвитку первинної та вторинної саркопенії. Інгібування ферменту введенням алопуринолу показало багатообіцяючий вплив на підтримку м’язової сили та маси після періодів іммобілізації або на експериментальних моделях кахексії. Подібним чином була продемонстрована роль алопуринолу у підтримці незалежності та функціональності у пацієнтів похилого віку. На наш погляд, алопуринол можна розглядати як можливе лікування саркопенії, хоча його доза повинна бути дуже добре відкоригована, щоб уникнути можливих несприятливих наслідків.
Ця робота була проведена завдяки фінансуванню, отриманому за допомогою грантів: ISCIII2006-RED13-027 від Тематичної мережі спільних досліджень щодо старіння та неміцності (RETICEF); PROMETEO 2010/074 Міністерства охорони здоров’я Женералітат Валенсіяна; 35NEURO GentxGent Фонду Gent Per Gent Валенсійської громади; PI11/01068 ISCIII та COSTB35 та CM1001, що фінансуються ЄС.
Конфлікт інтересів
Автори заявляють, що у них немає конфлікту інтересів.
- Аневризма черевної аорти та захворювання судин нирок Revista Española de Cardiología
- Їжа для діаб; тикос; потреба або маркетинг; Іспанський журнал харчування та дієтології людини
- Вчені вважають таке лікування схуднення безпечним
- 10 речей, які ви повинні знати про лікування ХГЧ для схуднення
- Закриття Percut; нео спілкування; російська міжусобна; Коротко- та середньострокові результати Журнал