предметів
реферат
Безалкогольна жирова хвороба печінки (НАЖХП) - одне з найпоширеніших захворювань печінки, але її механізм недостатньо вивчений. Тут ми показали, що ядерний фактор 4a гепатоцитів (HNF4a), збагачений печінкою ядерний гормональний рецептор, помітно пригнічується, тоді як miR-34a сильно індукується у пацієнтів з неалкогольним стеатогепатитом, мишей з діабетом та мишей, які харчуються високим вмістом жиру дієта. miR-34a є важливим для експресії HNF4a та регулює накопичення тригліцеридів у гепатоцитах людини та миші. miR-34a інгібує секрецію ліпопротеїдів дуже низької щільності та сприяє стеатозу печінки та гіполіпідемії в залежності від HNF4a. Як результат, збільшення експресії miR-34a або зниження експресії HNF4a в печінці послаблює розвиток атеросклерозу у мишей Apoe -/- або Ldlr -/-. Ці дані вказують на те, що шлях miR-34a-HNF4a активується в нормальних умовах метаболічного стресу і може відігравати певну роль у патогенезі НАЖХП та регуляції метаболізму ліпопротеїдів у плазмі крові. Зосередження уваги на цьому шляху може представляти новий підхід до лікування НАЖХП.
Ожиріння, діабет та інсулінорезистентність є загальними факторами ризику розвитку неалкогольної жирової хвороби печінки (НАЖХП) 1, 2, 3, однієї з найпоширеніших захворювань печінки у всьому світі. У США до 25% населення мають НАЖХП 4,5. NAFLD ініціюється простим стеатозом, який може перерости в неалкогольний стеатогепатит (NASH) після багаторазових "ударів", включаючи медіатори запалення, активні форми кисню (АФК) тощо, 4, 6, 7. NASH може прогресувати до цирозу печінки та гепатоцелюлярної карциноми. На сьогоднішній день механізм, що лежить в основі патогенезу НАЖХП, недостатньо вивчений. Отже, сучасне лікування НАЖХП обмежується лікуванням асоційованих синдромів, таких як діабет та ожиріння 8, 9 .
Ядерний фактор 4a гепатоцитів (HNF4a) є рецептором ядерного гормону, який відіграє важливу роль як у розвитку, так і у фізіології дорослих. Він сильно експресується в печінці, з нижчим рівнем β-клітин нирок, кишечника та підшлункової залози 10, 11. HNF4a має висококонсервативний домен, що зв'язує ДНК, і домен, що зв'язує ліганд. Структурний аналіз HNF4α свідчить про те, що жирні кислоти з довгим ланцюгом C14 - C18 тісно зв’язані з гідрофобною капсулою HNF4α і не можуть відокремлюватися від рецептора в неденатураційних умовах 12, 13. Таким чином, HNF4α є конститутивно активним.
HNF4a контролює базальну експресію багатьох генів, що беруть участь в метаболізмі жовчних кислот, ліпідів, глюкози та ліків. Мутації втрати функції у людини HNF4α викликають цукровий діабет типу 1 (MODY1) із настанням зрілості, що характеризується аутосомно-домінантним успадкуванням, раннім початком діабету та дисфункцією β-клітин підшлункової залози14. Фенотип діабету, як видається, зумовлений зниженою стимульованою глюкозою секрецією інсуліну в підшлунковій залозі 15. На додаток до фенотипу діабету, пацієнти з MODY1 також знижували рівень тригліцеридів у плазмі крові (TG) та рівень холестерину 16, 17, 18, мабуть, через порушену секрецію дуже низької щільності ліпопротеїнів (ЛПНЩ) у печінці 19. Відповідно до зменшення секреції ЛПНЩ, ми та інші показали, що втрата печінкового HNF4α призводить до жирової печінки та гіполіпідемії у мишей 19, 20 .
МікроРНК (miРНК) - це невеликі некодуючі молекули РНК, які регулюють експресію генів при транскрипційному зв'язуванні з 3'-нетрансліруваною областю (3'UTR) мРНК. Показано, що міРНК є важливими регуляторами клітинної проліферації, запалення та метаболізму. Недавні дослідження показали, що мікроРНК печінки можуть мати значний вплив на метаболізм ліпідів та ліпопротеїнів 21, 22, 23 .
У цьому звіті ми досліджуємо роль шляху miR-34a-HNF4α у патогенезі НАЖХП людини та метаболізмі ліпідів та ліпопротеїдів плазми. Наші дані показують, що цей шлях активується як у пацієнтів NASH, так і у хворих на цукровий діабет або мишей з високим вмістом жиру (HFD). Потім ми досліджуємо, чи і як цей шлях регулює метаболізм ліпідів печінки та плазми та/або ліпопротеїдів. Нарешті, ми досліджуємо, які метаболічні стимули стимулюють активацію цього шляху. Наші дані свідчать про те, що шлях miR-34a-HNF4a може бути привабливою мішенню для лікування НАЖХП людини.
результат
Зворотна регуляція експресії HNF4a та miR-34a in vivo
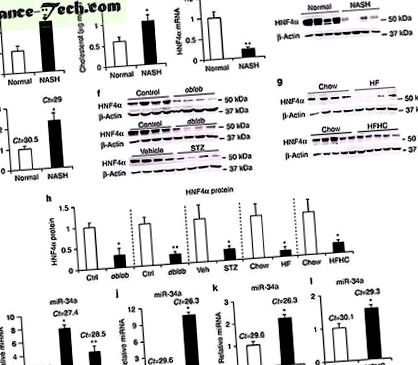
Ми та інші раніше показували, що втрата печінкового HNF4α викликає у мишей жир 19, 20. Оскільки HNF4α є дуже консервативним серед людей та гризунів, ми досліджували роль HNF4α у розвитку НАЖХП людини. У порівнянні з нормальними випробовуваними, у пацієнтів з НАСГ підвищений рівень печінкового ТГ (рис. 1а) та рівень холестерину (рис. 1б). Примітно, що рівні печінкової мРНК HNF4α знижувались на 80% (рис. 1в), а рівні білка HNF4α майже не виявлялись (рис. 1г та додаткова фігура 1а) у пацієнтів NASH. Відповідно до помітного зниження експресії печінкового HNF4α, кількість генів-мішеней HNF4α також була значно зменшена у пацієнтів з NASH (Додаткова таблиця 1). Показано, що мікроРНК відіграють певну роль у розвитку НАЖХП 24, 25. У печінці пацієнтів з NASH, miR-34a (рис. 1e), але не miR-19b або miR-27b (додаткова фігура 1b), індукується> у 2 рази.
Щоб зрозуміти, як miR-34a регулює експресію HNF4a, ми дослідили, чи зв'язується miR-34a з 3'UTR HNF4a. У 3'UTR HNF4a людини та миші є два дуже консервативні сайти зв'язування miR-34a (додаткова фігура 8a, b). Як показано на фіг. 3i, міметик miR-34a суттєво пригнічував активність промотору люциферази, зв’язаного з Hnf4a3'UTR, і ця репресія була скасована, коли мутував другий сайт зв'язування miR-34a (mutB). Для підтвердження даних in vitro ми надмірно експресували область кодування Hnf4a плюс дикий тип або мутант 3′UTR у мишей, специфічних для печінки, Hnf4a -/-. Надмірна експресія miR-34a суттєво знижувала екзогенні рівні білка HNF4a, коли кодуюча область Hnf4a асоціювалася з диким типом 3′UTR або 3′UTR з мутаціями в першому місці зв'язування miR-34a (mutA), і це зменшення було скасовано, коли область кодування Hnf4a була сплавлена до 3 toUTRs з mutB (рис. 3j). Таким чином, наші дані in vitro та in vivo вказують, що miR-34a інгібує експресію Hnf4a через зв'язування з другим сайтом зв'язування 3'UTR.
HNF4α регулює атерогенез та енергетичний обмін
Втрата функціональних мутацій HNF4α викликає гіполіпідемію у пацієнтів із MODY. Поки невідомо, чи захищають пацієнти з MODY1 від атеросклерозу. Оскільки печінковий HNF4α значно знижується при різних метаболічних стресах (рис. 1), ми досліджували вплив гострої та хронічної втрати печінкової HNF4α на розвиток атеросклерозу. Гострий нокдаун печінкового Hnf4a шРНК у мишей Apoe -/- протягом 3 тижнів спричиняв> 50% зниження загального рівня холестерину в плазмі та 30% зниження рівня TG у плазмі у західній дієті (додаткова фігура 9a-c). Аналіз профілів ліпопротеїдів у плазмі крові за допомогою рідинної хроматографії з білковими білками (FPLC) показав, що втрата печінкового Hnf4a знижує рівень холестерину ЛПНЩ і ЛПНЩ у плазмі крові (рис. 4а) і ТГ ЛПНЩ (рис. 4б). Послідовно із змінами ліпідів та ліпопротеїдів у плазмі крові, гострий нокдаун печінкового Hnf4α у мишей Apoe -/- зменшив розміри аортальних уражень> 50% (рис. 4в та додатковий рис. 9г). Крім того, втрата печінкового Hnf4a у мишей Apoe -/- збільшувала накопичення TG у печінці (рис. 4г) та зменшувала експресію білка MTP та ApoB (додаткова фігура 9e). Ці дані вказують на те, що гостра втрата печінкового HNF4α зменшує розвиток атеросклерозу в Апое -/- .
Печінковий miR-34a пригнічує атерогенез у Ldlr -/мишей -
Висновок про те, що miR-34a регулює метаболізм ліпідів шляхом інгібування HNF4α (рис. 3), привів нас до питання, чи регулює miR-34a також розвиток атеросклерозу. Надмірна експресія miR-34a у мишей Ldlr -/-, які харчувалися західною дієтою, знижувала загальний рівень холестерину в плазмі крові (рис. 5а) і рівень ТГ (рис. 5б). Дані аналізу FPLC показали, що miR-34a знижує рівень ЛПНЩ та ЛПНЩ (рис. 5в), а також рівень ТГ ЛПНЩ (рис. 5г). Як результат, надмірна експресія miR-34a в печінці зменшила розмір атеросклеротичних уражень на> 50% як у коренях аорти (рис. 5e, f), так і в аорті (рис. 5g, h) мишей Ldlr -/-. У печінці надмірна експресія miR-34a у мишей Ldlr -/- пригнічувала експресію печінки HNF4a, ApoB100 та ApoB48 (рис. 5i) та підвищений рівень TG у печінці (додаткова фігура 11). Таким чином, або надмірна експресія печінкового miR-34a (рис. 5), або інгібування печінкового HNF4α (рис. 4) може забезпечити захист від розвитку атеросклерозу.
80%. В результаті деякі відомі гени-мішені Hnf4a також зменшуються, тоді як деякі інші залишаються незмінними у цих мишей (Додаткова таблиця 2). Інші селективні фактори також можуть сприяти селективній регуляції генів-мішеней HNF4a у мишей, що харчуються HFD.
Чой та ін. 38 зазначає, що miR-34a також знижує рівень NAD + та активність SIRT1, націлюючи NAMPT, фермент, що обмежує швидкість синтезу NAD +. Хоча відомо, що SIRT1 відіграє важливу роль у метаболічному контролі, включаючи метаболізм печінкової ТГ, залишається визначити, чи відіграє роль SIRT1 у метаболізмі TG, регульованому miR-34a. Згідно з нашими переконливими даними, miR-34a підвищує рівень ТГ у печінці, інгібуючи HNF4a. Цікаво, що надмірна експресія miR-34a вибірково регулює деякі цільові гени HNF4a (рис. 3), що може бути результатом неповного пригнічення експресії HNF4a та незалежної від HNF4a регуляції генів.
Ще однією важливою знахідкою цього дослідження є те, що ми демонструємо, що шлях miR-34a-HNF4a також регулює метаболізм плазмосодержащих ліпопротеїнів ApoB та розвиток атеросклерозу. Відомо, що підвищений рівень ліпопротеїнів, що містять ApoB, прискорює розвиток атеросклерозу. Наші дані вказують на те, що шлях miR-34a-HNF4a сприяє гіполіпідемії, пригнічуючи секрецію ЛПНЩ. Відповідно до цього висновку, повідомляється, що у пацієнтів з НАСГ знижується секреція ЛПНЩ 39. Через гіполіпідемію або надмірна експресія miR-34a, або інгібування/абляція експресії печінкового Hnf4a запобігає розвитку атеросклерозу у мишей Apoe -/- або Ldlr -/-. Ці дані забезпечують перші докази того, що шлях miR-34a-HNF4a регулює розвиток атеросклерозу. На основі наших досліджень буде цікаво визначити, чи захищені пацієнти з НАСГ та/або пацієнти з MODY1 від атеросклерозу.
Окрім з'ясування ролі шляху miR-34a-HNF4α у регуляції обміну ліпідів та ліпопротеїдів, ми також дослідили, як цей шлях активується при нормальному метаболічному стресі. Наші дані свідчать про те, що шлях miR-34a-HNF4a активується як за допомогою p53-залежного, так і p53-незалежного методів (рис. 6j). У пацієнтів з NASH p53, FFA та холестерин можуть співпрацювати для активації шляху miR-34a-HNF4a. Однак p53 не активується при індукованому HFD діабеті або ожирінні. Таким чином, за останніх умов FFA та холестерин можуть бути основними факторами, що викликають активацію шляху miR-34a-HNF4a. Одним з наших майбутніх напрямків буде дослідити, як FFA та холестерин активують шлях miR-34a-HNF4α та чи задіяні інші метаболічні стимули в регуляції цього шляху.
Підсумовуючи, це дослідження показало, що метаболічний шлях, індукований шляхом miR-34a-HNF4a, може відігравати вирішальну роль у патогенезі НАЖХП та регуляції метаболізму ліпідів та ліпопротеїдів у плазмі крові. Хоча втрата печінкового HNF4α благотворно впливає на атеросклероз та енергетичний гомеостаз, втрата HNF4α печінки спричиняє жирову печінку, пригнічуючи секрецію ЛПНЩ. Таким чином, з терапевтичної точки зору придушення експресії печінкового HNF4α, разом із підходами, що полегшують стеатоз печінки, може бути корисним для запобігання розвитку атеросклерозу. Навпаки, надмірна експресія печінкового HNF4α не робить значного впливу на метаболізм ліпідів або ліпопротеїдів у плазмі крові, оскільки HNF4α є одним із найпоширеніших генів у печінці 19. Оскільки експресія HNF4α значно зменшується при метаболічному стресі (діабет, HFD та NASH), доставка HNF4α через аденоасоційований вірус або інший носій (и) генної терапії є життєздатним та привабливим підходом до профілактики та лікування НАЖХП, пов’язаного з метаболічним стрес. синдром. Антагонізм функції печінки антагоміром miR-34a також є життєздатним підходом, який може допомогти запобігти розвитку НАЖХП. Таким чином, орієнтування на шлях miR-34a-HNF4a представляє перспективний та привабливий підхід до лікування НАЖХП людини.
методи
Тканини людини печінки, миші та дієта
Мутагенез, трансфекції та культура клітин
аденовіруси
Ad-shLacZ, Ad-HNF4a, Ad-shHNF4a, Ad-empty (контроль) та Ad-miR-34a були описані раніше 19, 35. Коли конструювали Ad-HNF4a, в аденовірусний вектор клонували лише область кодування Hnf4a (яка не містить 3′UTR). На відміну від них, Ad-HNF4a-3'UTR, Ad-HNF4a-3'UTR_mutA та Ad-HNF4a-3'UTR_mutB були створені клонуванням кодуючої області Hnf4a плюс дикий тип або мутант 3'UTR (з mutA або mutB) у pAd/CMV/V5-Dest вектор (каталог V493-20, Life Technologies) з подальшою трансфекцією в 293 клітини для отримання аденовірусу 40. Ad-p53 був придбаний у компанії Vector Biolabs (кат. № 1168). Ad-anti-miR-34a генерували за допомогою прикладних біологічних матеріалів (Британська Колумбія, Канада). Клітини інфікували аденовірусами при кратності зараження (MOI) 5. Мишам вводили внутрішньовенно (iv) від 0,5 до 1,5 х 109 пфу аденовірусів. Якщо не вказано інше, мишей забивали через 7 днів після зараження.
ПЛР у режимі реального часу
РНК виділяли за допомогою реагенту TRIzol (Life Technologies, CA). МіРНК виділяли за допомогою набору ізоляції міРНК mirVana (Life Technologies, Каліфорнія). Рівні MRNA визначали кількісною ланцюговою реакцією полімеразної зворотної транскрипції (qRT-PCR) на ПЛР-машині в реальному часі 7500 від Applied Biosystems (Фостер-Сіті, штат Каліфорнія), використовуючи SYBR Green Supermix (Roche, Indianapolis, IN). Результати розраховувались із використанням значень Ct та нормалізованих до рівнів мРНК 36B4. Кількісно визначали рівні МіРНК за допомогою праймерів і зондів TaqMan (каталог 4427975, Life Technologies, CA) і нормалізували до рівнів U6.
Аналізи мікроРНК Northern blot
Рівні мікроРНК також визначали за допомогою тестів Northern blot згідно з інструкціями виробника (Signosis, Санта-Клара, Каліфорнія. Cat # NB-1001). В аналізі Northern blot сукні для miR-34a (каталог MP-0602) та U6 (каталог MP-0512) також були від Signose.
Аналізи активності МТР
Печінку гомогенізували, а активність МТФ вимірювали відповідно до інструкцій виробника (Chylos, Inc, Woodbury, NY. Cat # R100).
Вестерн-блот-тести
Вестерн-блот-аналізи проводили з використанням цілих печінкових лізатів 41 або основних білків із зразків печінки, а зображення збирали за допомогою ImageQuant LAS 4000 (GE Healthcare, Пітсбург, Пенсільванія) 42. Антитіло до MTP (каталог sc-135994), антитіло HNF4a (каталог sc-6556) та антитіло p53 (каталог sc-6243) були придбані у компанії Santa Cruz Biotechnology (Санта-Крус, Каліфорнія). Антитіло ApoB було придбано у Meridian Life Science (K45253G, TN). Антитіло до β-актину було від Novus Biologicals (каталог NB600-501, CO). Антитіло до гістону отримували від Cell Signaling (Beverly, MA). Антитіла використовували в концентрації 1 мкг мл-1 .
Антагоміри
Інгібітор/антагомір LNA miR-34a (LNA-miR-34a; anta-miR-34a; anta-34a) та інгібітор/антагомір LNA, що скремблює LNA (LNA-scr; anta-scr) були синтезовані Exiqon (Данія, Cat # 199900 ). мишам ob/ob або мишам, які годували HFD (годували HF дієту протягом 12 тижнів), ін'єктували внутрішньовенно або anta-miR-34a, або anta-scr один раз на 6 днів (10 мг кг-1). Після трьох ін'єкцій мишей забивали.
Аналіз ліпідів та ліпопротеїдів
Приблизно 100 мг печінки гомогенізували в метанолі, а ліпіди екстрагували в хлороформі/метанолі (2: 1 об./Об.), Як описано. Потім кількісно визначали рівень тригліцеридів та холестерину печінки за допомогою реагентів Infinity від Thermo Scientific (Waltham, MA). Рівні ліпідів і глюкози в плазмі крові також визначали за допомогою реагентів Infinity. Профіль ліпопротеїнів плазми крові аналізували FPLC, як описано в 19. Коротко кажучи, після ін'єкції 100 мкл плазми ліпопротеїни запускали при 0,5 мл хв-1 у буфер, що містив 0,15 М NaCl, 0,01 М Na 2 HPO 4, 0,1 мМ EDTA, рН 7,5, і розділяли на суперозі 6 10/300 GL. колонка (GE Healthcare) за допомогою системи BioLogic DuoFlow QuadTec 10 (Bio-Rad, Каліфорнія). Збирали п’ятьсот мікролітрів зразка на фракцію.
Секреція ЛПНЩ
Мишам C57BL/6J вводили внутрішньовенно специфічні аденовіруси. На 6 день ці миші голодували протягом ночі з подальшим внутрішньовенним введенням Тилоксаполу (500 мг кг -1). Кров брали у визначені моменти часу та визначали рівень ТГ у плазмі крові.
З нового ліпогенезу
Мишам вводили ip важкою водою (2 H 2 O) для досягнення 3% збагачення. Через 4 год печінку збирали. Мічений і немічений пальмітат, гліцерин (тригліцериди) та холестерин аналізували за допомогою мас-спектрометрії 19, 44 .
Атеросклеротичні ураження
Аорту та корінь аорти було виділено та розсічено. Корінь аорти промивали забуференним фосфатом сольовим розчином, вкладали в суміш оптимальної температури різання, а потім заморожували на сухому льоду. Серійні кріосекції товщиною 7 мкм від середньої частини шлуночка до дуги аорти були зібрані на предметних стеклах із заморозками та мікроскопом (Каталог 12-550-15, Fisher Scientific). У регіоні, починаючи з клапанів аорти, збирали кожен інший зріз. Розріз корінця аорти або аорти на обличчі забарвлювали олійно-червоним кольором O та визначали розмір атеросклеротичного ураження за допомогою Image-Pro Premier 9.0 (Media Cybernetics, Rockville, MD) 45 .
Витрати енергії
Мишей, яких годували західною дієтою, поміщали в Комплексну лабораторну систему моніторингу тварин (CLAMS). Визначено споживання кисню, виробництво CO 2 та виробництво тепла 46. Коротше кажучи, мишей поміщали в клітини для клімату на 40–48 год. Після періоду аклімації мишей зважували і поміщали назад у клітку з кліматом з попередньо зваженою їжею. Газообмін вимірювали у мишей кожні 30 с. Повітря в приміщенні закачували в клітини калориметрії миші зі швидкістю 0,472–0,600 літрів на хвилину (LPM), а повітря з клітки відбирали при 0,4 LPM. Фізичну активність вимірювали одночасно за допомогою 16 інфрачервоних датчиків, розподілених на 19 см. Для аналізу були відібрані дані з полудня 1 дня до обіду 2 дня (EST).
Статистичний аналіз
Статистичну значимість аналізували за допомогою непарного двостороннього t-критерію Стьюдента або ANOVA (GraphPad Prisim, Каліфорнія). Усі значення виражаються як середнє значення ± sem. Різниці вважали статистично значущими при P