Предмети
Резюме
Довіритель
Гліобластоми (ГБМ) - найпоширеніша форма первинних пухлин головного мозку, яка може вражати дорослих пацієнтів будь-якого віку. Ці високо васкуляризовані та інфільтруючі пухлини стійкі до сучасних методів лікування та найчастіше призводять до летального результату менш ніж за 18 місяців. Сучасне лікування променевою терапією та використання темозоломіду забезпечують кращі результати для пацієнтів з метильованим профілем гена MGMT. 16, 17 Однак ефективність цього лікування, навіть із застосуванням антиангіогенних молекул (бевацизумаб), обмежена, і ця пухлина залишається невиліковною. Агресивна поведінка GBM, включаючи стійкість до сучасних методів лікування та рецидиви пухлин, пояснюється наявністю GBM-подібних клітин-попередників (GSC). 18, 19 Тому для термінового знищення цих невиліковних пухлин необхідно терміново розробити нові методи лікування, які конкретно націлені на GBM-подібні стовбурові клітини.
Використовуючи підхід до профілювання мікроРНК у колекції первинних культур гліомоподібних клітин, отриманих пацієнтом (GSC), ми показали, що кластер miR-302-367 призводить CMS до незворотного диференційованого стану та блокує їх здатність ініціювати та розвивати пухлини у природніх умовах. 20 У цьому дослідженні ми показуємо, що отриманий пацієнтом GSC, розроблений для стабільної та конститутивної експресії кластера miR-302-367, зміг вивільнити екзосоми, що містять miR-302-367. Ці екзосоми швидко інтерналізувались сусіднім ГСК, що призвело до зміни властивостей проліферації та проліферації залежно від miR-302-367. Ортотопічний ксенотрансплантат клітин, що експресують miR-302-367, разом із GSC ефективно змінювали розвиток пухлини в мозку мишей, демонструючи його терапевтичний потенціал для блокування рецидивів пухлини. Наше дослідження припускає, що клітинна терапія може бути інноваційним рішенням проти раку.
Результати
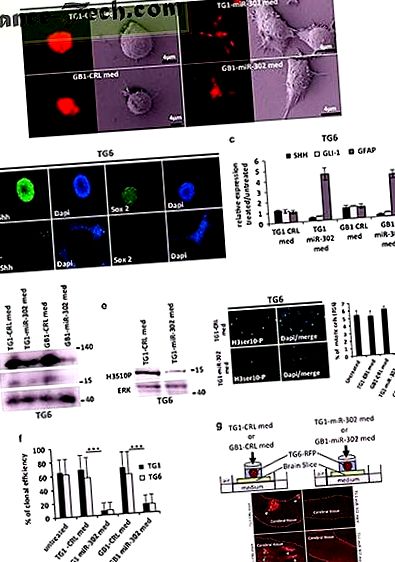
GSC, що експресує групу miR-302, паракрино пригнічує експресію, проліферацію та інфільтрацію SHH та SOX2.
Повнорозмірне зображення
Клітини TG1-miR-302 та GB1-miR-302 секретують екзосоми, здатні придушити потенцію та проліферацію GSC
Для ідентифікації молекул, відповідальних за протипухлинний ефект, була проведена ультрафільтрація на основі розміру кондиціонованого середовища. Зазначимо, що фракція з високою молекулярною масою (
Повнорозмірне зображення
Повний розмір таблиці
Кластер miR-302 переноситься в сусідні клітини за допомогою секреції екзосом
Повнорозмірне зображення
Повний розмір таблиці
Експресія групи miR-302 у GSC сприяє пригнічуючому ефекту паракринних пухлин in vivo
Результати цього підходу, отриманого нами на мишах, є принциповим доказом того, що клітинна терапія для лікування раку заслуговує на розгляд. На додаток до GSC, інші пацієнти, що секретують екзосоми, такі як макрофаги, можуть бути виділені від пацієнтів та генетично модифіковані для стабільної експресії терапевтичних молекул РНК для лікування пухлин.
Трансплантація цих клітин безпосередньо на місце пухлини під час хірургічного втручання дозволить тривало вводити екзосоми-супресори пухлини місцево, уникаючи важких і стресових періодичних ін’єкцій екзосом пацієнту.
На закінчення ми вважаємо, що наше дослідження викликає інтерес до використання клітинної терапії для доставки терапевтичних екзосом in situ для атаки GBM людини.
Матеріали і методи
Електронний мікроскоп
Динамічне розсіяння світла (DLS)
Вимірювання DLS проводили за допомогою Zetasizer Nano-ZS (Malvern Instruments, Malvern, Великобританія). Зразки розбавляли в 100 мкл 1 × PBS. 3 × 12 серії вимірювань проводили із застосуванням стандартних параметрів (показник заломлення = 1,33, температура = 25 ° С, в'язкість = 0,8882 та діелектрична проникність = 79,0). Результати були побудовані за допомогою OriginPro 2015.
Екстракція мікровезикул.
10 6/мл GSC у визначеному середовищі без мікровезикул (середовище NS34 +, Fareh та ін.). Через 72 год GSC видаляли центрифугуванням (276 xg, 4 ° C, протягом 5 хв) і кондиційну середу збирали, фільтрували через 0,2 мкм фільтр (Millipore, Fontenay sous Bois, Франція) та концентрували. за допомогою відцентрового фільтра Amicon Ultra 100 кДа (Millipore,). Концентроване кондиціоноване середовище використовували для очищення мікровезикул ультрацентрифугуванням при 200000 х g протягом 110 хв.
Реактиви та антитіла.
Реагенти для культури клітин, включаючи DMEM, F12, глутамін, Hepes, бікарбонат натрію, N2, G5 та B27, комплект для клонування pENTR, LR Clonase II, зворотну транскриптазу Superscript II, DiIC16 (3), DiO16 (3) та TRIzol. від Life Technologies (Cergy Pontolse, Франція). Фетальна теляча сироватка (FCS) була придбана у Hyclone (Бреб'єр, Франція), а набір Exoquick - у Ozyme (St. Quentin в Івеліні, Франція). Hoechst 33342 та Actinomycin D постачали Sigma (St. Quentin Fallavier, Франція), а Micromount Mounting Media було придбано у Leica Biosystems (Нантер, Франція). Набір мікроРНК для зворотної транскрипції Taqman, зонди Universal Taqman PCR Master Mix та зонди Taqman були придбані у Applied Biosystems (Villebon sur Yvette, Франція). Покращений реагент для виявлення хемілюмінесценції був придбаний у Bio-Rad (Marnes la Coquette, Франція).
Антитіла, використані в цьому дослідженні, перелічені тут: Поліклональні козячі анти-пишні (1/50 °, sc1194, Санта Круз Біотехнологія, Санта Круз, Німеччина); Миша моноклональна anti-CXCR4 (1/50, MAB 172, R&D Systems, Великобританія); Кролик поліклональний анти-H3-фосфо-S10 (1/100 °; ab5176, Abcam, Париж, Франція); Кролик Anti-sox 2 поліклональний (1/100 °; Sox-2 (H65), sc-20088, Santa Cruz Biotechnology, Inc); Мишачий моноклональний анти-нестин (1/100 °, ab22035, Abcam); Антикоза Alexa 488 (1/500 °; Дюссельдорф, Німеччина); Анти-кролик Alexa 488 (1/500 °, Дюссельдорф, Німеччина); Анти-миша Alexa 488 (1/500 °, Дюссельдорф, Німеччина); Антикоза Alexa 546 (1/500 °, Дюссельдорф, Німеччина); Анти-кролик Alexa 546 (1/500 °, Дюссельдорф, Німеччина); Антимиша Alexa 546 (1/500 °; Дюссельдорф, Німеччина); Анти-GFAP (1/200 °, 2203PGF, EUROPROXIMA, Арнем, Нідерланди). Анти-PTGFRN (1/500 °, ab174180, abcam); Anti-CD81 (1/500 °, клон # 454720, системи досліджень і розробок, Абінгдон).
Комбінація зонду miRCURY LNA Knockdown, націлена на miR-302a, miR-302b, miR-302c та miR-302d, була придбана у EXIQON (Мадрид, Іспанія). Кодовану послідовність використовували як контроль.
Культура клітин
Первинні клітинні лінії GSC TG1, TG6 та GB1 були виділені з людського GBM, як описано в іншому місці. 20, 33, 34 При підтримці як самовідновлюваного ГСК нейросфери культивували в середовищі NS34 +, що містить EGF і bFGF (співвідношення 1/1 DMEM-F12, 10 мМ глутаміну, 10 мМ гепесу, 0 бікарбонат натрію, 025%, N2 G5 та B27). Середовище для диференціації клітин (MFCS) складалося з DMEM-F12, 10 мМ глутаміну, 10 мМ гепесу, 0,025% бікарбонату натрію та 0,5% FCS. В експериментах з диференціації нейросфери дисоціювали і культивували 500000 окремих клітин у MFCS.
Стійкі конструкції плазміди та клітинної лінії.
Пул miR-302 ампліфікували з геномної ДНК людини методом ПЛР (прямий праймер: 5′-GGCTGAAGTCCCTGCCTTTTACCC-3 ', зворотний праймер: 5′-TGGCTTAACAATCCATCACCATTGC-3') і клонували в комерційний вектор pENTR (жива технологія). Субклонування в лентивирусний вектор бластицидину 2K7 (2K7BSD) проводили шляхом рекомбінації у присутності LR клонази II. Використовували випадкову форму shLuc (2K7BSD-shLuc-scb), яка запобігає інгібуванню гена люциферази як нерелевантної конструкції (CRL). Лентивірусні частинки отримували шляхом трансфекції 293-клітинної лінії за допомогою конструкцій 2K7BSD-Cluster mir-302 або 2K7BSD-shLuc-scb разом з векторами упаковки (Invitrogen, Waltham, USA). Після лентивірусної інфекції відібрали клітинні лінії, які стабільно експресують групу miR-302 (група TG1 miR-302 та група GB1 miR-302) або контроль shLuc-scb (TG1-CRL та GB1-CRL) у середовищі, що містить бластицидин ( 1 мкг/мл) протягом 15 днів. Дві стабільні клітинні лінії були розроблені з незалежних вірусних виробництв/інфекцій і показали подібну поведінку. Клітини, що стабільно експресують RFP, були отримані після зараження GSCs лентівірусними частинками 2K7BSD-RFP.
Імунофлюоресценція
Клітини вирощували на скляних покриттях із покриттям з полі-L-лізину в NBE, MFCS або кондиціонованих середовищах. У зазначені моменти часу клітини фіксували метанолом протягом 10 хв при -20 ° C і промивали PBS, попередньо охолодженим двічі. Блокування та гібридизацію антитіл проводили в PBS, що містить 10% FCS і 0,1% Triton x 100. Після 1 години інкубації з первинними антитілами при кімнатній температурі клітини тричі промивали PBS і фарбували протягом 30 хвилин при кімнатній температурі з тваринами . Специфічні вторинні антитіла, сполучені з флуорофором. Одночасно ядра фарбували Hoechst 33342 (1 мкг/мл). Гірки двічі промивали PBS, один раз дистильованою водою і, нарешті, монтували розчином для гелевого кріплення. Імунофлуоресцентні та пропускаючі світлові зображення були зроблені за допомогою мікроскопа Nikon eclipse Ti (Nikon, Champigny sur Marne, Франція).
Клоногенний аналіз
Нейросфери дисоціювали 20 разів, обережно піпетуючи вгору і вниз, щоб отримати окремі клітини. Як правило, по 10 клітин висівали в кожну лунку 96-лункових планшетів, що містять контрольне середовище або кондиціонований miR-302. Після 21 дня інкубації кожну лунку досліджували і підраховували кількість нейтросфер. Експерименти повторювались три незалежні рази.
Кількісна RT-PCR в режимі реального часу
РНК екстрагували за допомогою реагенту Trizol. Рівні експресії мікроРНК та мРНК кількісно визначали за допомогою двоступеневої RT-PCR у реальному часі. Етапи зворотної транскрипції виконували з використанням зворотної транскриптази Superscript II та набору мікроРНК зворотної транскрипції Taqman для мРНК та мікроРНК, відповідно до інструкцій виробника. Експерименти з ПЛР у режимі реального часу проводили з використанням універсальної суміші ПЛР Taqman. Експресія малих ядерних РНК SNORD54 (або U54) та GAPDH використовувались як внутрішній контроль для нормалізації експресії генів. Зміни складки оцінювали відповідно до умов контролю, використовуючи метод ΔΔCT.
Ортотопічні ксенотрансплантати
2.10 5 Контрольні клітини TG1, які стабільно експресують люциферазу (TG1-luc), ресуспендували в 5 мкл збалансованого сольового розчину Хенкса (Invitrogen) і односторонньо імплантували в смугасте тіло чоловіка NOD.CB17-Prkdcscid/NCrHsd (Харлан, Франція). Клітини, що експресують люциферазу, вводили спільно з клітинами TG1, стабільно експресуючи закодовану послідовність групи miR-302 (TG1-scrb) або стабільно експресуючи групу miR-302. Активність люциферази дозволила контролювати розвиток пухлини у живих тварин. Виживання клітин та ріст пухлини контролювали та кількісно визначали у живих тварин до 120 днів шляхом виявлення активності люциферази за допомогою системи IVIS Lumina II (Caliper Life Sciences, Hopkinton, MA, USA).
Органотипова культура МБС
Мозок розсікали у новонароджених мишей, вбудованих у 4% агар спинномозкової рідини (124 мМ NaCl, 3 мМ KCl, 26 мМ NaHCO3, 2 мМ CaCl2, 1 мМ MgSO4, 25 мМ KH 2 PO, 25 мМ KH 2 PO 4, 10 мМ глюкози) та нарізати на вібратом скибочками товщиною 400 мм. Зрізи поміщали в культуральну пластинку Millicell-CM (0,4 мкм), вставляли та витримували в інтерфейсі повітря-рідина більше 3 тижнів.
Парафін
Мишей з предметними скельцями фіксували 4% параформальдегідом протягом 20 хвилин при кімнатній температурі, потім промивали PBS. Потім зразки зневоднювали з наступною послідовністю інкубацій: 70% етанол 15 хв, двічі; етанол 90% 15 хв; 95% етанол 15 хв; 100% етанол 5 хв, три рази; Етикетка 5 хв.
Аналіз пухлини ex vivo
Десять нейросфер клітин TG1-CRL та TG1-miR-302, які стабільно експресують RFP, висівали на верхню поверхню MBS і культивували в інтерфейсі повітря-рідина протягом 3 тижнів. Клітини обробляли кондиціонованим середовищем кожні 48 год. Інфільтрація та ріст клітин візуалізувались на тонких ділянках шляхом відстеження сигналу RFP за допомогою мікроскопа Nikon Eclipse Ti.
- Надмірна вага викликає зміни в грудному молоці, які впливають на ріст немовлят
- Лікарня Сан-Рафаель Озоно Блоги про шахрайство, фентезі чи терапію
- Значення їжі у зростанні дітей - Mothers Today
- Важливість харчування у зростанні та розвитку дітей - ВАГІТНІСТЬ
- Лікування болю в шиї за допомогою терапії Су Джок