- Предмети
- Резюме
- Вступ
- Результати
- Диференціальна експресія мікроРНК печінки у мишей з фіброзуючим стеатогепатитом
- Аналіз генної онтології на основі мікрочипів та аналіз шляхів для диференційовано експресованих мікроРНК
- Валідація експресії мікроРНК за допомогою кількісної ПЛР у реальному часі (qRT-PCR)
- miR-146a-5p регулювався вниз в активованих HSC в пробірці
- Надмірна експресія MiR-146a-5p пригнічувала проліферацію HSC
- Вплив miR-146a-4p на активацію HSC та осадження колагену
- miR-146a-5p впливав безпосередньо на 3'UTR мРНК Wnt1 та Wnt5a
- miR-146a-5p негативно регулюють Wnt1 і Wnt5a на рівні посттранскрипції
- Вплив надмірної експресії та інгібування miR-146a-5p на гени-мішені за течією сигнального шляху Wnt
- Падіння Wnt1 або Wnt5a пригнічувало експресію генів передачі сигналів Wnt та фіброгенезу
- Обговорення
- Методи
- Тваринні моделі неалкогольного фіброзуючого стеатогепатиту
- Гістологічний аналіз та біохімічний аналіз.
- МікроРНК Аналіз мікрочипів
- QRT-ПЛР-аналіз
- Ідентифікація потенційних цілей miRNA
- Виділення, культура та ідентифікація HSC
- Трансфекція MiR-146a-5p в HSC
- Втручання та трансфекція РНК
- Імуноцитохімічний аналіз.
- Аналіз клітинної проліферації
- Вестерн-блот-аналіз
- Аналіз активності люциферази
- статистичний аналіз
- Додаткова інформація
- Додаткова інформація
- Файли PDF
- Додаткова інформація
- Коментарі
Предмети
- Фіброз печінки
- Безалкогольна жирова хвороба печінки
Резюме
Вступ
Безалкогольний стеатогепатит (НАСГ) є частиною спектру неалкогольної жирової хвороби печінки (НАЖХП), що характеризується стеатозом, часточковим запаленням та прогресуючим перицелюлярним фіброзом. При тривалому ураженні печінки стеатогепатит може перерости у фіброз печінки, що характеризується надмірним накопиченням позаклітинного матриксу (ЕКМ). Печінкові зірчасті клітини (HSC) відіграють центральну роль у патогенезі фіброзу печінки 2. Неактивні HSC можуть активуватися у відповідь на хронічний стеатогепатит 3. Активовані HSC стимулюють вироблення колагену та накопичення ECM, що призводить до появи фіброзу печінки 4. Незважаючи на фундаментальний прогрес у розумінні патофізіології фіброзуючого неалкогольного стеатогепатиту, механізми фіброгенезу при наявності стеатогепатиту залишаються незрозумілими.
Результати
Диференціальна експресія мікроРНК печінки у мишей з фіброзуючим стеатогепатитом
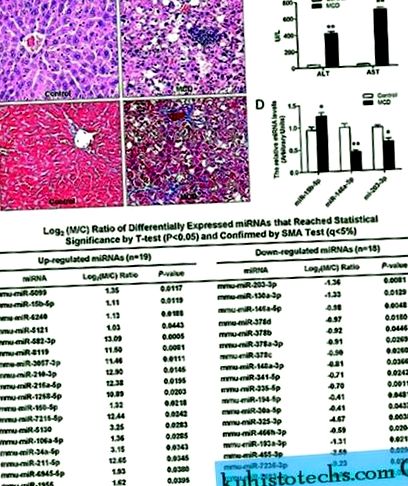
Як показано на рис. 1, у ділянках печінки мишей, які годувались МКД дієтою, спостерігалася невпорядкована часточка, макростеатоз в зоні 3, точковий або вогнищевий некроз гепатоцитів, запальна інфільтрація та перисинусоїдальний фіброз (рис. 1А), що супроводжувалося значно вищим рівнем сироватки крові Рівні ALT та AST (P 2 рази) (Рис. 1C).
( ДО ) Гістопатологічні зміни зрізів печінки у мишей, які отримували раціон харчування та контроль МХД. Пофарбовані гематоксилін та еозин (зверху) та трихроматизм Массона (знизу). ( B ) Вплив дієти MCD на рівень АЛТ та АСТ у сироватці крові. ( C. ) Диференціально регульовані мікроРНК, як ідентифікуються мікрочипами мікроРНК. ( D ) Перевірка даних мікрочипів за допомогою RT-PCR в реальному часі. Аналізи проводили в трьох примірниках для кожного зразка РНК, і відносна кількість кожної miРНК нормалізувалась до U6 snRNA. Значення є середніми ± SD, ** P
( ДО ) Аналіз категорії GO, заснований на прогнозованих цілях всіх диференційовано регульованих мікроРНК. Вертикальна вісь представляє категорію GO, а горизонтальна вісь - збагачення GO. ( B ) Аналіз шляху для диференційовано регульованих міРНК. Показані лише маршрути з P
( ДО ) Репрезентативні морфологічні зображення та імуноцитохімічне фарбування спокійних та активованих HSC для десміну та α-SMA (400 ×). ( B ) експресію miR-146a-5p досліджували за допомогою qRT-ПЛР у режимі реального часу. Значення є середніми ± SD, ** P # P
( ДО ) Фарбування Desmin, що вказує на проліферацію клітин LX-2 та HSC-T6, зменшується при надмірній експресії miR-146a-5p. ( B ) miR-146a-5p пригнічував ріст клітин LX-2 та HSC-T6, як визначали аналізи CCK-8. Значення є середніми ± SD, * P
( ДО, C. ) потенційні сайти зв'язування miR-146a-5p в 3'UTR Wnt1 і Wnt5a. ( B, D ) Клітини HEK-293T трансфікували репортерним вектором люциферази, що містить дикий тип або мутантну 3'UTR-форму Wnt1 та Wnt5a, у присутності імітаторів miR-146a-5p, імітаційного контролю, інгібітора miR-146a -5p та контролю інгібіторів, а потім оцінювали активність репортера люциферази через 48 годин після трансфекції. Значення є середніми ± SD, * P # P # P ## P
( ДО ) рівні мРНК та білка ( B ) β-катеніну, GSK-3β та NFAT5 у мишей, які годували печінку дієтою MCD та контролем. ( C. ) HSC-T6 трансфікували інгібітором miR-146a-5p або інгібітором контролю, імітуючи miR-146a-5p або імітуючи контроль протягом 48 годин. Рівні мРНК та білка ( D ) β-катеніну, GSK-3β та NFAT5 аналізували за допомогою RT-PCR у режимі реального часу та Вестерн-блот, відповідно. Control-актин використовували як контроль навантаження. Значення є середніми ± SD, ** P
На закінчення ми виявили печінкові мікроРНК та оцінили їхні типи експресії у безалкогольному фіброзуючому стеатогепатиті, індукованому дієтичним МХД, використовуючи мікрочипи. Серед перевірених miRNAs miR-146a-5p мав значну регуляцію зниження рівня безалкогольного фіброзуючого стеатогепатиту та активованих HSC. Надмірна експресія miR-146a-5p сприяла розвитку фіброзу печінки, інгібуючи проліферацію, активацію HSC та відкладення колагену, пригнічуючи сигнальний шлях Wnt. Отже, miR-146a-5p може служити новим регулятором патогенезу безалкогольного фіброзуючого стеатогепатиту.
Методи
Тваринні моделі неалкогольного фіброзуючого стеатогепатиту
Вісім тижневих самців мишей C57BL/6J вирощували і утримували, як описано раніше. Безалкогольний фіброзуючий стеатогепатит індукували, годуючи мишей дієтою MCD (Research diets, Inc., NJ, New Brunswick, USA) протягом 8 тижнів. Тим часом мишей годували дієтою, доповненою холіновим бітартатом та DL-метіоніном (Research diets, Inc., NJ, New Brunswick, USA) в якості контролю. В кінці експерименту всіх тварин забивали під наркозом, а зразки крові відбирали із стегнової артерії для біохімічного аналізу. Печінку частково фіксували в 10% формаліні для гістологічного аналізу або заморожували в ліпідному азоті з подальшим зберіганням при -80 ° C у морозильній камері до необхідності. Всі протоколи та процедури виконувались відповідно до вказівок Комітету з догляду та використання лабораторних тварин Хебея та були затверджені Комітетом з етики експериментів на тваринах Медичного університету Хебея.
Гістологічний аналіз та біохімічний аналіз.
Зрізи парафінової печінки, пофарбовані гематоксиліном та еозином та забарвлені трихроматизмом Массона (товщиною 5 мкм), оцінювались за стеатоз печінки, запалення та фіброз, як описано раніше згідно з критеріями Бранта та гістологічною системою оцінки НАЖХП, виданою Патологічним комітетом Мережі клінічних досліджень неалкогольного стеатогепатиту. Рівні ALT та AST у сироватці крові вимірювали ферментативно-кінетичним методом за допомогою автоматизованого біохімічного аналізатора (Olympus AU2700, Японія) відповідно до інструкцій виробника.
МікроРНК Аналіз мікрочипів
Загальну РНК витягували з 20 мг тканини печінки у мишей, яких годували дієтою MCD, і мишей, які годували контрольну дієту (n = 3 миші/група), використовуючи реагент TRIzol (Invitrogen) відповідно до інструкцій виробника. Аналіз мікрочипів мікроРНК µParaflo ™ проводили за допомогою постачальника послуг (LC Sciences, Х'юстон, Техас, США). Аналіз починали з 4 до 8 мкг загальної проби РНК, яку продовжували на 3 'з полі (А) хвостом, використовуючи полі (А) полімеразу. Потім олігонуклеотидну мітку прикріплювали до полі (А) хвоста для подальшого фарбування флуоресцентним барвником. Гібридизацію проводили протягом ночі на мікрожидкостному чіпі µParaflo з використанням мікроциркуляційного насоса (Atactic Technologies). Після гібридизації РНК барвник Cy3, кон'югований з мітками, циркулював через мікрофлюїдний чіп для фарбування барвника. Флуоресцентні зображення збирали за допомогою лазерного сканера (GenePix 4000B, Molecular Device) та оцифровували за допомогою програмного забезпечення для аналізу зображень Array-Pro (Media Cybernetics). Дані аналізували, спочатку віднімаючи фон, а потім нормалізуючи сигнали за допомогою НИЗЬКОГО фільтра (Локально зважена регресія).
QRT-ПЛР-аналіз
Загальну РНК виділяли та екстрагували із заморожених тканин печінки реагентом TRIzol (Invitrogen). КДНК синтезували за допомогою miRNA-специфічної зворотної транскриптази праймера стовбурової петлі (RiboBio, Гуанчжоу, Китай) або праймерів oligo dT (Thermo, Waltham, MA, USA). Диференціально, qRT-ПЛР проводили на ПЛР-системі в режимі реального часу ABI 7500 (Applied Biosystems, Фостер-Сіті, Каліфорнія, США), використовуючи SYBR Green Master Mix (CoWin Biotech, Пекін, Китай). Відносна кількість мікроРНК була нормалізована до малих ядерних РНК U6, а рівні експресії генів нормалізувались щодо еталонного гена ендогенної глюцеральдегідфосфатдегідрогенази (GAPDH). Відносну кількість кожної мікроРНК та генів вимірювали за допомогою методу 2 -ΔΔCt. Всі реакції qRT-PCR проводили у трьох примірниках. Праймери, що використовуються для qRT-PCR, наведені в таблиці 1.
Повний розмір таблиці
Ідентифікація потенційних цілей miRNA
Втручання та трансфекція РНК
Клітини HSC-T6 трансфікували siRNA проти Wnt1 або siRNA проти Wnt5a та контролювали siRNA (Ribo Bio, Гуанчжоу, Китай), що складається з кодованої послідовності, яка не призведе до специфічної деградації будь-якого клітинного повідомлення. SiRNA трансфікували в клітини HSC-T6 за допомогою ліпофектаміну 2000 (Invitrogen). Ефективність видалення оцінювали за допомогою qRT-PCR та вестерн-блот. Синтезовані оліго наведені в таблиці 1
Імуноцитохімічний аналіз.
HSC культивували на предметних предметних стеклах, а експерименти трансфекції проводили, як описано вище. Клітини фіксували в 4% параформальдегіді протягом 15 хвилин і тричі промивали PBS. Клітини замочували X-Triton100 протягом 20 хвилин і тричі промивали PBS. Потім клітини блокували 5% бичачого сироваткового альбуміну в PBS протягом 1 год, після чого проводили інкубацію з первинними антитілами проти десміну (ProteinTech Group, Чикаго, США) та α-SMA (Novus Biologicals, Littleton, USA). США протягом 16 годин. год при 4 ° С протягом ночі. Після триразового промивання PBS застосовували вторинне антитіло та інкубували протягом 1 години. Після подальшого промивання клітини аналізували за допомогою флуоресцентної мікроскопії.
Аналіз клітинної проліферації
Через п'ять годин після трансфекції мімічним miR-146a-5p або імітаційним контролем клітини LX-2 та HSC-T6 повторно висівали в 96-лункові планшети при щільності 5 × 10 3 клітин на лунку для 1, 2, 3, 4, 5г. Клітини аналізували на проліферацію за допомогою набору для підрахунку клітин-8 (CCK-8, Додзіндо, Кумамото, Японія), відповідно до інструкцій виробника. Експерименти проводились тричі самостійно.
Вестерн-блот-аналіз
Загальну кількість білків екстрагували з тканини печінки та клітин за допомогою радіоімунопреципітаційного буфера (RIPA). 80 мкг зразків білків поділяли на 10 або 12% гелю SDS-PAGE і переносили в мембрани PVDF (Millipore Corporation, Billerica, MA, USA) шляхом електроосадження. Мембрани блокували на 60 хвилин у буфері, що містив 0,1% Твін-20 та 5% молока. Мембрани інкубували протягом ночі при 4 ° C з первинними антитілами проти α-SMA, Col-1, MMP-2 (Bioss, Пекін, Китай), Smad7 (Novus Biologicals, Літтлтон, США), Wnt1 (Abcam, Cambridge, MA, США), Wnt5a (Novus Biologicals, Літтлтон, США), Β-катенін, GSK-3β (ProteinTech Group, Чикаго, США), NFAT5 (Санта-Крус, Каліфорнія, США). Імунні комплекси виявляли з кон’югованими вторинними антитілами до пероксидази хрону (HRP) (ProteinTech Group, Чикаго, США), а потім візуалізували методом ECL. Β-актин (Бостер, Ухань, Китай) служив контролем завантаження. Інтенсивність кожної цікавої смуги білка визначали за допомогою денситометрії за допомогою програмного забезпечення Quantity One 4.6.3 (Bio Rad).
Аналіз активності люциферази
Послідовність сегментів з насінням дикого типу (WT) або мутантного (Mut) регіону Wnt1 та Wnt5a була синтезована та клонована у векторі люциферази psiCHECK TM -2 (Promega, Madison, WI, USA). Xho I та Not Я обмежую сайти. Порожній вектор-репортер люциферази використовували як негативний контроль. Клітини HEK-293T культивували в 24-лункових планшетах і кожну лунку трансфікували 200 нг відповідних конструкцій psi-CHECK2 3'UTR, а імітаційний або імітаційний контроль miR-146a-5p 50 нМ та контроль інгібітора або 100 нМ інгібітори, використовуючи реагент для трансфекції ліпофектаміну 2000 (Invitrogen, Carlsbad, CA), згідно з протоколом виробника. Через 5 годин середовище для трансфекції OptiMEM (Invitrogen, Каліфорнія, США) замінили DMEM. Клітини збирали та аналізували через 48 годин після трансфекції, використовуючи систему аналізу люциферази (Promega). Синтезовані олігоцити представлені в таблиці 1.
статистичний аналіз
Дані виражаються як середнє значення ± стандартне відхилення. Статистичний аналіз проводили за допомогою SPSS 17.0. Для статистичного аналізу використовували односторонній дисперсійний аналіз (ANOVA) та тест Стьюдента. Вважалося, що Р
- Прагніть запалити тепло в жирових клітинах, які спалюють енергію
- Популяції природних клітин-кілерів та цитотоксична активність свиней, що годуються молоком
- Секрети радикальної фізичної культури Майка Тайсона змінюють дороге лікування стовбуровими клітинами
- Ожиріння виявляє, як метаболізм імунних клітин регулює вагу TN
- Чому рак підшлункової залози такий смертельний?