- реферат
- Головний
- МАТЕРІАЛИ І МЕТОДИ
- пацієнтів
- Ампліфікація зонда мультиплексного лігування
- Флуоресценція in situ гібридизація
- РЕЗУЛЬТАТИ
- Пацієнт А
- Пацієнт Б
- Пацієнт С
- Пацієнт D
- ОБГОВОРЕННЯ
реферат
Призначення: Вроджені вади розвитку є основною причиною захворюваності та смертності новонароджених, а геномний дисбаланс є важливою частиною їх етіології. Метою цього дослідження було оцінити здатність екрану ампліфікації зонда для пренатальної мультиплексної лігації виявляти криптичний хромосомний дисбаланс у плодів з ультразвуковими аномаліями невідомої етіології.
Методи: Ампліфікацію зонда мультиплексного перев’язування проводили за допомогою трьох окремих наборів зондів: двох для субтеломерних областей та одного для локусів синдрому розумової відсталості. У період з січня 2007 року по січень 2009 року тестували шістдесят один плід із значними ультразвуковими аномаліями та нормальним каріотипом з роздільною здатністю не менше 400 смуг.
Результати: Ми виявили чотири незбалансованих механізми: один дель 18птер/підсилювач 5пт, один дель 9птер, один мікроделетон 15q11q13 та один мікроделетон 22q11 з нетиповим представленням. Після генетичного консультування дві вагітності були перервані.
Висновок: Ампліфікаційний аналіз зонду мультиплексного перев’язування зумів виявити клінічно значущі зміни у 6,5% плодів із пренатально виявленими сонографічними відхиленнями. Це проспективне дослідження підкреслює, що скринінг ампліфікації плода з ультразвуковими аномаліями в пренатальному періоді є мультиплексним ампліфікаційним скринінговим зондом, який є технічно здійсненним та важливим для діагностики та прогнозу.
Головний
Вроджені вади розвитку є основною причиною захворюваності та смертності новонароджених і діагностуються приблизно у 3% населення. Деякі вроджені вади розвитку виявляються за допомогою УЗД в пренатальному періоді. Стандартний каріотип, отриманий шляхом відбору проб ворсин хоріона або амніоцентезу, виявляє хромосомні аберації у 18–35% уражених плодів. 1, 2 Методи високої роздільної здатності, засновані на флуоресценції in situ гібридизації (FISH), порівняльній геномній гібридизації (розповсюдження метафази або масив CGH) та кількісні методи мультиплексної полімеразної ланцюгової реакції (ПЛР), такі як мультиплексне посилення, використовуються для збільшення цієї швидкості виявлення зонд для перев'язки. (MLPA) або кількісна мультиплексна ПЛР коротких фрагментів, але їх використання в пренатальній діагностиці залишається обмеженим.
Теломероспецифічна фелома вже виявилася корисним інструментом для виявлення делецій та дублювань плодів з великими вадами розвитку. 3, 4 Нещодавно було проведено аналіз зразків плоду CGH як можливий для виявлення змін ДНК із низьким числом копій. 5-8 MLPA - це швидкий, економічно ефективний метод скринінгу на криптичні незбалансовані субтеломерні перебудови та інтерстиціальні дисбаланси, виявлені в регіонах, пов'язаних з розумовою відсталістю (синдром розумової відсталості [MRS] -MLPA). MLPA насправді вимагає менше 2 днів, а результати MLPA можуть бути доступні протягом 3 днів (протягом 4 днів, якщо необхідний контроль FISH). Наразі лише одне дослідження поєднувало MRS-MLPA та субтеломерний MLPA, що покращило частоту виявлення дисбалансу з 5,8% до 10,1% у дітей з розумовою відсталістю. 9
У цьому дослідженні вивчали 61 плід із нормальними каріотипами та ультразвуковими аномаліями, що свідчать про хромосомні аберації з використанням субтеломерних MLPA та MRS-MLPA. Наскільки нам відомо, це перший звіт про субтеломерний MLPA у поєднанні з MRS-MLPA, який використовується як пренатальний проспективний скринінговий метод при діагностичній оцінці плодів з ультразвуковими аномаліями.
МАТЕРІАЛИ І МЕТОДИ
пацієнтів
Шістдесят один плід з одним або кількома вадами розвитку, що свідчать про хромосомні аномалії та нормальний каріотип, були включені в наше проспективне дослідження з січня 2007 року по січень 2009 року (Таблиця 1). Для кожного плоду виконували 400-смуговий каріотип із пов’язкою RHG та GTG з навколоплідних вод або ворсин хоріона. У разі серцевих відхилень проводили FISH 22q11.2. Коли результати каріотипу та FISH були нормальними, ми запропонували пацієнтам продовжувати цитогенетичні дослідження за допомогою MLPA. Усі 61 пацієнт погодився взяти участь у дослідженні та отримав відповідну інформовану згоду. Дослідження проводилось з повною відповідністю Гельсінським принципам.
Стіл в натуральну величину
Ампліфікація зонда мультиплексного лігування
У протоколі MLPA було використано сто двадцять нанограм ДНК. Реакції проводили на термоциклері TProfessional (Biometra, Archamps, Франція). Три мікролітри продуктів ПЛР аналізували за допомогою капілярного електрофорезу на генетичному аналізаторі ABI Prism 3100 (Applied Biosystems, Courtabeouf, Франція), а кількісні дані отримували за допомогою програмного забезпечення ABI Prism GeneScan Analysis та Genetyper (Applied Biosystems). Аналіз даних MLPA проводили за допомогою Microsoft Excel. Один пацієнт із незбалансованою транслокацією t (10; 18) (qter; qter) та один пацієнт із делецією 15q12 були включені в якості позитивних контролів у кожен аналіз MLPA P036/P070 та P245, а також один негативний контроль. Аномальні результати визначали як співвідношення вище 1,3 для приросту та нижче 0,7 для втрати генетичного матеріалу.
Флуоресценція in situ гібридизація
Ненормальні висновки, отримані MLPA, були підтверджені FISH на метафазних хромосомах згідно зі стандартними процедурами (Cytocell Technology або Vysis, Inc, Downers Grove, IL) з використанням зондів, розташованих у підозрюваних регіонах, плюс контрольні зонди. Лімфоцити периферичної крові від батьків були проаналізовані FISH, коли у плода було проведено позитивний тест на перебудову.
РЕЗУЛЬТАТИ
Ми виявили криптичний дисбаланс у чотирьох із 61 плоду (6,5%), обстежених MLPA. Виявлено дві субтеломерні перебудови та дві перицентромерні мікроделеції. Клінічні та цитогенетичні дані для цих чотирьох випадків наведені нижче.
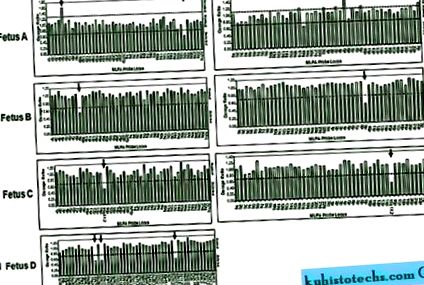
Пацієнт А
Співвідношення генних доз для субтеломерних MLPA та MRS-MLPA. A, Співвідношення доз наборів SALSA P036 (ліворуч) та P070 (праворуч) для плода A, що показує 5p ампліфікацію теломер та делецію 18 теломер 18q. B, Співвідношення доз наборів зондів SALSA P036 (ліворуч) і P070 (праворуч) для плода B, що демонструє делецію 9p теломер 9p. C, Співвідношення доз наборів зондів SALSA P036 (ліворуч) та P070 (праворуч) для плода C, що показує видалення області 15q11.2. D, Співвідношення дози наборів зондів SALSA P245 для плода D, що показує видалення трьох зондів, націлених на область 22q11.21.
Повнорозмірне зображення
Пацієнт Б
26-річна мати цього плода була вагітна своєю другою дитиною. Ультразвукове дослідження першого триместру вимірювало товщину нухальної напівпрозорості у 1,4 мм, а скринінг материнської сироватки дав оцінку ризику розвитку синдрому Дауна 1: 840. Сімейний анамнез був незначним. Після 34 тижнів вагітності ультразвукове дослідження виявило затримку внутрішньоутробного розвитку та гіпоспадію, що призвело до рекомендації амніоцентезу. Каріотип 46, XY був нормальним, а аналізи FISH для делеції 4p16.3 (Wolf-Hirschhorn, OMIM194190) були негативними. Субтеломерний аналіз MLPA виявив втрату 9 п. (Рис. 1В). Видалення підтверджено FISH (див. Рис. B, Додатковий цифровий вміст 2, //links.lww.com/GIM/A105). Мінімальний розмір, визначений MLPA та FISH, становив 810 Кб (DMRT1-, DOCK8-, RP11-143M15-). Аналіз каріотипу та FISH розповсюдження метафаз батьків не показав аберацій. Після консультацій та відповідно до законодавства Франції батьки вирішили перервати вагітність на 38 тижнів через високий ризик розумової відсталості. Патологоанатомічна клінічна оцінка підтвердила гіпоспадію та виявила дисморфізм обличчя з підвищеним розщепленням пастухів, мікроретрогнатією, короткою шиєю та широкими сосками.
Пацієнт С
Пацієнт D
Пацієнт був 30-річною примагравідою. Товщину нухальної напівпрозорості у першому триместрі вимірювали на рівні 1,6 мм, а скринінг материнської сироватки дав оцінку ризику розвитку нижнього синдрому 1: 2899. Після 25 тижнів вагітності УЗД виявило односторонню дисплазуючу мультициклічну нирки та двосторонні ноги ніг, що призвело до амцентації . Сімейний анамнез був незначним, а ультразвукове обстеження нирок батьків - нормальним. Кетотип плода, 46 років, XY, був нормальним. Після 32 тижнів вагітності було виявлено значне багатоводдя та проведено MLPA на кріоконсервованих клітинах. MRS-MLPA виявив мікроделецію 22q11, 2 (рис. 1D) з мінімальним розміром 1,68 Мб (CLDN5 -, GP1BB -, SNAP29 -), що було підтверджено FISH (див. Малюнок D, Додатковий цифровий вміст 2, // посилання. lww. com/GIM/A105). Батьки відмовились проходити власне тестування на каріотип і після генетичного консультування вирішили продовжувати вагітність. Постнатальна оцінка в термін підтвердила аномалії плода та подальші вади розвитку. Сюди входять перимембранозний міжшлуночковий зв’язок, стридор гортані та сильний шлунково-стравохідний рефлюкс. Вага становила 3540 г, довжина - 50,5 см, а окружність потиличного переду - 36 см.
ОБГОВОРЕННЯ
Метою цього дослідження була оцінка технічної доцільності та корисності впровадження ЗМЗ протягом пренатального періоду. Наскільки нам відомо, це перше дослідження з оцінки MRS-MLPA у поєднанні з субтеломерним MLPA при пренатальному діагностичному скринінгу плодів з патологічним ультразвуком невідомої етіології.
Ми виявили чотири субмікроскопічні перебудови за допомогою трьох різних наборів зондів MLPA у 61 плода, відправленого до нашої лабораторії для ненормального УЗД. Цей дисбаланс був підтверджений FISH щодо метафазних поширень.
Ми також виявили дві інтерстиціальні делеції (3, 3%). Субтеломерні MLPA та MRS-MLPA виявили мікроделецію 15q11q13, пов'язану з багатоводдям та гіпотонією. Бігі та ін. 18 опублікував перший звіт, що описує можливий фенотип плоду при СЗЗ, який можна було ідентифікувати після 30 тижнів вагітності. Вони стверджували, що специфічне положення рук і ніг, пов'язане зі зменшенням рухів плода та багатоводдя, вказує на СЗЗ. 18 Однак плід С не виявляв такого типу зсуву кінцівок. Дадлі та Мускателлі 19 описали генотипно-залежну варіацію характеристик народження СЗЗ, тобто делецію або однорідну дисомію матері, що ускладнює визначення фенотипу плода. MRS-MLPA також виявив мікроделецію 22q11.2 з нетиповим виглядом. Дисплазія нирок часто асоціюється з мікроделецією 22q11.2, і при цьому синдромі повідомляється про багатоводдя та кліщі. 20, 21 Однак, наскільки нам відомо, пренатальна асоціація односторонньої дисплазованої мультициклічної нирки, двосторонніх клубкових ніжок та багатоводдя, виявлених у плода D, ніколи не повідомлялася при синдромі мікроделеції 22q11, 2. Разом ці два випадки свідчать про те, що MRS-MLPA може корисно виявити мікроделецію при нетиповому або неповному передпологовому передлежанні.