Перегляньте статті та зміст, опубліковані в цьому носії, а також електронні зведення наукових журналів на момент публікації
Будьте в курсі завжди, завдяки попередженням та новинам
Доступ до ексклюзивних рекламних акцій на підписки, запуски та акредитовані курси
Журнал з медицини та досліджень є науковим виданням Автономного університету штату Мексика. Кожні шість місяців він приймає статті іспанською та англійською мовами та розглядає для публікації роботи, пов’язані з медичними дослідженнями у всіх аспектах. До публікації приймаються оригінальні статті, оглядові статті, наукові листи, клінічні рекомендації, консенсус, редакційні коментарі, листи до редакції, статті про історію та мистецтво медицини академічного характеру, що включають результати досліджень із змістом із цих областей. кардіологія, пульмонологія, нефрологія, гастроентерологія, ревматологія, гінекологія, генетика, фармакологія, імунологія, молекулярна біологія, внутрішня медицина, охорона здоров'я, загальна медицина та ін.
Журнал з медицини та досліджень - це науковий журнал Мексиканського університету університету. Він публікує двічі на рік статті іспанською та англійською мовами та розглядає для публікації роботи, пов'язані з медичним розслідуванням у всіх аспектах. Журнал приймає до публікації оригінальні статті, оглядові статті, наукові листи, клінічні вказівки, консенсус, редакційні коментарі, листи до редакторів, статті та історичне мистецтво медицини, в тому числі з результатами академічних досліджень із змістом у галузі кардіології, пульмонології, нефрологія, гастроентерологія, ревматологія, гінекологія, генетика, фармакологія, імунологія, молекулярна біологія, внутрішні хвороби, охорона здоров'я, загальна медицина та ін.
Слідкуй за нами на:
- Вступ
- Патофізіологія
- Клінічні прояви
- Діагностика та лікування
- Фінансування
- Вступ
- Концептуальна ідентифікація синдрому Лі
- Біохімічні основи синдрому Лі
- Патофізіологія
- Клінічні прояви
- Спадщина синдрому Лі
- Діагностика та лікування
- Фінансування
- Конфлікт інтересів
- Дякую
- Бібліографія
Вивчення будови, фізіології та розладів, пов’язаних з мітохондріями, були темами досліджень багатьох вчених протягом історії. Ми можемо посилатися на 1951 рік, в якому Денис Лі описує випадок дитини з її власними клінічними проявами синдрому, який сьогодні носить його ім'я, про яке відомо все більше і більше, але досягнуто незначного прогресу у створенні лікування, яке дозволяє збільшити тривалість життя тих, хто страждає від нього.
Людський організм як ідеальна машина вимагає внеску біологічних видів палива (вуглеводів, ліпідів та білків), необхідних для отримання хімічної енергії, необхідної різним біологічним процесам, і таким чином підтримує гомеостаз. Метаболізм цих видів палива в організмі досягається за допомогою використання різних катаболічних та анаболічних шляхів, які вимагають злагодженого функціонування клітинних елементів, тобто хорошого зв’язку між органелами будь-якої клітини в організмі.
Після правильного метаболізму біопалива в клітинах ми нарешті отримуємо молекули хімічної енергії у формі АТФ, які необхідні для здійснення таких процесів, як; проходження молекул через клітинну мембрану, рух джгутиків, скорочення м’язів серед багатьох інших життєво важливих функцій. Більша частина цієї хімічної енергії отримується завдяки участі мітохондрій, у структурі яких розташований важливий дихальний ланцюг для здійснення окисного фосфорилювання і, нарешті, отримання АТФ.
Концептуальна ідентифікація синдрому Лі
Нейродегенеративні розлади, вторинні за вродженою відсутністю: Піруватдегідрогеназний комплекс, Комплекс I, IV або V дихального ланцюга 1 .
Біохімічні основи синдрому Лі
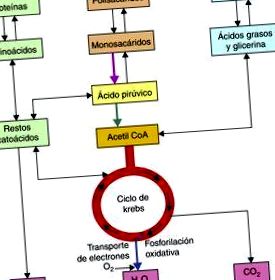
Метаболічні шляхи, які використовуються як при катаболізмі вуглеводів, ліпідів і білків, сходяться в мітохондріях після остаточного утворення молекул ацетил-КоА 2, які згодом метаболізуються циклом трикарбонової кислоти для отримання відновлених кофакторів, НАДН + Н і FADH2., який потім окиснюється в дихальному ланцюзі з отриманням молекул АТФ (рис. 1).
Отримання ацетил КоА.
У випадку вуглеводів як аеробний, так і анаеробний гліколіз є важливими шляхами використання цих молекул, після ряду реакцій, які анаеробний гліколіз передбачає в клітинному цитозолі, ми отримуємо піруват, який буде субстратом для піруватдегідрогенази. комплекс, який окислить молекулу пірувату до ацетил-КоА в мітохондріях.
Молекула ацетил-КоА утворена з коферменту А, молекула якого містить аденин, рибозу, пантотенову кислоту та тіолову групу, остання реагує з карбоксильними групами, так що молекула ацетил-КоА нарешті отримана, це сполука високої енергії, тому ви може пожертвувати ацетильною групою в циклі трикарбонової кислоти.
У циклі трикарбонової кислоти молекула ацетил-КоА буде метаболізуватися до CO 2 і H 2 O, так само в серії реакцій, які є частиною цього циклу; 3 NADH + H, 1 FADH 2 і молекула GTP. Відновлені кофактори (NADH + H та FADH2), що утворюються в цьому циклі, важливі, оскільки вони діють як транспортери електронів, що отримуються після катаболізму біопалива, отже, ці кофактори, отримані в результаті циклу Кребса або трикарбонових кислот, згодом віддавати ці електрони до першого комплексу дихального ланцюга у випадку кофактора NADH + H або до комплексу II у випадку кофактора FADH2, після серії реакцій, в яких ці кофактори окислюються, а комплекси відновлюються ( рис.2).
Відновлені кофактори, отримані в анаеробному гліколізі клітинного цитозолю, не можуть перетнути мітохондріальну мембрану, тому для введення вони використовують човники гліцерин - 3 - фосфат (головним чином у клітинах мозку та м’язів) та малат - аспартат (переважно в печінці та серце), які вводять електрони відновлених кофакторів з цитоплазми в мітохондрії.
Проходження електронів через дихальний ланцюг починається в комплексі I або II, пізніше вони переходять до убихінону (Q), потім до комплексу III, це зводиться до цитохрому і, нарешті, цитохром відновлюється до комплексу IV, який віддаватиме 2 електрони кисню для утворення молекули води, слід зазначити, що проходження електронів через ферментативні комплекси дихального ланцюга здійснюється від комплексу, який має нижчий стандартний потенціал відновлення, до комплексу, який має більш високий стандартний потенціал відновлення, тобто від комплексу з меншою спорідненістю до електронів до комплексу, який має вищу спорідненість до них.
Проходження електронів через комплекси дихального ланцюга поєднується з перекачуванням протонів за допомогою комплексів I, III та IV в міжмембранний простір, створюючи, таким чином, електрохімічний градієнт у цьому просторі, тенденцію протонів. стабілізуючи градієнт по обидва боки внутрішньої мітохондріальної мембрани, це дозволить їм пройти через комплекс АТФази, структура якого базується на субодиниці F 1 і F 0. Субодиниця F 0 утворює канал, по якому проходять протони, тоді як субодиниця F 1 є місцем, де з АДФ та Пі відбувається утворення молекули АТФ, тому важливо відзначити, що енергія, яка генерується після протони, що проходять через цей канал, дозволяють звільнити молекулу АТФ, що утворилася субстратами (АДФ і Пі), не слід думати, що енергія, отримана при проходженні протонів, є правильною енергією, що міститься в АТФ.
Отримавши молекули АТФ, вони можуть бути використані в широкому діапазоні фізіологічних процесів, які вимагають для нормального функціонування та підтримання життєво важливого балансу для людини.
В організмі є тканини, які виділяються за вимогою інтактного окисного метаболізму, що забезпечує отримання необхідної енергії для ефективного виконання своєї функції, в цих тканинах переважає центральна нервова система, в межах якої виділяються базальні ганглії. для представлення високої метаболічної активності ситуація, яка робить їх вразливими до пошкодження клітин, так що збої в клітинному метаболізмі цих структур будуть суттєво відображатися на контрольних функціях, які вони виконують в організмі.
Базальні ганглії (globus pallidus, путамен, хвостате ядро, ядро субталамуса та чорна субстанція) - це скупчення нейрональних тіл, основною функцією яких є контроль за початком, амплітудою та швидкістю рухів 4, у дитини з синдромом Лі - порушення окисного метаболізму та некроз цих структур перетворюється на дефекти руху, тому вони характеризуються руховими дефіцитами або аномальною активацією рухової системи, що призводить до ригідності, тремору та мимовільних рухів (рис. 3).
Некроз базальних гангліїв.
Зниження продукції АТФ, що відбувається при цьому синдромі, не обмежується лише його впливами на центральну нервову систему, наслідки цього зниження енергії відображаються на клінічних проявах синдрому Лі.
Судоми, психомоторна відсталість, атрофія зорового нерва, гіпотонія, слабкість, млявість, блювота, ненормальні рухи (атаксія, тремор), дратівливість, втрата зору та порушення дихання 3 .
Спадщина синдрому Лі
Хоча мітохондрія має свою власну ДНК, вона не залежить від участі ядерної ДНК, оскільки обидві беруть участь у кодуванні субодиниць, що складають кожен з ферментативних комплексів дихального ланцюга, за винятком комплексу II. виключно кодується ядерною ДНК, тому, залежно від ураженого комплексу та його кодування, тип успадкування може бути: материнським, у разі мутацій мітохондріальної ДНК або аутосомно-рецесивним, коли мутації відбуваються в ядерній ДНК 5 .
Найбільш зареєстровані випадки синдрому Лі були виявлені за допомогою мутацій мітохондріальної ДНК, ген якої кодує одну з субодиниць АТФази, саме тому він представляє материнську спадщину, з іншого боку, мутації ядерної ДНК, що впливають на синдром комплексу IV представляє аутосомно-рецесивне успадкування. Частота прояву цього синдрому становить 1 з 36 000 пологів.
Діагностика та лікування
Клінічні прояви синдрому проявляються до 6-місячного віку; лікар, що оцінює випадок, вимагає великих навичок, щоб мати можливість диференціювати цей розлад від інших розладів мітохондрій, які мають подібні характеристики та з якими його можна сплутати, для діагностики Адекватний диференціал повинен використовувати ресурси, такі як; Біопсія м’язів для аналізу функціонування дихального ланцюга та виявлення помилок ферментних комплексів, а також використання магнітно-резонансної та комп’ютерної томографії, що дозволяє виявити некроз базальних гангліїв, головна характеристика Лі синдрому.
Лікування після діагностики цього синдрому є паліативним, застосування кетогенної дієти, коли синдром пов’язаний з дефіцитом піруватдегідрогенази, може не відображати жодної користі через відсутність ефективного лікування, яке дозволяє зменшити шкоду, тривалість життя дитини при цьому синдромі не перевищує 2 років.
Жодної спонсорської допомоги для виконання цієї статті не отримано.
Конфлікт інтересів
Автор не заявляє конфлікту інтересів.
Доктору Ауреліо Мендосі Медельїну, професору навчального відділу з біохімії Медичного факультету Автономного університету штату Мексика, за знання, що вплинули на виконання цієї статті.