Резюме
Цей протокол забезпечує надійний метод встановлення гуманізованих мишей з імунною системою людини та клітинами печінки. Відновлені подвійні імунодефіцитні миші, досягнуті внутрішньосплевною ін'єкцією гепатоцитів людини та гемопоетичних стовбурових клітин CD34 +, сприйнятливі до зараження вірусом імунодефіциту людини-1 та рекапітульованих уражень печінки, що спостерігаються у ВІЛ-інфікованих пацієнтів.
Анотація
Вступ
З моменту появи антиретровірусної терапії спостерігається значне зменшення смертності, пов’язаної з моноінфекцією ВІЛ-1. Однак захворювання печінки виявилось поширеною причиною захворюваності у ВІЛ-інфікованих пацієнтів 1, 2. Ко-інфекції вірусу гепатиту з ВІЛ-1 є більш поширеними, на них припадає від 10% до 30% ВІЛ-інфікованих в США 3, 4, 5 .
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Протокол
Цей протокол затверджено Інституційним комітетом з догляду та використання тварин (IACUC) при Медичному центрі Університету Небраски.
ПРИМІТКА: Отримайте схвалення від місцевої IACUC перед проведенням експериментів на тваринах.
1. Обробка пуповинної крові та виділення HSpC шумано
2. Підготовка гепатоцитів людини до трансплантації
- Видаліть кріоконсервовані гепатоцити з рідкого азоту, швидко занурте флакон у водяну баню і розморожуйте приблизно 90 - 120 с.
- Зніміть кришку з флакона та вилийте розморожені гепатоцити в конічну трубку об’ємом 50 мл із підігрітим розморожуючим середовищем.
- Підвісьте клітини, похитуючи пробірку об’ємом 50 мл вручну протягом декількох секунд.
ПРИМІТКА: Не крутіть трубку. - Відлякуйте клітини при 100 х g протягом 8 хв при кімнатній температурі. Гранульовані клітини промивають у PBS 0,1% BSA та струшують свіжим або розмороженим HSCC (співвідношення 10: 1) у PBS у кінцевому обсязі 80 мкл/мишу.
3. Управління тваринами, скринінг, генотипування та лікування трансплантації hSPC та гепатоцитів людини
4. Валідація трансплантата печінки людини методом ІФА та імунної системи людини методом проточної цитометрії
ПРИМІТКА: Оцінюйте відновлення печінки та імунної системи людини щомісяця, починаючи через 1 місяць після трансплантації за допомогою імуноферментного аналізу (ІФА) та проточної цитометрії відповідно.
5. ВІЛ-інфекція мишей TK-NOG та її вплив на печінку та імунну систему людини
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Репрезентативні результати
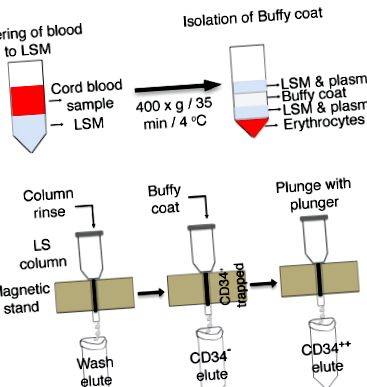
Фігура 1 : Схема збагачення клітин CD34 + з пуповинної крові. (ДО) Пуповинну кров шарують у середовищі для розділення лімфоцитів (LSM) та центрифугують для виділення шару буфі. (B) Колонки LS поміщають на магнітну підставку і промивають буфером BSA з подальшим додаванням шару buffy. Клітини, позитивні для CD34, потрапляють у колонки, а клітини CD34 елююються в окремих пробірках. Клітини CD34 +, що потрапили в смоли колони, занурюють, і клітини збирають у нову пробірку. Клацніть тут, щоб переглянути збільшену версію цього малюнка.
Малюнок 4 : Концентрація альбуміну вимірюється методом ІФА в сироватці крові подвійних мишей людини. Мишам трансплантують гепатоцити людини (HEP) та гемопоетичні клітини CD34 + стовбур/попередник (HSPC) (№11). Сироватку збирають у різний час через 1, 4 та 6 місяців після трансплантації, і проводять розведення для регулювання невідомих концентрацій зразків у діапазоні стандартів. Кожен символ представляє окреме значення миші. Результати представляють медіану, а також окремі значення. * Р 8. Клацніть тут, щоб переглянути збільшену версію цього малюнка.
Малюнок 5: Вплив на ВІЛ-1 у сироваткових рівнях альбуміну та виснаження гепатоцитів CK18 + у печінці подвійних мишей людини. (ДО) Концентрацію альбуміну контролюють у неінфікованих мишей (№9), трансплантованих HEP та HSpC людини через 1 та 4 місяці. Мишей заражають (n x 10) ВІЛ через 4-5 місяців після трансплантації і приносять у жертву через 5 тижнів після зараження. Кожен символ представляє окреме значення миші. Результати представляють медіану, а також окремі значення. * Р 8. (B) П'ятимікронні зрізи печінки від неінфікованих мишей TK-NOG (HEPs + HSP, ліва панель) та ВІЛ-інфікованих мишей TK-NOG (HEPs + HSCCP + ВІЛ, права панель) фіксують, вкладають у парафін і фарбують для захисту від людини антитіла до цитокератину-18 (CK18). Про ВІЛ-1, що спричинює виснаження гепатоцитів CK18 +, свідчить територія, менш зайнята клітинами CK18 + людини. Результати, представлені тут, отримані від неінфікованої миші та ВІЛ-інфікованої миші, трансплантованої двома гепатоцитами людини та HSPC.
Малюнок 6 : Співвідношення клітин CD4 + до CD8 + T у периферичній крові та печінці відновлених подвійних мишей, не інфікованих та інфікованих ВІЛ-1. Для подвійно відновлених неінфікованих мишей: замкнене коло; HEP + HSPC; кров No7; печінка № 6. Для мишей, інфікованих ВІЛ-1: відкриті кола; HEP + HSPC + ВІЛ; кров n до 10; печінка № 11. Результати представляють медіану, а також індивідуальні значення. * Р 8. Клацніть тут, щоб переглянути збільшену версію цього малюнка.
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Обговорення
В даний час подвійна гуманізація показана трансплантацією CD34 + HSCCP людини та клітин печінки плода; Однак поводження з новонародженими тваринами створює технічні проблеми 13, 14. HSCCP можна отримати або виділити з безлічі джерел, таких як клітини печінки плода (FLC), ембріональні стовбурові клітини (ESC) та CB. Однак етичні питання обмежують використання ESC та FLC. CB не має таких обмежень і є більш корисною альтернативою для отримання HSCCP, а також є цінним джерелом первісних стовбурових і потомкових гемопоетичних клітин, які можуть відновити функціональну імунну систему. Пуповинна кров не повинна бути старшою за одну добу, коли використовується для ізоляції HSCCP, оскільки ефективність HSCCP сильно залежить від віку. Перед кріоконсервуючими клітинами слід перевірити чистоту ізольованих HSCCP. Уникає перехресного забруднення CD3 + Т-лімфоцитів, оскільки це може призвести до системної хвороби трансплантата миші-хазяїна та гострої алорежекції HPH при трансплантації з невідповідними клітинами.
Комерційно доступні гепатоцити використовувались як джерело для відновлення печінки 8, 13. Дорослі гепатоцити є кращими для відновлення печінки завдяки їхній більшій ефективності прищеплення та стійкості протягом тривалого періоду 29.
Наявність імунної системи людини у моделі миші підвищувала рівень ALB, як було продемонстровано раніше, 30, 31. Однак ефективність гепатоцитів та відновлення імунної системи може змінюватися залежно від різних джерел донорських клітин і залежить від миші-реципієнта. Тому кожну мишу потрібно оцінювати на прищеплення, і найважливішою частиною є використання антитіл або реагентів, специфічних для людини, які не перехресно реагують з клітинами миші. Специфічні для людини реагенти та антитіла, використані в дослідженні, представлені тут, докладно описані в Таблиця матеріалів. Якщо антитіла, крім зазначених у Таблиця матеріалів для дослідження обов’язково перевірте специфіку людини.
Оптимальним умовою буде трансплантація сингенних клітин; однак цього технічно важко досягти. По можливості, HSCCP та гепатоцити слід об’єднувати від донорів з частково спареними антигенами класу 1 лейкоцитів людини (такими як HLA-A2).
Для обстеження мишей на дослідження ВІЛ проводиться забір крові у різні моменти часу для визначення оптимальної реконструкції печінки та імунної системи; Переважними є проточна цитометрія та ІФА, оскільки їх можна проводити лише з невеликою кількістю крові. Клітини крові та сироватку з одного зразка можна використовувати для проточної цитометрії та ІФА, відповідно. Важливо проводити адекватні розведення сироватки в кожен момент часу (діапазон 1000 - 40 000), щоб оцінити рівні ALB, щоб невідомі концентрації могли бути введені в діапазон стандартних концентрацій (діапазон набору: 6,25 - 400 нг/мл).
Прозапальні цитокіни у відповідь на інфекцію ВІЛ-1 у присутності імунної системи людини також можуть бути корисними для вирішення питань взаємодії гепатоцитів та імунних клітин. Модель корисна для показу імунопатогенезу індукованого ВІЛ-1 захворювання печінки, оскільки вона повторює пошкодження печінки так само, як і у людей, про що свідчить низький коефіцієнт CD4: CD8, зниження рівня ALB, смерть від гепатоцитів людини та імунна активація печінки. Модель також має деякі обмеження, такі як низький рівень цитотоксичної активності Т-клітин та порушення переключення між класами імуноглобулінів. Через присутність імунної системи людини та печінки модель, представлена тут, демонструє обіцянку щодо коінфекції вірусу ВІЛ-1 та гепатиту, хронічної гепатитної інфекції (для з’ясування механізмів імунної відповіді проти гепатиту) та як цироз Модель.
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
- Топ-модель Бар Рефаелі розкрила свій секрет збереження ідеального тіла
- Подвійний FP не злітає, він лише додав на 3 відсотки більше студентів і втратив 18 компаній - La Nueva
- Glucoject Dual Plus Lancing Device 1Ud
- Давайте поговоримо про форум Діснея - Історія Міккі Мауса - ГАРАЖ ЩУРА; N
- Печінка доповнює зараз Продукти харчування Печінка оновлюється
