предметів
реферат
Попередні дослідження показали, що багато несприятливих факторів навколишнього середовища під час внутрішньоутробного життя можуть впливати на розвиток захворювань дорослих (наприклад, гіпертонія, цукровий діабет тощо). 1, 2, 3 Ряд внутрішньоутробних образ (наприклад, нікотин, гіпоксія, дієта з низьким вмістом білка тощо) може "запрограмувати" певні серцево-судинні проблеми та підвищити сприйнятливість до серцево-судинних захворювань у більш пізньому віці. 3, 4, 5, 6 Доведено, що надмірне споживання сахарози під час вагітності призводить до ожиріння та непереносимості глюкози у цуценят, а також до гіпертонії у обох статей 1 і може асоціюватися з резистентністю до інсуліну та гіперглікемією щурів. Пренатальна дієта з високим вмістом сахарози (ГС) також може бути причиною ряду несприятливих наслідків для розвитку плоду. Однак основні механізми, що сприяють розвитку гіпертонії у нащадків, які зазнають високого рівня внутрішньоутробного цукру, неясні.
Було показано, що при застосуванні щурам під час вагітності каптоприл, інгібітор перетворюючого фермент ангіотензину, запобігає розвитку гіпертонії, запрограмованої низьким вмістом білка материнською дієтою, що свідчить про ключову роль системи ренін-ангіотензинових клітин (RAS) у розвитку. гіпертонія. Крім того, специфічний антагоніст рецептора AT1 (AT1R), лозартан, може усунути підвищення артеріального тиску (АТ), спричинене материнською дієтою з низьким вмістом білка у щурів, припускаючи, що ангіотензин II (Ang II), найважливіший гормон у регуляції серцево-судинного гомеостазу, відіграє важливу роль у пренатальному програмуванні гіпертонії. У цьому дослідженні ми вивчали тиск, що реагує на АТ та Ang II у нащадків, які зазнали високого рівня цукру до пренатального періоду.
Ang II може стимулювати звуження судин трьома основними способами: вивільняючи Са 2+ з внутрішньоклітинних запасів, трансмембранним припливом Са 2+ переважно через канали Са 2+ типу L (Ca v 1.2) та активуючи одну або декілька протеїнкіназ С ( PKC) ізоформи. Показано, що PKC збільшує внутрішньоклітинний Ca 2+ за рахунок активації Ca в 1, 2, що, в свою чергу, викликає звуження судин. Наше попереднє дослідження показало, що надмірне споживання цукру під час вагітності призвело до посилення судинної реакції на Ang II. 12 Уайт та ін. 13 показали, що підвищена чутливість брижових артерій стрептозотоцин-діабетичних щурів до альфа-адренергічних агоністів більше залежить від позаклітинного кальцію. Інші лабораторії показали, що клітини гладкої мускулатури аорти на мишачій моделі діабету 1 типу демонструють збільшення рівня струму Са на рівні 1, 2. Тому це дослідження було розроблене, щоб перевірити, чи сприяє шлях PKC/Cao 1.2 підвищенню Ang II- опосередкована реакція на тиск та звуження судин у потомстві HS.
методи
Вагітних щурів Спраг-Доулі з Центру тварин Університету Сочовського утримували в контрольованому середовищі при 22 ° C з 12-годинним циклом світло/темрява. Їх випадковим чином розділили на дві групи: (1) контрольну групу годували стандартною дієтою, (2) групу ГС забезпечували однаковою їжею та 20% розчином сахарози з 1 дня вагітності. водопровідної води та стандартної їжі для щурів протягом 5 місяців. Усі процедури були затверджені Інституційним комітетом з догляду за тваринами та відповідали Посібнику з догляду та використання лабораторних тварин.
Вимірювання рівня глюкози в крові та маси тіла
Вагітним щурам (на 21 день гестації), а також дорослим чоловікам у віці 5 місяців знеболювали сумішшю кетаміну (75 мг кг-1) і ксилазину (10 мг кг-1; Hengrui Medicine, Цзянсу, Китай) вводиться внутрішньочеревно. Зразки крові плоду брали після обезголовлення. Зразки крові матері та потомства були отримані з черевної аорти. Зразки крові брали в крижані пластикові пробірки, що містять гепарин. Глюкозу в крові визначали за допомогою аналізатора Nova (Nova Biomedical, Waltham, MA, США) та вимірювали масу тіла.
Вимірювання АТ
Потомство імплантували в їх стегнові артерії за допомогою катетера для реєстрації АТ, як описано. Після 3 днів відновлення після хірургічного втручання АТ постійно вимірювали у свідомих та вільно рухаються щурів. Після основного запису протягом
Ang II (100 нг кг-1; Sigma, Сент-Луїс, Каліфорнія, США) 16 в 0,2 мл фізіологічного розчину вводили внутрішньовенно через катетер протягом 60 хвилин і реєстрували АТ протягом додаткових 120 хвилин за допомогою приладу Power. -Лабораторна система та програмне забезпечення (AD Instruments, Белла Віста, Новий Південний Уельс, Австралія).
Вимірювання судинного тонусу
Невеликі сегменти брижових артерій (гілка четвертого порядку) були виділені в розчині Кребса-Генселейта (ммоль -1: NaCl 115, NaHCO 3 25, KCl 4, 6, NaH 2 PO 4 1, 2, MgCl 2 1, 2, CaCl 2 2, 5 та глюкоза 10). рН 7, 4 і змонтований у мультиміографічній системі (Danish Myo Technology, Центральна Ютландія, Данія), що підтримується в кисненому розчині Кребса-Генселейта (95% O 2, 5% CO 2) при 37 ° C. 17, 18 Після врівноваження для Через 60 хвилин судинні кільця скорочувались із кумулятивно зростаючими концентраціями Ang II (10-11-10-5 моль-1). Лозартан (антагоніст AT1R, 10 мкмоль l -1), 19 PD123319 (антагоніст AT2R, 10 мкмоль l -1), 19 GF109203X (антагоніст PKC, 1 мкмоль l -1) 20 або ніфедипін (Cav 1, 2, 10 мкмоль l антагоніст ) - 1) 21 використовували для попередньої обробки сегментів протягом 30 хвилин перед застосуванням Ang II. Кумулятивні криві концентрація-відповідь активатора ПКС, форболу 12, 13-дибутирату (PDBu, 10 - 9 - 10 - 5 л - 1) або KCl (20 - 140 ммоль л - 1) проводили як у відсутність, так і в присутності ніфедипіну в брижових артеріях. Тон судини нормалізувався за рахунок максимального скорочення, викликаного 60 ммоль-1 KCl, або за рахунок максимальної реакції судини на конкретний агоніст. Кожен контейнер використовувався лише один раз. Сигнали реєстрували за допомогою системи Power-Lab із програмним забезпеченням Chart 5 (AD Instruments, Castle Hill, NSW, Австралія).
Виділення міоцитів судин
Міоцити ферментативно виділяли з окремих брижових артерій. 22 Посудини розрізали на смужки розміром 1 мм у крижаному розчині (PSS), що містить (ммоль-1) 137 NaCl, 5,6 KCl, 1 MgCl 2, 0,42 Na 2 HPO 4, 0,44 NaH 2 PO 4, 4,2 NaHCO 3 і 10 HEPES (рН 7, 4). Всі розчини ферментів містили 1 мг мл-1 бичачого сироваткового альбуміну. Ізольовані судинні клітини гладких м’язів отримували шляхом м’якого розтирання в PSS. Клітини зберігали при 4 ° C для дослідження протягом 6 годин.
Електрофізіологічне вимірювання
Міоцити поміщали безпосередньо на дно експериментальної камери і візуалізували за допомогою інвертованого мікроскопа (OLYMPUS CKX41, Токіо, Японія). Клітини промивали розчином для ванни для видалення домішок. Патч-піпетки витягували з тонкостінних скляних капілярів, використовуючи засіб для зняття мікропіпеток (модель P-30, Sutter Instruments, Новато, Каліфорнія, США). Опір наконечника пластирової піпетки становив 3 х 4 МОм при наповненні внутрішнім розчином піпетки.
Затискач напруги для цілої комірки виконувався за допомогою комп’ютерно керованої системи затискання струму та напруги (Multiclamp 700B, Digidata 1440, Axon Instruments, Фостер-Сіті, Каліфорнія, США) на базі Clampex 10.1 та Multiclamp Commander 1. Зсув піпетки та система цілих комірок ємності компенсувались електронним способом. Потенціал клітинної мембрани вимірювали в беззорковому режимі в конфігурації струмозатискача для цільної комірки, а струм цілої комірки вимірювали в режимі епізодичної стимуляції в конфігурації струмофіксатора напруги для цілої комірки з використанням підсилювача Axonpatch 700B та Clampex 10.1. струми комірок нормалізували за допомогою ємності комірок, щоб отримати щільність струму.
Вестерн-блот-аналіз
Наявність PKC α, δ та Cav 1.2 α1 c-субодиниць білків у мезентеріальних артеріях вимірювали за допомогою Вестерн-блот-аналізу, нормалізованого до β-актину. 23, 24 Первинними антитілами були козині поліклональні антитіла (Санта Круз Біотехнологія, Санта Круз, Каліфорнія, США) проти субодиниць Са в 1,2 та 1 c-субодиницях (1: 200), кролячі поліклональні антитіла (Санта Круз Біотехнологія) проти ПКСа (1: 200) або PKCδ (1: 200). Вторинним антитілом було антисептичне антикозиче антитіло (1: 4 000) або антитіло козячого (кролицьке) (1: 4 000; Beyotime Biotechnology, Цзянсу, Китай). Імуносигнали візуалізували за допомогою детектування хемілюмінесценції (Amersham Biosciences, Piscataway, NJ, США) та системи візуалізації UVP (EC3-Imaging-System, Upland, CA, USA). Сигнали візуалізації оцифровували та аналізували, а потім отримували коефіцієнт інтенсивності смуги β-актину для кількісного визначення рівня відносної експресії білка.
Аналіз та статистика
Дані були виражені як середнє значення ± sem Signal (P 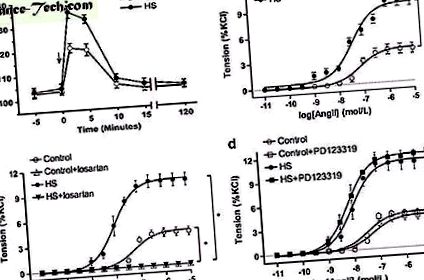
( a ) Анг-опосередковані реакції тиску у нащадків. Стрілка: час внутрішньовенного введення Ang II. Контроль (n = 10 з п'яти дамб), HS: висока сахароза (n = 12 з п'яти дамб). ( b ) Ang II-опосередковане звуження судин у брижових артеріях нащадків (n = 5, кожна група). ( c, d ) вплив лозартану або PD123319 на опосередковану Ang II вазоконстрикцію в брижових артеріях нащадків (n = 5, кожна група). * P
( a, b ) Вплив GF109203X або ніфедипіну на опосередковані Ang II вазоконстрикції в брижових артеріях нащадків (n = 5, кожна група). ( c, d ), PDBu та KCl-індуковане звуження судин за відсутності та присутності ніфедипіну в брижових артеріях нащадків (n = 5, кожна група). Дані v d були виражені у відсотках від максимальної реакції цього судини на KCl. * P # P
( a, b ) репрезентативні сліди струмів Сао 1,2, зареєстровані з контрольних та клітин HS. ( c ) Графіки I - V показали збільшення внутрішнього струму при +10 мВ до +50 мВ у клітинах HS (n = 20) порівняно з контролем (n = 25). * P 0, 05). Інактивація V1/2 відбулася при -9,00 ± 1,29 мВ для контролю та -6,24 ± 1,13 мВ для клітин HS (P> 0,05). Не було значної різниці між контрольною та HS-клітинами у залежності від напруги активації та інактивації Ca в 1.2 (рис. 4).
( a, b ) Типові струми інактивації, отримані з кроком +20 мВ протягом 200 мс після застосування серії 1000-мс потенціалів кондиціонування від -60 до +60 мВ. ( c ) Залежність від напруги кривих активації струмів Ca в 1, 2 в контролі (n = 15) та комірок HS (n = 11) (G, провідність; G max, максимальна провідність). ( d ) Залежність від напруги кривих інактивації струмів Ca в 1, 2 у контрольних групах (n = 22) та HS (n = 19) (I, струм; I max, максимальний струм). Репрезентативні сліди струмів активації показані на малюнку 3 ( a ) ( b ).
Повнорозмірне зображення
PKC a, 5 ізоформ та експресія Cao 1,2 та 1 c у брижових артеріях
Вестерн-блот-аналіз не показав суттєвої різниці в рівнях експресії субодиниць α1c Cao 1.2 та ізоформи PKC8 в брижових артеріях між HS та контрольною групою. Вища експресія ізоформи PKCα виявлена у потомства HS (рис.5).
Експресія PKC α, δ ізоформ та субодиниць Ca 0 1,2 та 1 c в мезентеріальних артеріях нащадків (n = 5, кожна група). * Р 9, 25 і РКС/Са в 1,2 є критичними при судинозвужувальних реакціях та реакціях тиску. Ang II зв'язується з AT1R, щоб активувати фосфоліпазу C, а потім гідролізує мембранні фосфоїнозитиди до діацилгліцерину, щоб активувати PKC. 26, 27 PKC може активувати Cav 1.2 шляхом прямого фосфорилювання 28 або шляхом зміни мембранного потенціалу через інгібування каналів BK. Активація Са в 1,2 може призвести до позаклітинного припливу Са 2+ і звуження судин.
Надмірне споживання цукру під час вагітності може призвести до надмірної експресії AT1R у нащадків. У цьому дослідженні лозартан, специфічний антагоніст AT1R, скасував підвищену судинну реакцію на Ang II у групі HS, тоді як блокатор AT2R PD123319 не виявив істотного впливу на скорочення, опосередковані Ang II, припускаючи, що AT1R, а не AT2R, опосередковує Ang II -посилена звуження судин і реакція на тиск у нащадків ГС. Дієта з високим вмістом цукру під час вагітності може змінити рівень крові та рівень гормонів, включаючи рівень глюкози та інсуліну. Відомі взаємодії між RAS та іншими ендокринними системами, пов’язаними з гомеостазом глюкози. У попередньому дослідженні гіперглікемія підвищувала регуляцію компонентів RAS, необхідних для синтезу та дії Ang II, що може сприяти гіпертонії, пов'язаній з метаболічним синдромом. Тому є розумним припустити, що біохімічні та ендокринні зміни після передозування цукру перед пренатальним періодом можуть спричинити зміни RAS у нащадків. Ми також виявили, що GF109203X пригнічує посилену Ang II вазоконстрикцію, припускаючи, що посилені функції PKC відіграють певну роль у ангіноконстрикції стимульованої Ang II вазоконстрикції у нащадків HS. Як вищий компонент шляху Ang II, надмірно виражений AT1R може сприяти поліпшенню функції PKC.
Гестаційний цукровий діабет може призвести до підвищення активності та посиленого розподілу кількох ізоформ PKC у ранньому органогенезі тканин, а гіперглікемія може збільшити активність PKC щодо різних питань in vitro. 32, 33, 34 ізоформи PKC, включаючи PKCa, PKCy, PKC8, PKCɛ та PKCζ, були виявлені в брижових артеріях щурів. Здається, лише α та δ ізоформи беруть участь у PDBu-індукованій вазоконстрикції. PKCα може посилити Ca 2+ -залежне скорочення клітин, і його надмірна експресія пов'язана з гіпертонією. У цьому дослідженні вимірювали експресію PKCα та PKCδ, щоб визначити, чи брали вони участь у покращеній функції PKC. Крім того, PDBu використовували для тестування активності ПКК. Надмірна експресія PKCα, а не PKCα, була виявлена у нащадків HS. На сьогоднішній день показано, що пренатальна гіпоксія індукує епігенетичне програмування гена PKCɛ у серці щурів. Таким чином, епігенетичні фактори можуть бути одним з основних механізмів зміни PKCα, області, яка заслуговує на подальше дослідження. PDBu викликав більшу вазоконстрикцію у нащадків HS. Крім того, ніфедипін перевернув вазоконстрикцію, посилену PDB, припускаючи, що змінений шлях PKC/Cao 1.2 може сприяти підвищенню Ang II судинного тонусу.
На закінчення, експерименти з мікросудинами та клітинами дозволяють припустити потенційні шляхи, які можуть бути пов'язані зі збільшенням активності PKC/Ca у 1.2 та пов'язані зі змінами AT1R, PKCa та Ca у 1.2. Ці спостереження можуть дати нові уявлення про механізми, що лежать в основі реакції, посиленої Ang II, та судинного тонусу у нащадків, які зазнали пренатального високого цукру. Ця інформація є важливим внеском у наше розуміння ранньої профілактики або лікування серцево-судинних захворювань, запрограмованих внутрішньоутробно .
