- предметів
- реферат
- вступ
- Пацієнт і методи
- Реєстрація пацієнта та відбір проб
- Дослідження та аналіз послідовності
- Дослідження експресії білка
- Тест на підрахунок копій Такмана
- результат
- Пробанд ведмеді мутація GPD1
- Гаплоінформація про GPD1 у пробанда та батька
- Дефіцит білка GPD1 у зразку тканини печінки пробанда
- обговорення
предметів
- Генетика хвороб
- Захворювання печінки
- Порушення обміну речовин
- мутації
реферат
Клініко-патологічні та лабораторні дані, включаючи масивну гепатомегалію, стеатоз та виражену гіпертригліцеридемію в дитячому віці, надзвичайно рідкісні. Ми описуємо дитину, яка має вищезазначені дані, і, незважаючи на велике діагностичне тестування, жодної причини не встановлено. Повне секвенування exom проводили на ДНК пацієнта та батьків. Ідентифіковані мутації в GPD1, що кодує гліцерол-3-фосфатдегідрогеназу, яка каталізує оборотну окислювально-відновну реакцію дигідроксиацетонфосфату та NADH до гліцерол-3-фосфату (G3P) та NAD +. Пробанд успадкував видалення GPD1 від батька, як було визначено аналізом номера копії та зміною помилки с. (R229Q) від матері. Білок GPD1 не був присутній у біопсії печінки пацієнта на вестерн-блотті. Низька нормальна активність карнітинпальмітоїлтрансфераз, CPT1 та CPT2, була присутня у фібробластах шкіри пацієнта, без мутацій у генах, що кодують ці білки. Це перший звіт про гетерозиготні мутації сполуки в GPD1, пов'язаних з дефіцитом білка GPD1 та зниженням активності CPT1 і CPT2.
GPD1 (MIM 138420) кодує цитоплазматичну NAD-залежну гліцерин-3-фосфатдегідрогеназу 1 (GPD1), білок 349 амінокислот розміром 37,5 кД, який каталізує оборотну окислювально-відновну реакцію дигідроксиацетонфосфату (DHAP) та NADH до гліцерину-3 -фосфат.) та НАД +. 1, 2 GPD1 разом з мітохондріальним ферментом, GPD2 також відіграє важливу роль у транспорті відновлювальних еквівалентів від цитозолю до мітохондрій. 2 Нещодавно гомозиготна мутаційна мутація в GPD1, c.361-1G> C, котра передбачала кодувати p.Ile119fsX94, була виявлена у 10 членів сімей з чотирьох високопов'язаних ізраїльських арабських сімей, які виявляють гепатомегалію, печінковий стеатоз та гіпертригліцеридемію на ранніх стадіях. . 2
Моногенна гіпертригліцеридемія зумовлена мутаціями ліпопротеїнової ліпази (LPL), аполіпопротеїну C-II (APOC2), глікозил-фосфатидил-інозитолу, закріпленого HDL-зв'язуючим білком (GPIHBP1), apoA-V (APOA51) та фактору 1 (LMOF). 2, 3, 4 Стеатоз печінки як моногенне захворювання в ранньому дитинстві є надзвичайно рідкісним і описаний при синдромі Чанаріна-Дорфмана через домен абгидролази, що містить 5 (ABHD5) мутацій та дефекти окислення жирних кислот мітохондрій, включаючи CPT1A, CPT2 та дуже дуже ацильна Довголанцюгова дегідрогеназа CoA (ACADVL). 5, 6, 7 У цих пацієнтів часто є інші особливості, включаючи гіпоглікемію, енцефалопатію та кардіоміопатію, міопатію та печінкову недостатність. Поєднання глибокої гіпертригліцеридемії та важкої гепатомегалії в ранньому дитинстві є надзвичайно рідкісним.
Тут ми описуємо пацієнта кавказького походження з масивною гепатомегалією, жировою печінкою та важкою гіпертригліцеридемією, що несе гетерозиготну мутацію сполуки в GPD1 (MIM 138420). Це перший випадок мутації GPD1, виявленої за межами ізраїльського арабського населення. Далі ми показуємо, що білок GPD1 відсутній у тканині печінки пацієнта. Не було компенсаційного підвищення рівня GPD2 у відповідь на дефіцит GPD1. Більше того, хоча активність карнітинпальмітоїлтрансфераз CPT1A та CPT2 була знижена у фібробластах пацієнта, мутацій у цих генах не виявлено, а кількість CPT1A у зразку тканини печінки не змінилася.
Пацієнт та методи
Реєстрація пацієнта та відбір проб
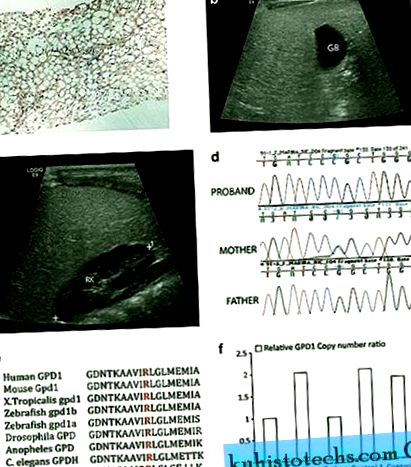
Рентгенопатологічні та генетичні дані у пробанда з мутацією GPD1 . a ) Біопсія печінки: паренхіма печінки показує зміну макро- та мікровезикулярного жиру при фарбуванні гематоксиліном та еозином (H&E), збільшення × 10 ( b a c ) УЗД демонструє дифузну гіперехогенність печінки з дрібнозернистим малюнком. Для порівняння, жовчний міхур (ГБ) ( b ) і права паренхіма нирок (РК) ( c ) є гіпоехогенними. d ) Аналіз послідовності ДНК геномних продуктів ПЛР ілюструє три генотипи для GPD1 c.686G> C, що спостерігаються в сім'ї з гомозиготним пробозимом, матір'ю гетерозиготною та батьком WT для алеля. e ) Змінений залишок аргініну (червоний) еволюційно добре зберігається у білках GPD1 та GPD1L у хребетних та нижчих організмів, включаючи дріжджі. ( f ) Відносні рівні експресії GPD1 за допомогою аналізу числа копій показали, що батько та пробанд були гаплоінергіями GPD1 щодо матері та двох контролів.
Повнорозмірне зображення
Пропанда (0091-01) та її батьки (0091-02 та 0091-03) були включені в затверджене IRB дослідження, проведене Центром досліджень генів у Центрі досліджень захворювань сиріт в Мантоні під час госпіталізації у дитячу лікарню в Бостоні (BCH). ).). Зразки крові відбирали та обробляли для вилучення ДНК за допомогою Research Connection Biobank Core у BCH. Тканину, що залишилася від діагностичної біопсії печінки, брали для подальшого молекулярного аналізу.
Дослідження та аналіз послідовності
ДНК пробанда та обох біологічних батьків була направлена на секвенування цілого екзома (WES) до Axeq Technologies, Роквілл, штат Медіка, США. Зразки готували у вигляді бібліотеки секвенування Illumina та збагачували їх для екзомічних послідовностей, використовуючи протокол збагачення Exome Illumina. Захоплені бібліотеки послідовно використовувались за допомогою секвенсорів Illumina HiSeq 2000. Показання були зіставлені з набором людських геномів UCSC hg19 за допомогою вирівнювання Берроуза-Вілера (версія 0.5.8). Однонуклеотидні поліморфізми (SNP) та невеликі вставки/делеції були названі SAMtools (версія 0.1.7). Варіанти або SNP фільтрувались за допомогою сервера варіантів екзоли NHLBI (//evs.gs.washington.edu/EVS/) та баз даних dbSNP Build 137.
ПЛР проводили для ампліфікації гена-кандидата (GPD1), використовуваною посилальною послідовністю був GPD1; NG_032168.1, NM_005276.3. Варіанти, визначені в GPD1, були надіслані до Лейденської бази даних відкритих варіантів (LOVD) //databases.lovd.nl/shared/genes/GPD1.
Були використані наступні праймери: GPD1_1F: AGGAGGGGTCTTTTCTCAC та GPD1_1R: ATCAGGTCAGCAACACCACA, а отриману ампліфіковану ДНК направляли в Sanger Sequencing. Результати аналізували за допомогою програмного забезпечення Sequencer 5.0 і порівнювали з послідовністю гена дикого типу (WT). Праймери також були розроблені для послідовності різних SNP, суміжних з GPD1. SNP включені: rs836180, rs200359712, rs201128732, rs2640533, rs147189770, rs10875996, rs4898546, rs7139363, rs836170, rs836171, rs113783111, rs836177, rs10783334, rs7964522, rs112386170, rs7964698, rs10735822, rs71464996, rs71441320, rs55639096 і rs12229758.
Дослідження експресії білка
Вестерн-блот проводили для вимірювання рівнів білка GPD1, GPD2 та CPT1A у зразках тканини печінки, доступних у пацієнта, та контролі порівняно з віком. Тканину зберігали при -80 ° C до аналізу. Перенесені білки тестували на антитіла проти GPD1 (HPA044620, розведення 1: 200, Sigma-Aldrich, Сент-Луїс, Міссурі, США), GPD2 (Ag11036, розведення 1: 2000, Proteintech, Чикаго, Іллінойс, США), CPT1A ( (Ag7202, розведення 1: 500, Proteintech, Чикаго, Іллінойс, США) та GAPDH (розведення FL-335, розведення 1: 1000, Біотехнологія Санта-Крус, Санта-Крус, Каліфорнія, США) як контроль та візуалізація за допомогою посиленої хемілюмінесценції. до GAPDH, використовуючи том перший 4.2.1 (Bio-Rad Laboratories, Inc., Геркулес, Каліфорнія, США) на Image Station 440 (Kodak DS; Eastman Kodak Co., Рочестер, Нью-Йорк, США).
Тест на підрахунок копій Такмана
Аналіз підрахунку копій Такмана (Life Technologies, Woburn, MA, США) проводили на ДНК пробандів, батьків та двох контролів. Зонди для GPD1 (Hs00911535_cn, маркований FAM) та номер контрольної копії (4403326, RNase P (RPPH1) з позначкою VIC) є у продажу. Тест повторювали двічі і проводили у трьох примірниках. Двадцять нанограм (1 мкл) ДНК використовували на лунку з 12 мкл загальної суміші ПЛР Taqman Universal (Applied Biosystems, Woburn, MA, США) та 1 мкл кожного з конкретних зондів (мішень та контроль). Для інтерпретації результатів була використана система ПЛР у реальному часі 7300 від Applied Biosystems для виконання програм ПЛР та виявлення послідовності v1.4. Порівняно ампліфікацію ДНК на основі графіків ампліфікації та отримано середні пороги циклу (Ct). Зміна кратності кількості копій цільового та еталонного генів, нормалізована до контролю, була обчислена з використанням відносної кількості = 2 - A Ct .
результат
Proband несе мутацію GPD1
WES проводили на зразках ДНК від тріо (біологічних батьків та пробандів). Пробанд несе гомозиготну мутацію c.686G> C у гені GPD1, який, як вважається, спричиняє зміну амінокислот p (R229P). Послідовність Сангера підтвердила мутацію (рис. 1г), і одночасно дослідницька група в Онтаріо, використовуючи аналіз генів-кандидатів, незалежно отримала однаковий результат (особисте спілкування від Роберта Хегеле). Цей залишок еволюційно збережений (рис. 1д), і мутації не було в жодній із загальнодоступних баз даних SNP, тоді як c.686G> Потенційно викликає зміну р (R229Q) виявлено в 1/13 005 хромосомах (частота 28 було 1, що узгоджується з мутацією, яка, ймовірно, може пошкодити, а аналіз SIFT 9 показав, що ця зміна не переноситься потенційно. Цікаво, що, хоча мати мутувала гетерозиготно, батько, мабуть, був гомозиготним щодо алелю WT. Ми припустили, що у батька може бути делеція в тому самому локусі, який успадкував пробанд, або може проявляти однопартійну дисомію для алеля матері.
Гаплоінформація про GPD1 у пробанда та батька
Тест на номер копії Такмана було проведено на тріо та двох контрольних зразках ДНК, щоб оцінити, чи були батько та пробанд гаплоінергічними на GPD1. Ланцюжок послідовностей, що використовувався для проектування зонда Taqman Hs00911535_cn, містив мутантний локус GPD1 c.686 (Chr 12: g. 50, 501, 423). Зонд 4403326 для RPPH1 був використаний як еталон. Видалення GPD1 спостерігали у пробанда, а на батька вказувала наявність єдиної копії порівняно з двома копіями, наявними у матері та двох контрольних групах (рис. 1f). Ми підозрюємо, що видалення становить> 1,85 кб, як і в іншому локусі GPD1 (rs836180, Chr 12: g. 50, 503, 269), батько, мабуть, був гомозиготним для SNP, тоді як і пробанд, і мати були гомозиготними для WT алель. Щоб оцінити, чи стосується видалення гени, сусідні (5 'і 3') з GPD1, ми генотипували кілька відомих SNP, виявлених у генах SMARD1 та COX14. Багато з цих СНП були інформативними, і не було доказів їх видалення. Виходячи з розташування геномних координат, ми припускаємо, що делеція менше 28,7 kb. На закінчення, пробанд гетерозиготний для двох мутацій GPD1, які несуть делецію від батька та затримку від матері.
Дефіцит білка GPD1 у зразку тканини печінки пробанда
Для оцінки ефектів цих мутацій з патологічного відділення були отримані зразки біопсії печінки пробанда та контроль віку та статі. Антитіло GPD1 використовували для тестування білка GPD1. У контролі, що відповідає двом ізоформам GPD1, було виявлено дві смуги з молекулярною вагою 37,5 кД (ізоформа 1) та 35 кД (ізоформа 2) (рис. 2). Цікаво, що ізоформа 1 була сильно виражена в контролі, але у пацієнта відсутня. Для порівняння, ізоформа 2 виражалась у невеликих кількостях у контрольних зразках, тоді як у пацієнта вона була незначно збільшена. Ми підозрюємо, що у разі ізоформи 1 мутація c.686G> Missense може впливати на сплайсинг, створюючи аберрантну транскрипцію, яка зазнає опосередкованої безглуздя деградації. Крім того, незначне збільшення ізоформи 2, яке спостерігається у пацієнта, може бути вторинним щодо дефіциту ізоформи 1.
Вестерн-блот-аналіз на зразку біопсії печінки на пробанді та контролі, порівнянному з віком. Білок GPD1 відсутній у пробанді, хоча подібні кількості GPD2 та CPT1A були в пробанді та контролі.
Повнорозмірне зображення
Рівень GPD2, мітохондріальної ізоформи, порівнювали, щоб визначити, чи змінювався він у відповідь на дефіцит GPD1. Ми протестували GPD2 із використанням певного антитіла, і пробанд не виявив жодних змін у рівнях GPD2.
Активність ферментів CPT1 і CPT2 була знижена в культивованих фібробластах шкіри від пробанда, але послідовність обох генів не виявила жодної патогенної мутації. Ми протестували кількість CPT1 A, ізоформи печінки CPT1 в печінці методом вестерн-блот, і не виявили суттєвої різниці між пацієнтом та контролем.
обговорення
Вперше ми повідомляємо про пацієнта, який успадкував дві гетерозиготні мутації GPD1, видалення та затримку зміни. Наші дослідження переконливо показують, що ці дві мутації призвели до дефіциту GPD1. З раннього дитинства у пацієнта був ФТТ, блювота, важка гепатомегалія та гіпертригліцеридемія. Клінічні висновки були дуже схожі на 10 осіб із чотирьох ізраїльських арабських сімей, що мали гомозиготну мутацію заснування c.361-1G> C у GPD1, які мали блювоту, ФТТ, збільшення печінки та гіпертригліцеридемію натще (TG 258-6244 мг)./dl). 2
GPD1 є членом NAD-залежного сімейства GPD. Він відіграє важливу роль у біосинтезі ліпідів, перетворюючи DHAP в G3P, який, у свою чергу, дефосфорилюється до гліцерину з подальшим ацилюванням жирними кислотами з утворенням видів ацилгліцерину. DHAP, проміжний продукт гліколізу, не може бути перетворений у G3P через дефіцит GPD1, що спричиняє відносне перевищення DHAP та зменшення G3P. На мишачій моделі дефіциту GPD1 концентрації DHAP були значно вищими, а G3P нижчими порівняно з рівнями у мишей з печінкою, м’язами та нирками. Механізм жирової печінки у нашого пацієнта може бути обумовлений ацилюванням надлишку ДГАП. Вже описаний шлях ацил-DHAP, де DHAP спочатку можна ацилювати, а потім відновити до 1-ацил-sn-G3P. 11, 12 Як відомо, ацильний DHAP-шлях відіграє важливу роль у синтезі гліцероліпідів у печінці миші. 12
Активність CPT1 та CPT2 була низькою в нормі у фібробластах пацієнта, але не було виявлено мутацій у генах CPT1A та CPT2. Крім того, не було зменшення кількості білка CPT1A в печінці. Ми підозрюємо, що зниження активності CPT1 та CPT2 може бути вторинним щодо накопичення DHAP та/або нейтрального жиру в цитоплазмі. Відомо, що малоніл CoA, проміжний продукт у біосинтезі жирних кислот de novo та подовженні жирних кислот, алостерично пригнічує CPT. 13
Діагностика дефіциту GPD1 мала значний вплив на ведення пацієнта. Трансплантація печінки, яку раніше розглядали, не рекомендувалася після молекулярної діагностики. Це частково базувалося на результатах у пацієнтів з мутацією GPD1. 2 Найстарішому пацієнту з когорти мутантів, що несли сплайси GPD1, з Близького Сходу було 23 роки і протікало безсимптомно. Крім того, у восьми з десяти постраждалих пацієнтів рівень тригліцеридів з часом знижувався.
На закінчення, дефіцит GPD1 - це дефект у глюкозних та ліпідних шляхах, пов’язаний із важкою гіпертригліцеридемією та NASH. WES поставив діагноз у цьому випадку, коли великі клінічні випробування не виявили причини. Молекулярна діагностика надавала родинам попередню інформацію та керувала клінічним управлінням. Незважаючи на те, що в даний час розвиток доцільний, цей пацієнт потребуватиме пильного моніторингу, оскільки дефіцит GPD1 може перешкоджати маятнику гліцерину фосфату і не дозволяє певним клітинам отримувати всю свою енергію від гліколізу, особливо в клітинах мозку, на які не покладаються повністю. розчин малату та аспартату для доставки цитозольних відновлюючих еквівалентів до матриксу мітохондрій.
- Дієтична сіль призводить до прогресування РС до хвороби 2021
- Elle Що спричиняє це і чому воно потребує негайного лікування - Ygeia 2021
- Гепатомегалія, викликає збільшення печінки - Хвороби 2021
- Ена та її коханка вбили свого сина († 9) Після того, як вдарили ножем, вони захотіли його смажити на грилі!
- Лікувальна вода Ференца Йожефа з глаубером та гарячою сіллю 700 мл