предметів
реферат
Зміни мікрофлори кишечника відіграють ключову роль у фізіології та метаболізмі господаря; проте молекулярні шляхи, що лежать в основі цих змін ожиріння, спричиненого дієтою, незрозумілі. Механістична ціль сигнального шляху рапаміцину (mTOR) пов’язана з порушеннями обміну речовин, такими як ожиріння та діабет 2 типу (T2D). Тому ми досліджували, чи викликані дієтою зміни регуляції передачі сигналів mTOR (дієта з високим вмістом жиру [HFD] або дієта, що харчується дієтою) та/або терапевтичні засоби (ресвератрол [специфічний інгібітор комплексу mTOR 1)] чи рапаміцин [інгібітор обох комплекси mTOR 1 та 2])) змінили склад кишкової мікрофлори у мишей. Пероральне введення ресвератролу запобігало непереносимості глюкози та накопиченню жиру у мишей, що годувались HFD, тоді як рапаміцин значно погіршував толерантність до глюкози та запалення кишечника. Рівень лактококів, Clostridium XI, Oscillibacter та Hydrogenoanaerobacterium збільшився в умовах HFD; однак чисельність цих видів зменшилася після обробки ресвератролом. На відміну від них, кількість некласифікованих Marinilabiliaceae та Turicibacter зменшилась у відповідь на HFD або рапаміцин. У сукупності ці результати показали, що зміни у складі мікробіозу кишечника, викликані змінами активності mTOR, корелюють із фенотипами ожиріння та діабету.
Ожиріння є основним фактором ризику різних хронічних захворювань, включаючи діабет 2 типу (T2D), серцево-судинні захворювання, гіпертонію, неалкогольну жирову хворобу печінки та рак 1. Основною причиною ожиріння є дисбаланс між споживанням енергії з їжею та енергетичними витратами через базальний обмін речовин, фізичну активність та термогенез 2. Оскільки на базальний метаболізм (BMR) припадає приблизно 60-75% загальних витрат енергії 2, низький BMR на одиницю маси тіла є одним із факторів ризику ожиріння 3. Крім того, на енергетичний баланс впливають складні взаємодії між генетичними, екологічними та психосоціальними факторами 4. Що стосується споживання енергії, зміни моторики шлунково-кишкового тракту (ШКТ) сприяють ожирінню, регулюючи не тільки ефективність травлення, але також апетит і ситість 5. Цікаво, що останні дослідження показують, що мікрофлора кишечника відіграє важливу роль у збиранні енергії та ожирінні завдяки взаємодії з моторикою ШКТ 6, 7 .
Тут ми досліджували вплив ресвератролу та рапаміцину на сигналізацію mTOR, експресію метаболічних маркерів та склад мікрофлори кишечника як у нормальних, так і у мишей DIO. Результати показують, що ресвератрол і рапаміцин мають значний вплив не тільки на сигнальну активність mTOR та експресію метаболічних маркерів, але і на склад мікрофлори кишечника, що дозволяє припустити, що конкретні мікробні групи корелюють з патофізіологічними фенотипами, пов’язаними з ожирінням та T2D.
результат
Ресвератрол, але не рапаміцин, полегшує ожиріння, спричинене ВЧР
Як і слід було очікувати, маса тіла (ЧБ) і запас жиру у мишей, яких годували HFD, були вищими, ніж у мишей, які годувались нормальним харчуванням (НИЗ) (P 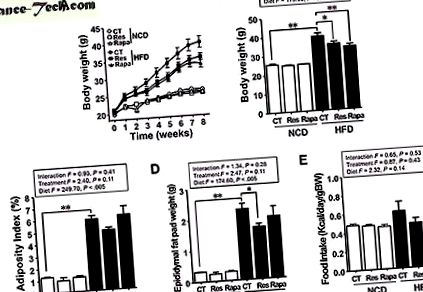
( A, B ) Рівні глюкози в крові (повторне вимірювання двостороннього ANOVA після пост-тесту Бонферроні, F = 13, 88; P * P ** P # P ## P * P ** P * P ** P 24 і довжина товстої кишки. Концентрація Кал LCN-2 у мишей HFD-CT був значно вищим, ніж концентрація у мишей NCD-CT (P
Спільноти бактерій групували, використовуючи незважений аналіз на відстані UniFrac (PCoA). ( A ) Основна координата (ПК) 1 проти РС2 та ( B ) PC1 проти PC3. Відсоток відхилення в графічному ПК позначений по осях. ( C. ) Гістограми, що показують відносну частоту (%) різних родів бактерій у різних дієтичних та лікувальних групах. Кожна група мишей представлена різним символом або стовпчиком на осі x графіку, і кожна пляма або стовпець вказує один зразок (n = 5 на групу).
Повнорозмірне зображення
Істотні відмінності у відносному представництві кишкових бактерій у різних групах харчування та лікування. Ефект ( A, B ) ресвератрол або ( C, D ) рапаміцин для відносної кількості 7 або 10 родів бактерій та ієрархічний кластерний аналіз цих бактеріальних профілів на основі відстаней Манхеттена були досліджені у мишей, які отримували NCD та HFD. Дані виражаються як середнє значення ± SEM (n = 5 на групу). Значення F та p отримані з двостороннього ANOVA після тесту Bonferroni post hoc (Додаткова таблиця S2). * P ** P # P ## P
Коефіцієнти кореляції Пірсона включають карти, що показують зв'язок між метаболічними маркерами та рядом конкретних родів бактерій після ( A ) ресвератрол або ( B ) лікування рапаміцином. Через велику кількість проведених кореляційних тестів було використано поріг значущості Р 14. Оскільки метформін є ключовим регулятором передачі сигналів mTOR, це дослідження досліджувало, чи включають механізми, що лежать в основі метаболізму енергії центрального господаря, які контролюються диференціальною регуляцією шляху mTOR, зміною складу кишкової мікрофлори.
На закінчення результати, наведені в цьому документі, показують, що зміни у складі мікрофлори кишечника внаслідок лікування ресвератролом та рапаміцином корелюють із змінами BW, запасом жиру, резистентністю до інсуліну та запаленням кишечника у мишей DIO. Хоча ідентичність конкретних молекул, пов'язаних з HFD, які збагачують або зменшують певні кишкові мікробні популяції, ще залишається визначити, сигналізація mTOR, схоже, є ключовим компонентом регулювання складу кишкової мікрофлори у мишей DIO.
методи
Відбір проб
Зразки стільця були зібрані щойно після 8 тижнів обробки ресвератролом або рапаміцином, а потім зберігалися при -80 ° C. Наприкінці періоду лікування мишей знеболювали ізофлураном (2-хлор-2- (дифторметокси) -1,1, 1-трифтор-етан) після ночі голодування (16 годин). Зразки печінки, кишечника, придатків епідидимуму та крові швидко збирали, короткочасно промивали в PBS і зберігали при -80 ° C до обробки. Епідидимальні жирові прокладки зважували для розрахунку ШІ (г епідидимальних жирових прокладок/г BW-100). Сироватку відбирали з крові за допомогою пробірок Microtrainer® (BD, Franklin Lakes, NJ) для аналізу інсуліну.
Аналіз гомеостазу глюкози
ГТТ або ІТТ проводили в кінці періоду лікування. Миші, яких годували протягом ночі, отримували навантаження глюкозою (1,5 г/кг маси тіла) шляхом перорального введення або інсуліну (0,75 ОД/кг маси тіла) шляхом внутрішньочеревної ін’єкції. Вимірювач рівня глюкози в крові (Accu-Check Performa, Roche) використовувався для вимірювання рівня глюкози в крові до та після введення глюкози або інсуліну. Для обчислення QUICKI та K ITT було використано оновлену оцінку гомеостатичної моделі (HOMA2), яка включає HOMA2-IR (резистентність до інсуліну), HOMA2-% B (функція бета-клітин підшлункової залози) та HOMA2-% S (чутливість до інсуліну), такі як описані. раніше 23, 46, 47. Модель HOMA2 була розрахована з використанням рівня глюкози натощак та рівня інсуліну натще, виміряних перед жертвою та перед введенням глюкози в GTT.
Імуноферментний аналіз
Для оцінки активації як сигнальних комплексів mTORC1, так і 2, зразки печінки досліджували за допомогою набору для аналізу параметрів cAMP (миша/щур) (R&D Systems Inc., Міннеаполіс, Міннесота) для рівнів клітин cAMP та набори сендвіч-методів ELISA PathScan (технологія клітинної сигналізації), Беверлі, Массачусетс) для загального S6, фосфорильованого S6 (Ser235/236) та загального Akt та фосфорильованого Akt1 (Ser473). Для вивчення фосфорилювання Akt1 за 10 хвилин до забору крові вводили 0,5 одиниці інсуліну на кг маси тіла. Концентрації інсуліну в сироватці крові вимірювали за допомогою набору інсуліну ELISA AKRIN-011T (Shibayagi, Gunma, Японія). Для визначення кишкового запалення вимірювали рівні LCN-2 у фекаліях, використовуючи набір Quantikine ELISA від Lipocalin-2/NGAL (R&D Systems Inc., Міннеаполіс, Міннесота), як описано Chassaing et al. 24. Всі ІФА проводили згідно з протоколами виробника.
Вилучення ДНК, бактеріальна ампліфікація гена 16S рРНК та 454 піросеквенування
Метагеномну ДНК витягували із зразків калу (0,02 г на зразок), використовуючи метод повторного подрібнення гранул плюс колонку, як описано вище 14. Гіпер-варіабельні ділянки V1 та V2 бактеріального гена 16S рРНК ампліфікували з кожної екстрагованої проби ДНК за допомогою праймерів штрих-коду 14. П'ять повторюваних продуктів ПЛР на зразок об'єднували та очищали за допомогою набору для очищення ПЛР QIAquick (Qiagen, Валенсія, Каліфорнія). Об’єднану ДНК секвенували за допомогою піросеквенування титану 454 GS FLX (Roche 454 Life Sciences, Бранфорд, КТ). Секвенування проводили за допомогою Macrogen (Сеул, Корея).
Аналіз послідовностей бактеріальних генів 16S рРНК та порівняння спільнот
Статистичний аналіз
Дані були виражені як середнє значення ± SEM. Всі статистичні аналізи та коефіцієнти кореляції Пірсона проводили за допомогою програмного забезпечення GraphPad Prism (версія 6.0; GraphPad Software, SD, США). Карти коефіцієнта кореляції Пірсона теплові карти були візуалізовані з використанням Excel та PowerPoint (версія 2010; Microsoft Corporation, WA, США). В експериментах, що порівнювали декілька груп, відмінності аналізували двостороннім методом ANOVA з подальшим тестом Bonferroni post-hoc. GTT та ITT аналізували, використовуючи повторні виміри двостороннього ANOVA з часом та групою як джерелами варіацій. Значення P * P ** P
