Резюме
Мета:
Інгібування ангіотензинперетворюючого ферменту (АПФ) може зменшити масу тіла мишей, які утримуються на дієті з високим вмістом жиру. У цьому дослідженні вивчався вплив інгібітора АПФ, каптоприлу (CAP), на зміну ожиріння, спричиненого дієтою (DIO), інсулінорезистентність та запалення у мишей.
Матеріали і методи:
DIO отримували у самців мишей C57BL/6J (n = 30), утримуючи тварин на дієті з високим вмістом жиру (із масою жиру 21% жиру) протягом 12 тижнів. Протягом наступного 12-тижневого періоду лікування тваринам дозволявся доступ до жирної дієти та води, що містить CAP (0,05 мг мл-1) або звичайної водопровідної води (CON, контроль).
Результати:
З першого тижня лікування споживання їжі та маса тіла зменшились у мишей, які отримували CAP, порівняно з мишами CON. Як периферична чутливість до інсуліну, так і печінкова інсулінова чутливість були покращені у мишей, які отримували CAP, порівняно з мишами CON. У мишей, оброблених САП, зменшилась абсолютна та відносна вага печінки та епідидимального жиру порівняно з мишами CON. Миші, оброблені САП, мали більш високий адипонектин у плазмі крові та нижчий рівень лептину в плазмі, ніж миші CON. Порівняно з мишами CON, у мишей, які отримували CAP, спостерігалося зменшення білка 1 хемоаттрактанта моноцитів скелета та жирової мускулатури (MCP-1), жирового інтерлейкіну-6 (IL-6), рецептора 4, подібного до даного миття (TLR4), та незв'язаного білка 2 ( UCP2) вираження мРНК. Крім того, миші, які отримували CAP, збільшували активований пероксизомою проліфератор γ-коактиватор-1α (PGC-1α), довголанцюгову ацил-CoA-дегідрогеназу (LCAD), гормоночутливу ліпазу (HSL) та ліпазу. Знижений ліпопротеїн (LPL). . печінку.
Завершення:
Результати поточного дослідження вказують на те, що у мишей, які страждали на ДІО, лікування CAP зменшувало споживання їжі та масу тіла, покращувало чутливість до інсуліну та знижувало експресію мРНК на запальні маркери. Таким чином, САП може бути життєздатним засобом лікування ожиріння, інсулінорезистентності та запалення.
Вступ
Ожиріння стає основною епідемією 21 століття, головним чином у розвинених країнах, хоча зараз воно визнане у всьому світі. Приблизно 1,6 мільярда дорослих у всьому світі мають надлишкову вагу, а 400 мільйонів відповідають критеріям ожиріння. 1 Ожиріння пов'язане з низкою інших захворювань, включаючи діабет 2 типу, серцево-судинні захворювання та деякі типи раку. 2 Поширеною ланкою є хронічне системне запалення. У худих особин адипоцити виділяють незапальні або протизапальні фактори, такі як інтерлейкін (IL) -10 або IL-13, або сенсибілізуючі інсулін фактори. 3 Оскільки люди страждають ожирінням, макрофаги починають накопичуватися в жировій тканині і призводити до місцевого запалення. Зі збільшенням ожиріння в жировій тканині утворюються різні прозапальні фактори. Насправді жирова тканина особин, що страждають ожирінням, демонструє вищу експресію прозапальних білків, включаючи IL-6, фактор некрозу пухлини-α (TNFα) та білок-хемоаттрактант моноцитів-1 (MCP-1), порівняно з особинами. Чотири. П’ять
Хронічна активація внутрішньоклітинних прозапальних шляхів у клітинах-мішенях інсуліну може призвести до інсулінорезистентності, пов’язаної з ожирінням. 6 Активація макрофагів, пов’язана з ожирінням, призводить до збільшення продукції прозапальних медіаторів, таких як TNFα, IL-1β та резистин, які діють на адипоцити, індукуючи стан інсулінорезистентності. 7 Крім того, негативні кореляційні зв'язки, що спостерігаються між TNFα та ліпопротеїнами високої щільності, концентрацією глікозильованого гемоглобіну та інсуліну в сироватці крові, пояснюють, чому ішемічна хвороба серця частіше зустрічається у пацієнтів із ожирінням порівняно зі здоровими або худими суб'єктами. 8
Інгібітори ангіотензинперетворюючого ферменту (АПФ) широко використовуються як лікування первинної гіпертензії. Інгібітори АПФ пригнічують утворення ANG-II і, отже, знижують кров'яний і венозний тиск. 19 Дії інгібування АПФ виходять за рамки регуляції артеріального тиску, і про покращення активності інсуліну у всьому тілі повідомлялося на численних моделях гризурів, стійких до інсуліну, після лікування АПФ. 20, 21 Крім того, інгібітори АПФ або блокатори рецепторів ангіотензину зменшують як масу тіла, так і жир. 22, 23 Показано, що інгібітор АПФ каптоприл (CAP) запобігає розвитку ожиріння у гризунів, які харчуються дієтою з високим вмістом жиру, 22, 24, хоча механізми залишаються невирішеними. Нещодавно припускали, що антиоксидантні та протизапальні властивості PAC можуть сприяти поліпшенню маси тіла. 25
Результати
Вага тіла, склад тіла та споживання рідини та їжі.
Через 12 тижнів на дієті з високим вмістом жиру, самців мишей C57BL/6J випадковим чином розподіляли до групи CON або CAP. Вага тіла при рандомізації не відрізнявся (рис. 1а). Аналіз даних маси тіла за допомогою двосторонніх повторних вимірювань ANOVA показав значну взаємодію між групою та часом (F (12, 324) = 30, 892, P 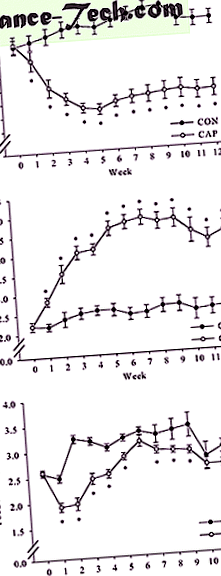
( до ) Вплив CAP на масу тіла. Дві групи самців мишей C57BL/6J (n = 15/група) годувались дієтою з високим вмістом жиру протягом 12 тижнів і отримували воду (CON) або CAP ще 12 тижнів. Результати виражаються як середнє значення ± sem в g (n = 15) (* P * P * P
( до ) Вплив CAP на GTT. Значення виражаються в ммоль l -1 як середнє значення ± sem (n = 15) (* P -1 як значення ± sem (n = 15) (* P -1 проти CAP: 21,00 ± 2,21 мкг мл -1, t 22df = 5,20373, P −1 проти CAP: 14,63 ± 2,37 нг мл −1, t 23df = −5.40193, P
( до ) Вплив PAC на рівні адипонектину в плазмі крові. Результати виражаються як середнє значення ± sem в мкг мл -1 (n = 15) (* P -1 (n = 15) (* P -1 (n = 15). CAP, каптоприл; FA, жирна кислота; NEFA, Нестерифікований ФА.
Повнорозмірне зображення
Існувала дуже висока кореляція між концентрацією лептину в плазмі та жировою масою придатка яєчка (рис. 4а, r = 0,924, Р
( до ) Співвідношення між епідидимальним жиром та концентрацією лептину в плазмі крові в CON (відкриті кола) та групи, які отримували CAP (закриті кола). ( b ) Кореляція між вмістом епідидимального жиру та концентрацією адипонектину в плазмі крові в CON (відкриті кола) та в групах, які отримували CAP (закриті кола). ( c ) Кореляція між концентрацією лептину в плазмі та концентрацією адипонектину в плазмі крові в групах CON (відкриті кола) та CAP (закриті кола). CAP, каптоприл; З, контроль.
Повнорозмірне зображення
МРНК з жирової тканини
Як показано на малюнку 5а, експресія мРНК для лептину (t 25df = -3,28455, P
( до ) Вплив CAP на лептин, адипонектин, IL-6, MCP-1, UCP2, TLR4, PPARγ, PGC-1α, D9D/SCD1 та HSL в жировій тканині. Результати нормалізуються до експресії 28S рибосомної РНК (* P * P * P 24. Поточне дослідження розширило ці висновки: PAC знижував DIO у мишей, і ця втрата ваги зберігалася протягом 12-тижневого періоду лікування. На додаток до цієї втрати ваги, CAP лікування поліпшило периферичну чутливість до інсуліну, як вказує GTT, і знизило швидкість глюконеогенезу в печінці, як свідчить PCT. Більш детальний аналіз тканин жирової та скелетної м’язів показав, що лікування CAP знижувало експресію мРНК на запальні фактори, включаючи MCP-1, IL-6 та TLR4. Крім того, в тканині печінки лікування CAP модифікувало експресію генів, що беруть участь у метаболізмі ліпідів; експресія мРНК для PGC-1α, HSL та LCAD збільшилася, тоді як експресія мРНК для LPL знизилася.
Дванадцять тижнів дієти з високим вмістом жиру призвели до ДІО у мишей C57BL/6J, а подальше лікування ВАР призвело до швидкої втрати ваги. Наприкінці другого тижня маса тіла мишей, оброблених САП, була на 16% нижча, ніж маса мишей, які утримувались лише на дієті з високим вмістом жиру. Ця втрата ваги зберігалася протягом 12 тижнів і була в 3-4 рази більшою, ніж втрата ваги, зафіксована у щурів Лонг-Еванса, які отримували ПДК у дозі 40 мг кг-1 на день протягом 1-2 тижнів. 24 Наскільки нам відомо, CAP не був ефективним у зменшенні маси тіла у людей. Однак у клінічному дослідженні інгібітор АПФ еналаприл знижував вагу у пацієнтів з артеріальною гіпертензією. 27
Споживання рідини мишами, обробленими САП, значно зросло, що узгоджується з попередніми дослідженнями. 22, 31 Це може бути пов’язано із підвищенням рівня брадикініну 44 або посиленням синтезу ANG-II у мозку. 45 Оскільки споживання рідини мишами, обробленими CAP, є високим у порівнянні з CON, зменшення споживання їжі мишами, обробленими CAP, не зумовлене загальним придушенням поведінки CAP. Крім того, ANG-II не впливає на споживання їжі, спричиненої греліном 46, хоча спричиняє значне збільшення споживання рідини. 45 Таким чином, зменшення споживання їжі мишами, обробленими САР, не зумовлене збільшенням споживання рідини.
Раніше було показано, що PAC покращує толерантність до глюкози на різних моделях тварин. Результати 22, 24 GTT показали, що лікування CAP покращило порушення толерантності до глюкози у мишей DIO. Це спостереження забезпечує докази інсулінозалежного поліпшення кліренсу глюкози 47, і, що більш важливо, відбулося у тварин, у яких не було зниженого рівня NEFA. Поліпшення толерантності до глюкози може відбуватися в результаті декількох механізмів. Це могло статися в результаті зменшення вироблення печінкової глюкози внаслідок підвищення рівня циркулюючих адипонектину та/або внаслідок збільшення поглинання глюкози та окислення ФА в скелетних м'язах. 48
Печінкова резистентність до інсуліну є основною причиною діабету типу 2. 49,50 При інсулінорезистентності глюконеогенез печінки зростає. 51 Для визначення швидкості глюконеогенезу в печінці проводили РСТ. Результати РСТ показали, що у мишей, які отримували САР, знижений рівень печінкового глюконеогенезу порівняно з групою CON. Отже, результати GTT показують, що PAC покращує інсулінозалежний кліренс глюкози, вказуючи на кращу периферичну чутливість до інсуліну, а результати РСТ показують, що PAC специфічно інгібує печінковий глюконеогенез, вказуючи на кращу чутливість до інсуліну печінки.
IL-6 викликає печінкову резистентність до інсуліну, інгібуючи передачу сигналів рецепторів інсуліну та збільшуючи деградацію субстрату 1 рецептора інсуліну. Показано, що TLR4 активує внутрішньоклітинні запальні шляхи, що залучають NF-κB, що регулює печінкову резистентність до інсуліну, 54 та UCP2, який, як було показано, є негативним регулятором секреції інсуліну. 55 Сучасне дослідження показує зниження експресії мРНК для генів IL-6, TLR4 та UCP2 у жировій тканині мишей, які отримували CAP, порівняно з такою для групи CON. Отже, поточні результати показують, що CAP може покращити чутливість до інсуліну, але для виявлення механізмів, що виникають, потрібна додаткова робота.
Підсумовуючи, CAP знизив DIO у мишей, покращив толерантність до глюкози та зменшив експресію мРНК для запальних маркерів. Зниження маси тіла пов’язане зі зменшенням накопичення жиру в жировій тканині та тканинах печінки. Підвищений рівень адипонектину та знижена експресія мРНК для UCP2 могли сприяти поліпшенню чутливості до інсуліну. Зменшення експресії мРНК для MCP-1, IL-6 та TLR4 могло призвести до зменшення запальної реакції. Таким чином, результати поточного дослідження свідчать про те, що САР може бути перспективним інструментом для скасування ДІО, поліпшення чутливості до інсуліну та зменшення запалення.
- Тип харчування немовляти впливає на ожиріння дитини CuidatePlus
- Вплив дієти на серцево-судинні захворювання, діабет та ожиріння
- Включення яблука в раціон харчування дітей знижує ризик ожиріння
- Вплив ожиріння та дієти на шкіру псоріазу
- Цифрове ожиріння загрожує нашому самопочуттю. Давайте змінимо дієту HuffPost Life
