- предметів
- реферат
- вступ
- Загальнохромосомна репресія гена та епігенетична модифікація Xi
- Механізм приглушення некодуючих генів Xist РНК
- Регулювання процесу інактивації X
- Збереження та розбіжність інактивації Х у ссавців
- Висновки щодо механізму інактивації X
предметів
- Компенсація дози
- Епігенетика
- Регуляція генів
реферат
Ссавці інактивують одну з двох жіночих Х-хромосом, щоб компенсувати нерівне число X-пов'язаних копій генів між самцями та самками. Цей процес інактивації Х призводить до замовчування однієї Х-хромосоми регульованим розвитком способом. У цій роботі ми розглядаємо останні результати щодо інактивації Х та обговорюємо, як ці досягнення покращують механічне розуміння. Останні результати дають уявлення про те, як клітина підраховує і відбирає відповідну кількість Х-хромосом для інактивації, наприклад, координовану репресію генів у всій хромосомі, і як формується стабільна неактивна Х-хромосома. Ключові компоненти цієї складної регуляторної системи вже визначені та забезпечують вихідні точки для розуміння епігенетичної регуляції у ссавців. Більшість даних були отримані в результаті дослідження на мишах. В даний час незрозуміло, як загалом ці висновки можуть бути застосовані до інших видів ссавців. Ми намагаємось оцінити цей аспект на основі даних, що стали доступними.
У мишей РНК Xist утворюється над негенетичним хроматином ядра X-області хромосом (Chaumeil et al., 2006). Навіть на Xi XIST людини центральна область хромосомної області, яка містить переважно геномні повтори, схоже, перекривається (Clemson et al., 2006). Це свідчить про те, що основними мішенями Xist є не гени, а послідовності в негенетичних областях хромосоми X. У Xi гени розташовані на краю домену Xist, незалежно від того, замовчуються вони чи ні (Clemson et al., 2006). Ситуація на Сі важка. Багато генів на Xi людини та кілька генів на мишачому Xi уникають замовчування генів і експресуються з Xi та активної X-хромосоми (Xa). Що визначає, чи ген замовчується, чи залишається активним на Xi, не зовсім зрозуміло. Останні результати показують, що принаймні один із генів втечі у мишей, Jarid1c, містить елементи, що визначають його активний стан незалежно від його хромосомного положення на Xi (Li and Carrel, 2008). Це свідчить про те, що хромосомні послідовності або властивості генного локусу модулюють вплив, який Xist надає на експресію. Також невідомо, як Xist репресує гени з первинних негенетичних місць зв'язування, хоча отримані докази ядерної компартменталізації (Heard and Bickmore, 2007; Chow and Heard, 2009).
Загальнохромосомна репресія гена та епігенетична модифікація Xi
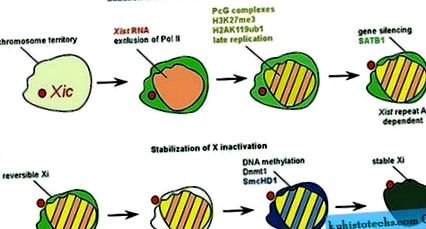
У жіночих соматичних клітинах Xi утворює стабільну гетерохроматичну структуру і може бути візуалізований за допомогою різних технік фарбування. Реактивації гена на гетерохроматичному Xi може бути важко досягти, якщо зміни в долі клітини не будуть викликані під час перепрограмування на ранній ембріональний тип (Takagi et al., 1983). Реактивація неактивного Х спостерігалася під час генерування індукованих плюрипотентних стовбурових клітин із жіночих соматичних клітин миші (Maherali et al., 2007). Спроби блокувати визначені епігенетичні шляхи в соматичних клітинах, включаючи деацетилювання гістону та метилювання ДНК, досягли часткової реактивації Xi у невеликій кількості клітин (Csankovszki et al., 2001). Це призвело до висновку, що замовчування генів на Xi опосередковується низкою епігенетичних факторів, які працюють разом, щоб підтримувати неактивний стан хромосоми. Xi зазнає декількох модифікацій і збагачується факторами, пов'язаними з тихим хроматином (рис. 1). Таким фактором є варіант гістону macroH2A, який розподіляється майже рівномірно по Xi в соматичних клітинах (Mietton et al., 2009). Це може припустити, що після досягнення стабільної інактивації гени та негенетичні послідовності охоплюються подібними епігенетичними модифікаціями до Xi.
Повнорозмірне зображення
Склад хроматину Xi суттєво відрізняється від складу інших хромосом у соматичних клітинах. Xi збагачений кількома модифікаціями гістонів, такими як метилювання гістону Н3 лізину 27 та убіквітинація гістону H2A (Plath et al., 2003; de Napoles et al., 2004; Fang et al., 2004). Це відбувається паралельно з набором комплексів Polycomb (рис. 1а), які, як було показано, каталізують ці модифікації гістонів (Plath et al., 2004). Крім того, гістон Н4 гіпоацетилирован, а ди- та триметилювання гістону Н3 лізином 4 сильно знижується до Xi (Chaumeil et al., 2002). Ці модифікації гістонів, як правило, корелюють з експресією генів, і відновлення цих модифікацій хроматину до Xi можна інтерпретувати як наслідок його транскрипційної неактивності. Потрібно охарактеризувати функції білків Polycomb та модифікацій гістонів, а також інших компонентів Xi, до складу яких входить варіант гістону macroH2A, а також білок ядерної ескізи SAF-A (Fackelmayer, 2005). Сучасна точка зору полягає в тому, що кілька хроматинових маркерів сприяють підтримці репресії на Xi (Csankovszki et al., 2001; Hernandez-Munoz et al., 2005).
Механізм мовчання генів, що не належать до Xist РНК
Інактивація Х зазвичай ініціюється під час раннього ембріогенезу у мишей. Перетворення активної речовини в транскрипційно мовчазну Х-хромосому спостерігається також при диференціюванні мишачих ембріональних стовбурових клітин. Це забезпечує потужну систему культури клітин для вивчення механізму мовчання в хромосомі (Payer and Lee, 2008). Інактивація індукується накопиченням Xist РНК у майбутньому Xi. Для пригнічення генів необхідна збережена послідовність на 5 'Xist, яка називається повторенням A (Wutz et al., 2002). Експресія Xist без повторення A не викликає репресії генів, але призводить до локалізації Xist і рекрутування більшості модифікацій хроматину до Xi (Chaumeil et al., 2006). Вважається, що мотив РНК, що повторюється, складається в структуру петлі стовбура, яка може функціонувати як ділянка зв'язування для мовчальних факторів (Wutz et al., 2002). Нещодавно структуру повтору АРНК також досліджували експериментально (Duszczyk et al., 2008). Це дослідження підтвердило першу стовбурову петлю з подальшим висновком, що мотив РНК може димеризуватися через послідовність, попередньо призначену для формування другої петлі. Делеція повтору A у мишей також виявила функцію репресії антисмислового гена Tsix у Xi, що передбачає додаткові функції для області A-повтору в регуляції інактивації X (Hoki et al., 2009).
Ксисту-репресія гена в хромосомі обмежена певними типами клітин. Зазвичай інактивація X ініціюється в ранніх ембріональних клітинах. Крім того, було показано, що конкретні попередники в системі крові мають відповідний клітинний контекст для ініціювання мовчання (Savarese et al., 2006). Це було продемонстровано експериментами з використанням індуцибельної експресійної системи для активації Xist у мишей-самців. Експресія XIST може також спричинити репресію генів у деяких соматичних клітинних лініях людини з різним ступенем модифікації хроматину (Chow et al., 2007). Нещодавно було показано, що Xist може ініціювати приглушення хромосом у пухлинних клітинах, отриманих від лімфоми миші (Agrelo et al., 2009). Цей висновок піднімає питання про те, чи можуть епігенетичні шляхи, як правило, активні під час інактивації Х в ембріоні, бути доступними для пухлинних клітин і чи сприяють ці шляхи пухлинному розвитку.
Регулювання процесу інактивації X
Регулювання інактивації X. a ) Інактивація ініціюється контрольованим шляхом розвитку. Усі хромосоми, крім одного Х, інактивовані в диплоїдній клітині. В даний час існує думка, що це досягається регулюванням виразу Xist. Елементи регулювання Xist утворюють область Xic. На початку інактивації Х, вважається, що трансхромосомне сполучення областей Xic викликає експресію Xist однієї Х-хромосоми. Це призводить до замовчування генів у всій хромосомі та утворення Xi. ( b ) Елементи, що регулюють експресію Xist в Xic, включають некодируемую розшифровку Tsix (зелена). Tsix транскрибується в антисмисловій орієнтації і перекриває блок транскрипції Xist і пригнічує експресію Xist. У межах Xic було виявлено кілька сайтів прив'язки жовтня 4 (червоні кола), які опосередковують репресію Xist у режимах, залежних від Tsix та Tsix. CTCF також бере участь у експресії Tsix та поєднанні Xic .
Повнорозмірне зображення
У мишей експресія Xist пригнічується антисмисловою РНК Tsix (рис. 2b). Блок транскрипції Tsix перекриває Xist, створюючи антисмислову пару. Це антисмислове сполучення Xist-Tsix породило ідею про можливу участь дволанцюжкової РНК, яку Dicer міг переробити в невеликі РНК. Дійсно, ці невеликі РНК були знайдені в недавньому дослідженні (Ogawa et al., 2008). Однак всебічний аналіз ембріональних стовбурових клітин показав, що видалення Dicer мало впливає на процес інактивації X, вказуючи на те, що Dicer не відіграє значної ролі в регуляції інактивації X (Kanellopoulou et al., 2009). Делеція Dicera, здається, дерегулює процеси обробки ендогенних мікроРНК, що призводить до втрати метилювання ДНК і, таким чином, впливає на інактивацію X (Нестерова та ін., 2008). Ці дані узгоджуються з непрямим впливом Dicer на інактивацію X, і проблема дволанцюжкової РНК при інактивації X залишає відкритим подальше дослідження.
Фактор транскрипції стовбурових клітин Oct4 нещодавно був залучений до регуляції експресії Xist у мишей (Navarro et al., 2008; Donohoe et al., 2009). Було показано, що жовтень 4 пов'язує послідовності ДНК всередині Xist-інтрону 1 та навколо послідовностей промотору та енхансеру Tsix (рис. 2b). Повідомляється, що жовтень 4 є посередником репресій проти Xist у режимах, залежних від Tsix та Tsix. Таким чином, експресія жовтня 4 може обмежити регуляцію Xista до настання інактивації X. Однак Oct4 також експресується на високому рівні разом із Xista у клітинних лініях, відмінних від ембріональних стовбурових клітин миші, включаючи стовбурові клітини, отримані з епібластів миші (Navarro та Avner, 2009). Тому вираз жовтня 4 навряд чи може бути єдиним фактором, що визначає регулювання Xista, і ще один рівень контролю може чекати відкриття.
Збереження та розбіжність інактивації Х у ссавців
Висновки щодо механізму інактивації X
Випадкова інактивація Х розвинулася виключно у плацентарних ссавців. Це говорить про те, що система компенсації дози покладається на процеси, які більшою мірою опосередковують регуляцію генів у хребетних. Помітним винятком є некодуючі Xist РНК та регуляторні послідовності Xic. Вони були спеціально розроблені для компенсації дози. Є також дані, що розвиток регуляторних елементів не зупинився і може мати місце навіть у сучасних ссавців. Регуляція інактивації Х включає хромосомне спарювання та антисенсове пригнічення. Комплекси Tsix, CTCF, Oct4 та Polycomb були задіяні як молекулярні гравці в цьому процесі. Мовчання у всій хромосомі індукується некодуючою Xist РНК, і, схоже, це багатоетапний процес. Xist і SATB1 діють, щоб ініціювати пригнічення генів, а SmcHD1 і метилювання ДНК відіграють вирішальну роль у підтримці репресії Xi. Полікомбні комплекси беруть участь у мовчанні всієї Х-хромосоми, але їх точну функцію потрібно дослідити.
Цілі Xist щодо хромосоми залишаються невідомими. У кількох дослідженнях було запропоновано роль геномних повторень та негенетичної ДНК в інактивації X. Гени та негенетичний хроматин просторово розділені на Xi. Спостереження, що Xist перекриває багаторазовий багатий центр області Х-хромосом, свідчить про те, що негенетичний хроматин може бути основною мішенню Xist. Це відкриває думку про те, що інактивація X може прийняти вже існуючий механізм багаторазового затемнення елементів. Геномні повтори включають залишки рухливих генетичних елементів, які вторглися в геном і згодом були інактивовані. Сюди входить розробка захисних механізмів господаря. Чи може неактивний Х бути результатом контрольованого залучення стратегій захисту господаря, що індукується експресією Xista? Було висловлено припущення, що елементи з довгим розсіяним повторенням (LINE) виконують функцію розповсюдження інактивації X. Нещодавно X інактивацію порівнювали у ссавців, у яких розповсюдження LINE припинилося. Ці дані вказують на те, що LINE-посилення не обов'язково потрібно для інактивації X, що свідчить про те, що інші типи елементів можуть зіграти подібну роль у інактивації X (Cantrell et al., 2009).
Досягнення розуміння інактивації X породило нові та більш чіткі питання. Потрібно визначити фактори, що опосередковують трансхромосомні взаємодії під час сполучення Xic-Xic на початку інактивації X. Робота над взаємодією 4 жовтня та терміни розвитку інактивації X представляється перспективною для виявлення регуляторної мережі, яка пов’язана з біологією стовбурових клітин клітини. Ключовим бракуючим елементом у розумінні шляху приглушення генів є зв'язок між повторенням SATB1 та Xist A. Відповіді на ці запитання не лише сприятимуть нашому розумінню компенсації дози ссавців, але також дадуть розуміння основних ядерних процесів епігенетичної регуляції ссавців.