Резюме
Цей рукопис містить протоколи, які використовують внутрішньоутробну електропорацію (SUI) для опису структурної зв’язаності нейронів на рівні одиничної клітини та збудливості флуоресцентно мічених нейронів. Гістологія використовується для характеристики дендритних та аксональних проекцій. Запис цілих клітин на гострі зрізи використовується для дослідження збудливості.
Анотація
Нервова система складається з величезного ряду різних типів нейронів. Ці нейронні субпопуляції характеризуються, серед інших характеристик, їх чіткими дендритними морфологіями, їх специфічними моделями аксональних зв’язків та їх вибірковою реакцією на стрільбу. Молекулярні та клітинні механізми, що відповідають за ці аспекти диференціації під час розвитку, ще недостатньо вивчені.
Далі ми описуємо комбіновані протоколи для маркування та характеристики структурної зв’язаності та збудливості нейронів кори. Модифікація протоколу внутрішньоутробної електропорації (SUI) дозволяє маркувати розріджену популяцію нейронів. Це, у свою чергу, дозволяє ідентифікувати та контролювати дендрити та аксони окремих нейронів, точну характеристику ламінарного розташування аксональних проекцій та морфометричний аналіз. SUI також може бути використаний для дослідження змін збудливості дикого типу (WT) або генетично модифікованих нейронів шляхом комбінування гострих зрізів із цільноклітинним записом електропорованого мозку. Ці дві методики сприяють кращому розумінню взаємозв’язку структурних та функціональних зв’язків та молекулярних механізмів, які контролюють нейрональне розмаїття під час розвитку. Ці процеси розвитку мають важливе значення для проводки аксонів, функціонального різноманіття нейронів та біології когнітивних розладів.
Вступ
Розвиток дендритних та аксональних структур є важливою стороною регуляції ланцюга в нервовій системі, в тому числі в корі головного мозку. Він відіграє важливу роль під час селективного підключення різних нервових субпопуляцій. Кілька нещодавніх звітів показали, що, крім зв'язку, молекулярне різноманіття нейронів відображається придбанням дуже специфічних режимів стрільби. Однак механізми, що визначають збудливість і зв'язність різних нейрональних підтипів під час розвитку, а також їх ступінь координації, все ще недостатньо вивчені. 1, 2.
Хоча цей протокол описує електропорацію мишей в ембріональний день (Е) 15,5, цей метод можна проводити в будь-якому віці від Е9,5 до 3 днів після пологів (Р) 2 4. На ранніх стадіях Електропорація націлена на нейрони та попередники таламуса та глибоких шарів кори, більш просунута стадія електропорації позначає більше поверхневих шарів (наприклад, нейрони II-III шару E15.5 IUE). Таким чином, поєднання SUI з одноклітинним морфологічним аналізом та електрофізіологією є корисним інструментом для з’ясування молекулярних механізмів, що лежать в основі величезного структурного та функціонального різноманіття нейронів нервової системи.
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Протокол
Усі процедури щодо тварин були затверджені Комісією з питань догляду та зайнятості тварин у Мадриді відповідно до національного та європейського законодавства (PROEX 118/14; PROEX 331/15). Під час процедури підтримуйте стерильні умови.
1. Електропорація внутрішньоутробно
ПРИМІТКА: Цей протокол для SUI є адаптацією інших, які раніше були опубліковані 5, 6, 7. Цей рукопис описує протокол для SUI ембріонів E15.5 зі змінами в стратегії репортерів, що дозволяє вивчати морфологію 8 особин нейрони та їх електрофізіологічні властивості в окремому експерименті із використанням стандартних репортерних плазмід GFP.
2. Підготовка до хірургічного втручання
- Виконайте операцію з виживання за допомогою асептичних процедур. Гарантуйте стерильні умови, такі як маски, рукавички, інструменти та хірургічне поле. Стерилізуйте хірургічні інструменти (скальпель, щипці Адсона, загартовані тонкі ножиці, криволінійні ножиці, щипці Дюмона та голкотримач).
- Виберіть капіляри боросилікатного скла 1/0,58 мм ОД. Переверніть капіляри 3. Орієнтація для оптимальної довжини кінчика 1 см після витягування. Відріжте кінчик голки під кутом 30 ° за допомогою тонких щипців (Малюнок 1B).
- Приготуйте 500 мл стерильного ізотонічного розчину (1x PBS або збалансований сольовий розчин Хенка (HBSS)). Додайте пеніцилін-стрептоміцин 1: 100 і нагрійте цей розчин до 37 ° C. Його можна зберігати при 4 ° C після операції.
- Підшкірно вводять доопераційну дозу знеболюючих засобів (наприклад, карпрофен, 5 мг/кг маси тіла).
- Зберігання тварин у теплі для хірургічного втручання, поміщаючи їх на грілку. Нагрівання чистої клітки до 37 ° C під час післяопераційного відновлення.
- Знеболіть вагітну мишу C57BL/6 E15.5 ізофлураном. Спочатку влийте закриту камеру з 3% ізофлураном в 0,8 л/хв кисню і залиште мишу в приміщенні до сну. Переведіть мишу в теплий компрес і покладіть ніс і рот всередину маски для доставки ізофлурану. Поступово зменшуйте анестезію під час операції до 1,5% ізофлурану через маску. Підтвердьте адекватну анестезію, спостерігаючи втрату педального рефлексу (защемлення пальця ноги). Оптимальна процедура займає приблизно 20 хв і не більше 45 хв.
- Нанесіть очну мазь, щоб запобігти пересиханню очей під час процедури.
- Видаліть волосся з області
3 см від живота (за допомогою електричної бритви або крему для депіляції). Промийте хірургічну зону ватними тампонами, просоченими етанолом, потім ватним тампоном, напоєним йодом. Повторіть три рази.
4. Ін'єкція ДНК та електропорація
5. Кінець операції та після операції
- Використовуйте ватяні палички для маніпуляції з маткою назад у матері. Наповніть черевну порожнину підігрітим сольовим розчином (додайте приблизно 2 мл).
- Зашийте м’яз простими перерваними швами або безперервним швом. Використання шва № 6-0.
- Використовуйте скоби, щоб закрити зовнішню рану. Перед сшиванням подбайте про те, щоб відокремити шкіру від м’яза. Зніміть маску з носа.
- Дайте миші відновитись протягом 30 хвилин у чистому утепленому клітці, перш ніж помістити її в приміщення для тварин. Не залишайте тварину без нагляду, поки вона не прийде до тями, щоб зберегти позицію стернала. Не ставте тварину, яка перенесла операцію, до компанії інших тварин, поки вона повністю не відновиться.
- Наглядайте за твариною протягом наступних днів після операції. Застосовуйте підшкірні знеболюючі засоби (карпрофен, 5 мг/кг маси тіла) кожні 12 годин протягом 2 днів або відповідно до законодавства про тварин. Додатковий післяопераційний догляд за цуценятами не потрібен.
6. Підготовка та аналіз зразків
7. Аналіз зображення та
ПРИМІТКА: Метою цього протоколу є отримання цілісноклітинних записів струмових затисків пірамідних нейронів шару II/III з клітин, візуально ідентифікованих експресією GFP в мозку електропорованих мишей GFP-a (або будь-якого іншого флуоресцентного білка перед електропорацією). . Це адаптація раніше опублікованих методів 17, 18. За допомогою цього протоколу можна вивчити вплив генетичної модифікації, введеної SUI, на електричні властивості нейрона. Придбання специфічних режимів стрільби - це поступовий процес диференціації, що включає динамічну експресію широкого репертуару іонних каналів і що призводить до вираження перехідних режимів стрільби до пізніх постнатальних етапів. Наприклад, зрілі електричні реакції не спостерігаються в шарі II/III соматосенсорної кори миші до P16 2, 19.
- Передумови гострих скибочок
- Підготуйте стерильні хірургічні інструменти для видалення мозку мишей: гільйотину, для видалення голови; маленькі ножиці, щоб розрізати череп; щипці, щоб відокремити череп від тканини; шпатель, щоб обережно видалити мозкову тканину з оболонки; металорізальний верстат для розсікання кори на дві рівні половини; та піпетку Пастера, щоб перемістити зрізи з вібратома (помістіть їх у розчин, що містить штучний ліквор (ACSF) для перевірки, а потім перенесіть зрізи ACSF в зону очікування інкубації).
- Приготуйте 1 л ACSF, використовуючи воду високої чистоти (подвійна дистильована вода), що містить 119 мМ NaCl, 26 мМ NaHCO3, 11 мМ глюкози, 2,5 мМ KCl, 1,2 мМ MgCl 2, 2,5 мМ CaCl 2 і NaH 1 мМ 2 PO 4. Титрують рН до 7,3-7,4 за допомогою HCl або NaOH. Відрегулюйте осмолярність до 290 мОсм.
- Бульбашки ACSF з карбогеном (95% O2/5% CO2) протягом 15 - 20 хв за допомогою тефлонових пробірок (
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Репрезентативні результати
Для детальної характеристики морфологічних змін нейронів та протягом усього розвитку важливо мітити нейрони рідко. Розбавлена система Cre-рекомбінази дозволяє експресувати ген, що цікавить, у невеликій популяції нейронів, так що лише ті нейрони, які включають цей фермент, експресують GFP (Малюнок 1А). З цією стратегією рівень II-III націлений і позначений IUE на рівні E15.5. CAG-DsRed2 при 1 г/л є спільною електропорацією в якості контролю та для ідентифікації позитивного електропорованого мозку у живих тварин. Важливо, що після фарбування антитілами проти GFP сигнал є достатньо сильним, щоб забезпечити чітку візуалізацію їх дендритних морфологій та аксонів. (Малюнок 1D Y І).
Після SUI та електрофізіології аналіз параметрів, отриманих із записів цілих клітин, використовується для порівняння реакцій тригера та збудливості клітин, що піддаються електропорації в різних умовах. Можна отримати різні параметри. Параметри повинні бути адаптовані до конкретного дослідження, використання спеціального програмного забезпечення для аналізу патч-фіксаторів. Малюнок 2С є прикладом графіку потенціалів дії проти вхідного струму, отриманого із записів нейрону шару WT II-III нейрона, який був електропорований при E15.5.
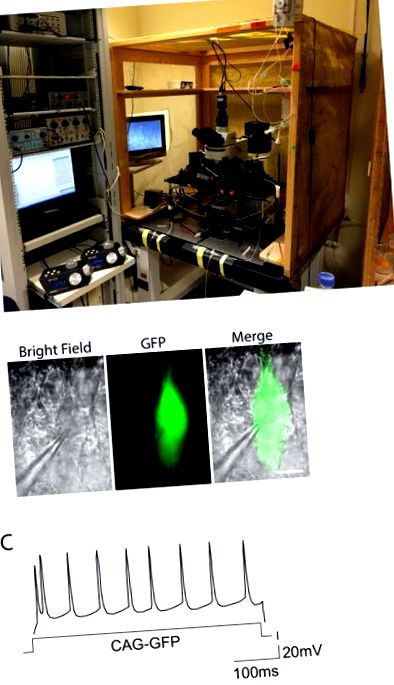
Рисунок 2. Установка електрофізіології та приклад реакції тригера. ДО. На фотографії показана установка, що використовується для експериментів з електрофізіології затискачів з гострими зрізаними зонами. Конфігурація укладена у клітку Фарадея для усунення шуму, а обладнання знаходиться на верхній частині антивібраційного столу. Ліворуч видно моторизовані драйвери мікроманіпуляторів для електродів. B. Пірамідальні нейрони миші, електропоровані із спостережуваним GFP, в умовах яскравого поля та зеленої флуоресценції. Піпетка для запису, приєднана до комірки GFP +, надзвичайна. Шкала шкали = 10 µ м. C. Тригерні схеми CAG-GFP для контролю рівня нейропорації шару електропорації II-III, що показує типову регулярну збагачену реакцію. Розподіл потенціалів дії наближається до регулярного розподілу протягом усього вхідного струму (вісь X). Клацніть тут, щоб переглянути збільшену версію цього малюнка.Етап Напруга Електроди посилання E9.5 7 В, 100 мс, 3 імпульси Платинові електроди прилипають Мацуї та ін. 2011 3 E12.5 30 В, 50 мс, 3 - 5 імпульсів Електроди типу щипців 3 мм Сайто, Т., 2006 12 E15.5 35-48 В, 50 мс, 5 імпульсів Електроди типу щипців 5-7 мм Родрігес-Торнос та ін. 2016 2, Сайто, Т., 2006 12 P2 100 В, 50 мс, 5 імпульсів Електроди типу щипців 5-7 мм Sonego та співавт. 2013 4 Таблиця 1: Умови напруги та електроди для електропорації ембріонів.
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Обговорення
Для успішного проведення SUI рекомендується враховувати певні міркування. Перш за все, важливо виконати операцію менш ніж за 30 хвилин, щоб зменшити стрес на матір та збільшити шанси на виживання нащадків. По-друге, найскладнішою частиною процедури є ін’єкція ДНК, щоб зробити ін’єкцію через боросилікатні капіляри якомога плавніше. Якщо на ембріони натискати занадто сильно, їм можна нашкодити. Що стосується усунення несправностей загибелі ембріона під час ін’єкцій ДНК, скошування кінчика під кутом 30 ° може підвищити ефективність цього підходу. Якщо фаска не доступна, а капіляри розрізані лише щипцями, правильний кут можна підтвердити за допомогою розсікаючого мікроскопа. Викиньте непридатні капіляри. Нарешті, адаптація умов електропорації до стадії ембріона є важливою для збільшення рівня виживання (див Таблиця 1).
Необхідні деякі міркування щодо відновлення аксонів та дендритів. Для позначення окремих нейронів необхідні адекватні концентрації плазміди Cre, щоб отримати хорошу, розріджену експресію та уникнути плутаного перекриття нейрональних проекцій, що належать до різних нейронів. Хоча цей протокол пропонує використання 4 нг/л, може знадобитися регулювати концентрацію плазміди для кожного експерименту, залежно від використовуваного промотору, якості препарату ДНК та методу кількісного визначення ДНК (наприклад, зменшити при 2 нг/л, якщо маркування занадто багато нейронів). додатково вперед, для відстеження аксонів важливо вирізати під відповідним кутом, щоб весь нейрон знаходився в одній площині.
Найважливішими кроками для успішного запису пластир-затискачів є здоров'я тканин гострих зрізів, а також розташування та велика кількість електропорованих GFP-позитивних нейронів. Якщо кроки виправлення не вдаються або під час записів зустрічаються відхилені відповіді, скоротіть час на обробку гострих фрагментів. Якщо нейрони GFP важко ідентифікувати та локалізувати через їх зменшену кількість гострих зрізів, переконайтеся, що достатня кількість плазміди CAG-GFP включена в суміш електропорації. Що стосується основних обмежень підходів, описаних у цьому документі, техніка затискання патча дозволяє реєструвати безліч різних параметрів, що описують збудливість нейрона, але не оцінює аспекти, які залежать від усієї схеми. Крім того, і, як вже зазначалося, не всі субпопуляції нейронів доступні через SUI. Таким чином, THfuturo e, ці методи можуть сприяти подальшому аналізу структурної та функціональної зв'язків різних нейрональних субпопуляцій мозку.
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Розкриття інформації
Автори заявляють, що не мають конфлікту інтересів.
Подяка
Ми дуже вдячні Р. Гутьєррезу та А. Моралесу за чудову технічну допомогу та Л. А. Вайс за редагування. CGB фінансується Міністерством науки та інновацій Іспанії (MICINN), FPI-BES-2012-056011. Ця робота фінансувалася грантом Фонду BBVA та SAF2014-58598-JIN (MINECO) для М.Наваррете, а також грантом Фонду Рамона Аресеса та грантами SAF2014-52119-R та BFU2014-55738-Redt (від MINECO) до М. Нієто.
