Предмети
Резюме
Вступ
Результати
Gas2/HSP90/HSP40 утворюють у клітинах рисової суспензії, пов'язаний з каспазою-3, білковий комплекс під нагріванням
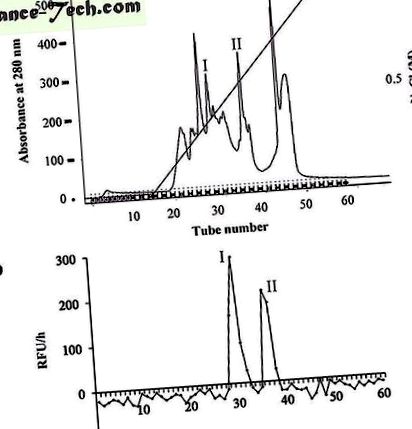
( до ) Активні фракції каспази-3 з колонки G-75 об'єднували і далі очищали на колонці Mono-Q, збалансованій 20 мМ буфером Tris/HCl, рН 8,0. Білки елюювали градієнтом NaCl (0
1 М) у 20 мМ трис/HCl-буфері, рН 8,0, при швидкості потоку 1 мл/хв. Білки виявляли за поглинанням при 280 нм. Піки збирали відповідно. ( b ) Рівну кількість піків, зібраних з колонки Mono-Q, інкубували з Ac-DEVD-AMC. Флуоресценцію AMC вимірювали за допомогою зчитувача мікропланшетів при 30 ° C. RFU/год представляв відносні відмінності одиниці флуоресценції, отримані за 1 год. I і II являють собою піки, які виявляли активність, подібну до каспази-3.
Повнорозмірне зображення
Повний розмір таблиці
Профіль експресії газу 2 під різними напруженнями.
У фізіологічних умовах Gas2 є некаталітичною субодиницею глюкозидази II, яка бере участь у глікозилюванні білків в ER. Для того, щоб визначити біологічні функції Gas2 в умовах абіотичного стресу, експресію Gas2 вимірювали кількісною кількісною ланцюговою реакцією в режимі реального часу за різних умов, навіть при DTT-індукованому стресі ER. Обробка 6,4 мМ DTT індукувала експресію Os bZIP50 34, маркера гена UPR, що вказувало на те, що DTT здатний викликати ER-стрес у клітинах у суспензії рису (рис. 2а), і в цих умовах Gas2 регулювався вниз ( 2б). На додаток до напруги ER, газ2 також регулювався зниженням під різними абіотичними стресами, такими як холодний стрес (рис. 2в), осмотичний (рис. 2г) та сіль (рис. 2д).
( до ) DTT індукував експресію OsbZIP50 у клітинних лініях дикого типу та OsGas2 RNAi. Протопласти готували з клітин у суспензії та обробляли 6,4 мМ DTT протягом 18 годин при 26-28 ° С ( b ) Експресія OsGAS2 у протопластах клітин суспензії при обробці 6,4 мМ DTT для різного часу. ( c - e ) Експресія OsGAS2 в коренях 8-денних саджанців при обробці 4 ° C ( c ), 150 мМ NaCl ( d ) і 40% PEG 6000 ( і ) для різних часів. Загальну РНК виділяли для RT-PCR і експерименти повторювали тричі.
Повнорозмірне зображення
Розміщення субклітин
Оскільки Gas2 утворює пов'язаний з каспазою-3 білковий комплекс із GRP94 та HSP40, що містять TPR, досліджували субклітинну локалізацію цих трьох білків. Як і слід було очікувати, Gas2 і GRP94 знаходились в ER (рис. 3a, b), тоді як HSP40, що містить TPR, знаходився в цитоплазмі (рис. 3c). Оскільки каспаза-3-подібна активність була присутня в цитоплазмі, це свідчило про те, що при специфічних стресових умовах TPR-вмісний HSP40 може утворювати комплекс з Gas2 та GRP94 на межі розділу ER-цитоплазми, оскільки відомо, що ER забезпечує сайти зв'язування для багато цитозольних білків.
Конструкції, що несуть 35S: Grp94-GFP, 35S: GAS2-GFP та 35S: GFA2-GFP, відповідно були введені в протопласти зі стебел сходів рису шляхом ПЕГ-кальцієвої трансформації. Флуоресценцію GFP спостерігали через 16 годин інкубації з конфокальним мікроскопом PerkinElmer UltraVIEW VoX. Синій-білий DPX (E12353) ER-Tracker ™ використовувався як контроль локалізації ER. Експерименти повторювали принаймні п’ять разів. Бар = 5 мкм.
Повнорозмірне зображення
Зниження регуляції газофагоіндукованої аутофагії в клітинах суспензії рису
Повнорозмірне зображення
Газ2 - це новий субстрат для активності, подібної до каспази-3 у рисі.
( до ) Його мітка 6 була злита з N-кінцем OsGAS2 і мутанта D110A/D113A, а злитий білок експресувався в E. coli. Очищені мутантні білки дикого типу та His 6-мічених інкубували відповідно з реакційним буфером, каспазою-3 та цитозольною фракцією термооброблених суспензійних клітин рису. Після інкубації продукти реакції аналізували за допомогою 12,5% SDS-PAGE, після чого проводили імуноблотинг анти-полігістидиновим антитілом, яке розпізнавало N-кінцевий епітоп OsGAS2 з 6 мітками. Стрілки вказують цільові білкові смуги. ( b ) Схема фрагментації OsGas2 каспазою-3. Повнорозмірний OSGas2 з МВ 74 КДа зображений у вигляді лінійної молекули з передбачуваним місцем розщеплення каспази-3 DEYD 113, який позначений стрілкою. У результаті перетравлення каспази-3 утворюється N-кінцевий фрагмент з МВ 14 КДа (N) та С-кінцевий фрагмент з МВ 60 КДа ( C. ).
Повнорозмірне зображення
Продукт розщеплення посиленої газою 2 активації каспази-3-подібної активності в рисових протопластах
Для виявлення можливої функції продуктів розщеплення Gas2 фрагменти N2 і C2 Gas2 експресували в протопластах рисового мезофілу, використовуючи Dex-індукований умовний вектор експресії, а Dex ефективно індукували експресію фрагментів (рис. 6a). Порівняно з експресією фрагмента N та контролем вектора, експресія фрагмента C призводила до значного збільшення активності, подібної каспазі-3, після термічної обробки (рис. 6b). Цікаво, що аутофагосоми не були виявлені в протопластах, що експресують два фрагменти після лікування ДТТ (дані не наведені).
( до ) RT-PCR-аналіз експресії N-кінцевого фрагмента (N) та С-кінцевого фрагмента (C) у мезофільних протопластах. Загальну РНК готували з протопластів із або без обробки Дексом (контролем) протягом 18 годин. РНК 17S використовували як контроль навантаження. ( b ) Каспаза-3-подібна активність у мезофільних протопластах під експресією N-кінцевого фрагмента (N) та С-кінцевого фрагмента (C). Експресія N і C індукувалась Dex протягом 18 годин, а потім протопласти обробляли при 48 ° C протягом 15 хвилин і давали можливість відновитися при 28 ° C протягом 6 годин. Протопласт із порожнім вектором умовного виразу був використаний як елемент управління. Рівну кількість цитозольних фракцій інкубували з Ac-DEVD-AMC, і флуоресценцію AMC вимірювали за 60 хвилин мікропроцесором при 30 ° C. RFU/мг: відносні одиниці флуоресценції на мг білка.
Повнорозмірне зображення
Обговорення
⊥: шлях інгібування, продемонстрований у цьому документі; суцільна стрілка: шлях активації, транслокації або деградації, продемонстрований у цьому документі; стрілка на дошці: шлях, який не вивчався в цьому документі; кругове коло: передбачуваний каспаза-3-подібний фермент. Детальніше див. У тексті.
Повнорозмірне зображення
Методи
Рослинні матеріали та методи лікування.
Oryza sativa L. cv. Саджанці Nipponbare вирощували в рідкому середовищі MS при 25 ° C, використовуючи 16-годинний світловий/8-годинний темний цикл. Для стрес-обробок 8-денні саджанці інкубували при температурі 4 ° C в пластинах або в рідкому середовищі MS, що містить 150 мМ NaCl або 40% PEG-6000, протягом різних періодів часу. Для індукованого DTT стресу ER, протопласти з 32 клітинних суспензій інкубували з рідким середовищем MS, що містить 6,4 мМ DTT, протягом 18 годин при 26-28 ° C, а потім двічі промивали середовищем MS. Рівний об'єм води додавали до середовища без DTT як негативний контроль 41 .
Очищення та ідентифікація білків, пов’язаних з активністю типу каспази-3
Підготовка протопласту
Клітини рисової суспензії ліній RNAi дикого типу та GAS2 регулярно розмножували та культивували при 28 ° C. Протопласти виділяли з 3 до 4 клітин у суспензії згідно з Maas et al. 42. Для виділення протопластів із зеленої тканини саджанці рису вирощували в поживному розчині при 28 ° С протягом 7-10 днів. Саджанці висотою 10 см використовували для ізоляції протопластів згідно з Wang et al. 43 .
Вилучення РНК із саджанців рису
Загальну РНК виділяли з протопластів рису або коренів розсади за допомогою реагенту Trizol (Takara, Японія). Загальну РНК (5 мкг) використовували для синтезу кДНК із набором реактивів PrimeScript ™ RT з гДНК-ластиком (Takara, Японія) відповідно до інструкцій виробника.
Кількісний аналіз в реальному часі ланцюгової реакції полімеразної зворотної транскрипції
Кількісну ланцюгову реакцію полімерази в реальному часі проводили за допомогою флуоресцентного кількісного апарату ПЛР CFX 96 (Bio-Rad, Hercules, CA, USA). Для виявлення транскриптів OsGAS2 використовували генноспецифічні праймери, а як внутрішній контроль - 17S рРНК. Кожен зразок проводили в трьох незалежних експериментах, і послідовності праймерів детально описані нижче.
OsGAS2 -F: TTGGTAAGGAGAAGGAGTTC; OsGAS2 -R: AGGCTGGTGGTACTATGT.
17sRNA -F: ACACGGGGAAACTTACCAGGTC; 17sРНК -R: CCAGAACATCTAAGGGCATCAC.
Побудова клітинної лінії RNAi-OsGAS2.
Для отримання RNAi-OsGAS2 праймери Ri 1-F/Ri 1-R були розроблені для фрагмента 1 OsGAS2, а праймери Ri 2-F/Ri 2-R для фрагмента 2 OsGAS2 (сайти Kpn I/Sac I та Mlu I/Сайти BamH I вказані курсивом):
Ri 1-F: GG GGTACC GCTGAGCATGATATGCCAGAAC; Ri 1-R: C GAGCTC TCCTTCCGAACACGAGAAGC.
Ri 2-F: CG ACGCGT TCCTTCCGAACACGAGAAGC; Ri 1-R: CG GGATCC GCTGAGCATGATATGCCAGAAC.
$ config [ads_text16] не знайдено
Ампліфіковані фрагменти 1 та 2 двічі перетравлювали Kpn I/Sac I та Mlu I/BamH I відповідно, а потім клонували у вектор RNAi LH-FAD2-1390. Рекомбінантні плазміди перетворювались у клітини суспензії рису шляхом зараження Agrobacterium .
Субклітинна локалізація білків OsGAS2, OsGrp94 та HSP40 у мезофільних протопластах рису
Для дослідження субклітинної локалізації повнорозмірні OsGAS2 (Os01g0276800), OSGrp94 (Os06g0716700) та передбачувані кДНК HSP40 (Os02g0100300) ампліфікували за допомогою генно-специфічних праймерів (сайт BamH I та Kpn I показані курсивом):
OsGAS2: F-CG GGATCC ATGGGGCTCCACGCGATCC; R-GG GGTACC GCGAGTTCATCATGGTCACGCT.
OsGrp94: F-CG GGATCC ATGCGCAAGTGGGCGCTCTCC; R-GG GGTACC CTACAGCTCGTCCTTATCATA.
HSP40: F-CG GGATCC ATGGATGCTTCTCGCGTTGGC; R-GG GGTACC TTACTGGGACCCATTGAATTT.
Продукти ПЛР підтверджували секвенуванням, а потім очищали гелем за допомогою набору для екстракції гелю ДНК AxyPrep (Axygen, Китай). Потім продукти розщеплювали BamH I та Kpn I і клонували у субклітинний вектор локалізації pXZP008 44. Ген-репортер, що кодує зелений флуоресцентний білок (GFP), був злитий з OsGAS2, OsGrp94 та OsHSP40, який рухається промотором вірусу мозаїки 35S вірусу цвітної капусти (35S: OsGAS2/OsGrp94/OsHSP40-GFP), а потім трансформувався та експресувався тимчасово в мезофільному рис. протопласти. Після інкубації протягом 16 годин при 26 ° C у темряві, трансформовані протопласти фарбували ER-Tracker ™ Blue-White DPX 100 нМ (E12353, Molecular Probes, США) протягом 30 хвилин при 28 ° C у темряві та промивали двічі з розчином W5. Флуоресценцію візуалізували за допомогою конфокального мікроскопа PerkinElmer UltraVIEW VoX. ER визначали, використовуючи E12353 як контроль.
Експресія та очищення рекомбінантних типів A та D 110 A/D 113 Подвійний мутантний білок OsGAS2.
Для експресії рекомбінантного OsGAS2 у Eschericia coli кДНК OsGAS2 повної довжини (Os01g0276800, WT) та D 110 A/D 113 A мутант (Mu) ампліфікували за допомогою ген-специфічних праймерів (сайти Nde I та EcoR I, показані курсивом):
WT: F-GGAATTC CATATG GCCTCCAGGCCGCCGCTCGA;
WT: RG GAATTC TTAGAGTTCAYCATGGTCACG;
D 113 A: F- ACGGGAGTGATGAGTATGCTAGCAATGTCACTTGCAAG
D 113 A: R- CTTGCAAGTGACATTGCTAGCATACTCATCACTCCCGT
D 110 A/D 113: F- TTGCTGCGACGGGAGTGCTGAGTATGCTAGCAATGTC
D 110/D 113 A: R- GACATTGCTAGCATACTCAGCACTCCCGTCGCAGCAA
Продукти ПЛР, підтверджені секвенуванням, очищали гелем і подвійно перетравлювали Nde I/EcoR I, клонували в мічений His-тегом pET-28a, а потім трансформували в E. coli DE3. Експресію індукували, використовуючи 0,3 мМ ізопропіл-bD-1-тіогалактопіранозид (IPTG) при 37 ° C протягом 4 годин. Клітини збирали і ресуспендували в буфері для лізису (50 мМ NaH 2 PO 4 (рН 8,0), 300 мМ NaCl). Після ультразвукового переривання суміш центрифугували при 10000 × g протягом 1 години при 4 ° C. Отриманий супернатант завантажували на колонку зі смолою Ni-NTA (GenScript, Китай). Після промивання колонки OsGAS2, мічений His, елюювали за допомогою елюційного буфера (50 мМ NaH 2 PO 4 (рН 8,0), 300 мМ NaCl і 250 мМ імідазолу).
Деградація OsGAS2 шляхом дії, подібної до каспази-3, in vitro
Очищений білок OsGAS2-His 6 (100 мкг) інкубували з каспазою-3 або цільноклітинним лізатом з термооброблених рисових суспензійних клітин протягом 5 год при 37 ° С в пробному буфері (50 мМ HEPES-KOH (рН 7,5), 10% гліцерин, 50 мМ KCl, 2,5 мМ MgCl 2 і 1 мМ DTT). Перетравлені продукти розділяли SDS-PAGE і виявляли вестерн-блот, використовуючи моноклональне мишаче анти-полігістидинове антитіло (розведення 1: 1000, BOSTER, Китай) як зонд.
Умовна експресія фрагментів OsGAS2 у протопластах рисового мезофілу
Фрагменти OsGAS2: N- і C-фрагменти ампліфікували за допомогою ген-специфічних праймерів (сайти Xho I і Spe I показані курсивом):
Продукти подвійно перетравлювали Xho I/Spe I, а потім направляли клонування у індукований дексаметазон (Dex) бінарний вектор pTA7002. Отримані конструкції та векторний контроль (20–25 мкг) трансформували у протопласти мезофілу рису.
Аналіз активності на зразок каспази-3
Протопласти, трансформовані з контролем вектора pTA7002 або pTA7002-N/C, ресуспендували в середовищі W5 (доповненому 10 мМ Dex) і інкубували в культуральній пластині із шістьма лунками при 28 ° C у темряві протягом певної кількості часу. Після інкубації протопласти обробляли при 48 ° C протягом 15 хв і давали можливість відновитись при 28 ° C протягом 6 годин. Протопласти суспендували в буфері для лізису (50 мМ HEPES (рН 7,4), 100 мМ NaCl, 250 мМ сахарози, 0,1% CHAPS, 1 мМ DTT, 0,1 мМ ЕДТА, 1 мг/мл пепстатиніну, 8 мг/мл апротиніну, 10 мг/мл лейпептину). Суспензії гомогенізували на льоду і центрифугували при 12 000 × g протягом 5 хв при 4 ° C, розчинні цитозольні фракції збирали та інкубували в пробному буфері (50 мМ HEPES-KOH (pH 7,5), 10% гліцерину, 50 мМ KCl, 2,5 мМ MgCl 2 і 1 мМ DTT), доповнений 70 мМ N-ацетил-Asp-Glu-Val-Asp-7-аміно-4-метилкумарином (Ac-DEVD-AMC, EnzoLife Sciences, США). Реакційну систему інкубували без світла при 30 ° С протягом 1 години. Флуоресценцію вимірювали у зчитувачі мікропланшетів (TECAN, США) при 380/460 нм. Різниця у флуоресценції до та після інкубації нормалізувалася щодо відповідної концентрації білка. Всі аналізи проводили з використанням трьох незалежних зразків.
Електронний мікроскоп
Протопласти, оброблені DTT, фіксували 2,5% (мас./Об.) Глутаральдегіду в CPW-9M (pH 5,8) при 4 ° C протягом ночі і після фіксації 1% (мас./Об.) Тетроксиду осмію протягом 3 год при кімнатній температурі. Після фарбування 1% (мас./Об.) Уранілацетату при кімнатній температурі протягом 2 год протопласти зневоднювали за допомогою декількох різних сумішей етанолу, води та оксиду пропілену, а потім вносили в смолу Сперра. Секції вимірювальні
Товщиною 70 нм вирізали і фарбували уранілацетатом та нітратом свинцю. Зразки зрізів спостерігали за допомогою електронного мікроскопа (H-7650, Hitachi).
Вимірювання вмісту цитозольного Ca 2+
Флуоресцентний барвник, чутливий до Ca 2+, Fluo-3-AM був використаний для виявлення відносної зміни залежної від Ca 2+ флуоресценції в протопластах. Протопласти інкубували з 5 мкМ попередньо нагрітого флюо-3-АМ (Dojindo Laboratories, Японія) протягом 30 хв при 37 ° C, як зазначено в інструкціях виробника. Потім клітини двічі промивали і повторно суспендували в розчині HBSS, що містить 0,4 М манітолу. Флуоресценцію Fluo-3 вимірювали за допомогою конфокального мікроскопа PerkinElmer UltraVIEW VoX з використанням довжин хвиль збудження та випромінювання 488 і 525 нм, відповідно. Інтенсивність флуоресценції протопластів вимірювали шляхом обмеження окремого протопласту, а середню флуоресценцію протопластів вимірювали та аналізували за допомогою Image Pro Plus. Для кожного лікування було включено 8–10 протопластів.
Маркування ЛСД
Протопласти, оброблені DTT та/або 3-MA, збирали та інкубували з 50 нМ LysoTracker Red DND-99 (Молекулярні зонди, США) протягом 20 хв при 37 ° C, тричі промивали буфером CPW-9M, а потім досліджували Конфокальний мікроскоп PerkinElmer Ultra VIEW VoX. Довжина хвилі збудження становила 561 нм, а сигнали випромінювання вимірювались при 590 нм.
Коментарі
Надсилаючи коментар, ви погоджуєтесь дотримуватись наших Умов та правил спільноти. Якщо ви виявите щось образливе або не відповідає нашим умовам чи інструкціям, позначте це як неприйнятне.
- Garzón оголошує про нову систему маркування для пропаганди здорового харчування - La Nueva España
- Японська боротьба готується до можливого повернення до діяльності Супербоїв
- Чорний чай, ваш новий союзник для схуднення
- Співчуття як мета нового року
- Це нова здорова причина, щоб щоранку пити міцну каву