Вплив бланшування та гігроскопічного покриття на якість моркви (Daucus carota var. Шантене) попередньо вирізати під час зберігання
Едгар Укіче Карраско, Луїс Ціснерос-Зеваллос, доктор філософії.
Університет Ла-Фронтера. Темуко, Чилі., Техаський університет A&M. Коледж-Стейшн, США.
T1: занурення на 20 секунд у дистильовану воду (контроль);
Т2: бланшовані зразки (50 ° С протягом 30 с у розчині 1% лимонної кислоти);
Т3: зразки, змочені гліцерином (занурення на 20 с у золь. 3% мас.);
Т4: зразки, бланшировані та змочені гліцерином (комбінація обробок Т2 та Т3).
Моркву бланшували (дві одиниці щоразу) у 500 мл 1% розчину лимонної кислоти (мас./Мас.) При 50 ° С протягом 30 секунд, використовуючи піч для ванни Memmert (Німеччина). Потім їх охолоджували в дистильованій воді протягом 30 с, давали стекти 5 хвилин. Для змочування приготували 3% (мас./Мас.) Розчин гліцерину в дистильованій воді, отриманий змішуванням при 1000 об/хв протягом 10 хвилин за допомогою мішалки Heidolph (Німеччина). Змочування зразків моркви проводили зануренням на 20 секунд у розчин гліцерину і давали їм стекти протягом 5 хвилин. Зразки упаковували в поліпропіленові пакети (дві одиниці в мішок) розмірами 15 х 25 см і товщиною 0,04 мм (мікрометр Мітутойо, Японія). Після герметизації мішки зберігали в холодильнику в камері Verstfrost FKG 371 (Данія) при 10 ± 1ºC, ємністю 0,64 м 3. Під час зберігання (19 днів) з кожної обробки з періодичністю днів витягували два пакети для оцінки вмісту каротиноїдів, вимірювання кольору поверхні (параметри L *, a *, b *), втрати ваги та зміни розчинних твердих речовин.
Для вимірювання каротиноїдів (18,19) приблизну пробу 0,25 г моркви поміщали в непрозору скляну пляшку (5 мл загального обсягу) (щоб уникнути ультрафіолетового світла) та 3 мл розчинника N, N-диметилформаміду ( DMF) для вилучення пігментів, потім герметично закривали і витримували в холодильнику (± 5ºC) протягом 14 годин. Вміст пігменту в супернатанті розчинника визначали за допомогою спектрофотометра Hewlett Packard UV 8452A (США). Концентрацію пігментів у фазі розчинника (c) розраховували за рівнянням: c = 0,25 * (A450 - A750) (нмоль/мл); де: A450 та A750 - поглинання при 450 нм та 750 нм відповідно супернатанту розчинника, що містить екстраговані пігменти. Концентрацію пігменту розраховували у зразку (C), її розраховували згідно: C = (c * V)/г (нмоль/р); де V: об'єм екстракційного розчину (мл); г: грами зразка на сухій основі. Вміст вологи визначали гравіметрично шляхом сушіння до постійної ваги в печі при 105 ° C (20). Вимірювання пігменту проводили на чотирьох зразках та у двох примірниках для кожної обробки. Повідомлені значення є середнім значенням за вісім вимірювань.
Оцінка кольору
Колір вимірювали за допомогою колориметра CR200 (Minolta Camera Co., Японія), відкаліброваного за стандартом (L * = 70,1, a * = 18,23, b * = 32,02). Відповідно до кольорової шкали CIE (Commission Internationale de l ? Eclairage) визначали значення L *, a *, b *. Вимірювання проводили на шести зразках та у двох примірниках (на поверхнях, протилежних зразку) для кожної обробки. Результати виражали як середнє значення дванадцяти значень ІВ (Індекс відбілювання) (1,6): ІБ = 100 - ((100 ? L *) 2 + a * 2 + b * 2) 0,5; а також як зміни індексів кольоровості та кута відтінку (21): кольоровість = (a 2 + b 2) 0,5; Кут відтінку = арктанг b/a.
Втрата ваги та розчинні тверді речовини
Шість зразків від кожної обробки зважували під час зберігання на аналітичних вагах з точністю ± 0,001 г (Ханау, Німеччина). Коефіцієнт втрати ваги розраховували відносно початкової ваги зразків, повідомляючи результати як середнє значення за шість вимірювань. Відсоток розчинних твердих речовин (СВ) визначали у чотирьох зразках за одну обробку, роблячи повторювані показники (20ºC) соку, витягнутого ручним тиском та відфільтрованого, для кожного зразка. Використовували рефрактометр ABBE Mark II моделі 10481 (Leica Inc., NY). Значення СС були представлені як середнє значення за вісім показань.
Результати для визначення вмісту каротиноїдних пігментів, кольору, втрати ваги та розчинних твердих речовин були статистично проаналізовані для визначення суттєвої різниці між обробками. Дисперсійний аналіз (ANVA) застосовували до залишків регулювання лінійної регресії вимірювань, проведених під час зберігання.
РЕЗУЛЬТАТИ І ОБГОВОРЕННЯ
Колір поверхні моркви
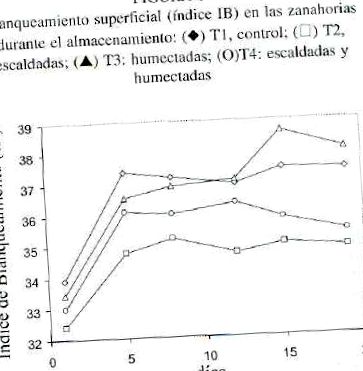
Виміряну зміну кольору виражали показниками IB, кутом відтінку та кольоровістю. Кут відтінку 0 ° являє собою чисто червоний, а кут відтінку 180 ° - чисто зелений. Значення кольоровості відображає інтенсивність кольору. Індекс IB використовується для оцінки поверхневого відбілювання у моркви, оскільки він краще корелює з візуальним розвитком відбілювання порівняно зі значеннями CIE (L *, a *, b *) та кольоровістю (1). Однак, коли індекс IB знаходиться між значеннями 31 і 37, як правило, на поверхні моркви не спостерігається білого утворення, але колір змінюється від насиченого помаранчевого до блідо-оранжевого (6).
У цій роботі на поверхні моркви не спостерігалося білуватого утворення, що дало б значення IB у діапазоні від 32 до 38 (рис. 1). В основному спостерігалася зміна кольору від насиченого помаранчевого до блідо-оранжевого, що збігалося зі зменшенням значень кольоровості в кінці зберігання для всіх процедур (Таблиця 1). Однак суттєвих відмінностей між ними не було (р> 0,05). Значення кута відтінку не змінюються суттєво під час зберігання, перебуваючи в межах від 54,1 до 56,5 (табл. 1). На малюнку 1 можна помітити, що в кінці зберігання найвищі значення індексу IB, які відповідають блідо-помаранчевому, вищі у контролі (T1) та у зразках, змочених гліцерином (T3).
Варіації кольору під час зберігання (1 і 19 день)
- Вплив солоності на якість полуниці та її еволюція у післязбиральному фертигації
- Вплив жувальної гумки на вагу
- Аргентинське дослідження щодо впливу вітаміну D на Covid-19, яке може врятувати багатьох
- Екстракт зеленого чаю не впливає на схуднення - Блокнот наукової культури
- Аргентинські вчені з питань коронавірусу представлять сьогодні нове розслідування щодо впливу