Резюме
Серотонін мозку відіграє вирішальну роль у регулюванні споживання їжі та гомеостазу маси тіла. Наведені вище дані свідчать про взаємодію з кортикотропін-рилізинг-гормоном (CRH). Для подальшого вивчення взаємодії між цими нейромедіаторами селективний інгібітор зворотного захоплення серотоніну (СІЗЗС) з флувоксаміном вводили внутрішньочеревно щурам факеру/факеру Цукера з антагоністом рецептора CRH та без нього. Тварини, оброблені фізіологічним розчином, набирали вагу. Флувоксамін призвів до значної втрати ваги, не впливаючи на споживання їжі. Крім того, рівень інсуліну в цій тваринній моделі був знижений після введення флувоксаміну. Ці ефекти були антагонізовані α-спіральною CRH і тому, швидше за все, опосередковуються через CRH або CRH-подібні пептиди.
Доступ надано
Вступ
Селективні інгібітори зворотного захоплення серотоніну (СІЗЗС) зазвичай використовуються як медикаментозне лікування при депресивних розладах. Загальновідомо, що ці ліки впливають центрально на споживання їжі та гомеостаз маси тіла. Це узгоджується з експериментальними даними, які демонструють сильні анорексичні властивості серотоніну при введенні в паравентрикулярне ядро (ПВН) та інші ділянки гіпоталамусу. 1, 2
У цьому дослідженні ми зосереджуємося на анорексичних властивостях ssri флувоксаміну, який є більш специфічним для серотоніну порівняно з іншими сполуками цієї групи препаратів, такими як флуоксетин, який має менший вплив на зворотне захоплення норадреналіну. 3
Наведені вище дані свідчать про те, що в межах PVN серотонін та кортикотропін-рилізинг-гормон (CRH) взаємодіють, змінюючи споживання їжі, а посилений синтез CRH у цьому конкретному ядрі був показаний після ін’єкції серотоніну. 4, 5 Крім того, було продемонстровано стимулюючий ефект D-фенфлураміну, серотонін-вивільняючого агента, на нейрональну активацію клітин, що експресують CRH, у PVN. 6 CRH однозначно володіє анорексичними властивостями при центральному введенні. 7 Причинно-наслідковий зв'язок між нейромедіатором серотоніном та нейропептидом CRH ще не продемонстровано. На додаток до своїх анорексичних дій, CRH стимулює метаболізм коричневої жирової тканини завдяки активації симпатичної нервової системи у гризунів при центральному застосуванні, 8, 9, що може спричинити збільшення енергетичних витрат.
У щурів fa/fa Цукера мРНК рецептора CRH 2 знижується у вентромедіальному гіпоталамусі (VMH), що свідчить про можливу участь нейронів CRH у зменшенні енергетичних витрат у цьому генотипі; 10, крім того, гіперінсулінемія у цих тварин, що пояснюється підвищеною активністю блукаючих клітин у підшлунковій залозі, 11 зменшується після місцевого застосування CRH до VMH.
Метою цього дослідження було подальше дослідження природи серотоніну мозку та взаємодії CRH у контролі маси тіла, що раніше не вивчалося в довгостроковому експерименті in vivo.
Методи
Хлоралгідрат та α-гвинтову CRH закуповували у Sigma Chemie (Дейзенгофен, Німеччина). Флувоксамін малеат був отриманий від Solvay Duphar. Інсулін визначали за допомогою Insulin RIA 100 від Pharmacia та Upjohn Diagnostics AB, Швеція.
Досліджували гомозиготних фа/фа самців щурів з Harlan-Winkelmann, Borchem, Німеччина. На початку експерименту тваринам було 12 тижнів і важили від 300 до 400 г. Тварин утримували в окремих клітинах при постійній кімнатній температурі 23 ° C протягом 12 годин циклу світло/темрява, і їм дозволялося пристосовуватися до умов утримання до операції протягом щонайменше 4 днів. Інші автори 12 показали, що дози α-спіральної CRH та флувоксаміну ефективні, і що ми були протестовані нами в пілотному дослідженні.
Тварин було розподілено до чотирьох експериментальних груп: група 1-0, 5 мл ip сольового розчину та 10 мкл сольового розчину icv, n = 7; група 2: флувоксамін ip (25 мг/кг маси тіла в 0,5 мл фізіологічного розчину) та α-CRH icv (25 мкг в 10 мкл фізіологічного розчину), n = 5; група 3: флувоксамін ip (25 мг/кг маси тіла в 0,5 мл фізіологічного розчину) і 10 мкл сольового розчину ICV, n = 6; і група 4-0,5 мл сольового розчину ip та α-CRH icv (25 мкг в 10 мкл сольового розчину), n = 4.
Для забору зразків крові проводили пункцію стегнової артерії та імплантацію катетера. Хлоралгідрат у дозі 0,4 г на кг ваги тіла вводили внутрішньовенно для наркозу. Під час операції температуру тіла підтримували за допомогою регульованої нагрівальної подушки. Скляний капіляр поміщали в лівий бічний шлуночок для ін’єкцій з використанням стереотаксичного інструменту. Необхідні координати були взяті з атласів Паксінос і Ватсон. 13 У перший післяопераційний день експериментальних тварин помістили в спеціальну клітку, яка забезпечувала вільний доступ до щура без змін. Після 30-хвилинного адаптаційного періоду відбирали пробу сироватки для визначення базального значення інсуліну та проводили внутрішньовенне введення. Після ін’єкції відбирали зразки крові через 30, 60, 90 та 120 хв. Вилучений об'єм замінювали сольовим розчином відразу після кожного збору; загальна кількість відібраної крові не перевищувала 1,5 мл у кожної тварини. Зразки негайно центрифугували; Сироватку збирали і заморожували при -70 ° С до аналізу інсуліну.
Споживання їжі та маса тіла тварин були задокументовані протягом наступних 7 днів. Масу тіла щурів вимірювали в день операції та один раз на день між 12:00 та 14:00 протягом періоду спостереження. Дослідним тваринам проводили обробку ip та icv о 8 ранку протягом семи днів поспіль. Щурів приносили в жертву між 13:30 і 14:30, в середині світлової фази циклу світло/темрява.
Статистичний аналіз проводили за допомогою SPSS, версія 8.0 для Windows. Для повторних вимірювань вихідних даних проводили ANOVA, а для нормалізованих даних - 2 × 2 ANOVA. T-тест Тукі був використаний як пост-спеціальний тест для порівняння після повторних вимірювань ANOVA.
Результати
На малюнку 1 показано розвиток маси тіла під час експерименту. У той час як тварини, які отримували комбінацію ip фізіологічного розчину та фізіологічного розчину icv (група 1), у кінці дослідження отримали загалом 20,57 ± 5,63 г маси тіла, тварини, які отримували ip флувоксамін та сольовий розчин (група 3), показали помітна втрата ваги на -22,97 ± 14,34 г. Після комбінованого введення флувоксаміну ip та спіральної CRH icv (група 2) приріст ваги тварин частково відновився (14,47 ± 8,29 г). Тварини, які отримували α-спіральний фізіологічний розчин CRH icv/ip (група 4), отримали 3,74 ± 2,85 г за період спостереження. Групи 1, 2 та 4 суттєво не відрізнялися одна від одної, тоді як втрата ваги у групі 3 була значно меншою порівняно з іншими групами (P 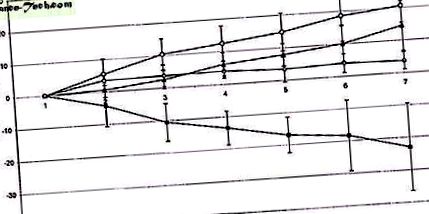
Базальна гіперінсулінемія у щурів факеру/факера Цукера пояснюється збільшенням парасимпатичного потоку у напрямку до ендокринної підшлункової залози 2, 20 і може бути зменшена введенням ICV ICH. 13 Наші дані чітко підтверджують думку про те, що вплив флувоксаміну на секрецію інсуліну опосередковується CRH, оскільки вони були скасовані α-спіральною CRH, принаймні частково.
Підводячи підсумок, результати наших експериментів однозначно свідчать про те, що CRH або CRH-подібні пептиди активно беруть участь у серотонінергічній регуляції маси тіла.
Висловлення подяки
Флувоксамін люб’язно надали Pharmacia & Upjohn, Швеція. Експериментальні протоколи для тварин та догляду за ними відповідали німецькому законодавству та були затверджені комітетом з догляду за тваринами. Всі експерименти відповідали найвищим стандартам догляду за тваринами.
- Незалежний член Herbalife Nutrition 6 Популярні міфи про схуднення
- Поширені запитання про схуднення
- Схуднути за допомогою приладів, що діють на нервову систему - Технологія та право
- Міфи незалежного члена Herbalife Nutrition та переваги схуднення через холодну воду
- Марта Лупес розповідає про свою різку втрату ваги - Мінуто Еспаса
