- Предмети
- Резюме
- Вступ
- Результати
- Mer похибки виражається в AML
- Mer активує клітинне виживання та антиапоптотичні шляхи
- Інгібування Mer за допомогою нокдауну Mer shRNA
- Інгібування Mer за допомогою shRNA зменшує фосфорилювання p38, ERK та CREB
- Інгібування Mer індукує апоптоз мієлобластів в пробірці
- Інгібування Mer зменшує проліферацію мієлобластів в пробірці
- Повторне впровадження Mer рятує здатність мієлобластів уникати апоптозу та утворювати колонії
- Інгібування Mer збільшує виживання без лейкемії у природніх умовах
- Обговорення
- Додаткова інформація
- Файли зображень
- Додаткова фігура S1
- Документи Word
- Додаткова таблиця S1
- Додаткова таблиця S2
- Додаткова таблиця S3
- Додаткові рисунки та таблиці Легенди
Предмети
- AML
- Онкогенні білки
- Онкогенез
- Виправлення помилки цієї статті було опубліковано 5 вересня 2016 року.
Резюме
Нещодавні дослідження в галузі АМЛ виявили лише кілька аномально експресованих або мутованих протеїнкіназ, які служать потенційними терапевтичними мішенями. Високе алельне співвідношення внутрішньої мутації дуплікації FLT-3 було пов'язано з поганим прогнозом, і розроблено інгібітори малих молекул, націлені на клітини, що експресують FLT-3. 6,7 Позитивний AM-C-комплект, виявлений у великої кількості хворих на рецидиви, асоціюється з поганим прогнозом, а також на нього спрямовані інгібітори малих молекул. 8,9 Потрібні більш цілеспрямовані варіанти терапії, щоб забезпечити більш ефективне лікування ПМЛ або дозволити зменшити високоінтенсивну хіміотерапію.
У цьому рукописі ми повідомляємо, що в більшості зразків педіатричних та дорослих хворих на ЛМП Мер погіршено експресується, порівняно із звичайними мієлоїдними попередниками. Mer також експресується в переважній більшості клітинних ліній AML. Активація Mer в клітинних лініях AML викликала виживання та проліферацію, включаючи фосфорилювання ERK1/2 та AKT, а також p38 MAPK (p38), MSK1, CREB, ATF1 та STAT6. Нарешті, ми показуємо, що інгібування Mer через втручання РНК в клітинні лінії AML людини призводить до значного збільшення апоптозу, зниження потенціалу утворення колоній та затримки розвитку лейкемії у мишей зі зниженим імунітетом. Терапевтична спрямованість на аберрантну експресію Мер при ОМЛ є привабливою, що потенційно дозволяє досягти кращих результатів у пацієнтів з високим ризиком, комбінованої терапії зі зниженою інтенсивністю у пацієнтів з низьким ризиком або терапевтичного варіанту для тих, хто не може переносити інтенсивність хіміотерапії з високим ризиком.
Результати
Mer похибки виражається в AML
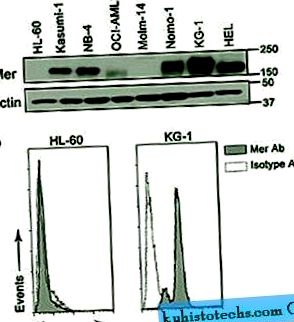
Для оцінки експресії Mer в AML ми оцінили 14 різних ліній мієлоїдних клітин. Мер було виявлено шляхом імуноблотингу в більшості клітинних ліній, що аналізувались як білок 150-180 кД (коливання в розмірах пояснювалось диференційованим глікозилюванням 18). Проточний цитометричний аналіз підтвердив висновки; клітини, які були позитивними для Mer, продемонстрували вищу інтенсивність флуоресценції порівняно з клітинами, забарвленими контролем ізотипу імуноглобуліну G1 миші, тоді як клітини негативними ні (рис. 1 та додаткова таблиця S1). Наш аналіз виявив високий ступінь кореляції між результатами імуноблоту та проточної цитометрії та показав, що певний ступінь експресії Мер був у 86% (12 з 14) клітинних ліній AML. У цьому аналізі клітинних ліній експресія Мер не асоціювалася з жодною класифікацією франко-американських британців (FAB) або Всесвітньої організації охорони здоров'я (ВООЗ), цитогенетичними відхиленнями, віком пацієнта, з якого похідна клітинна лінія, і не співвідносилася з Інші відомі клінічні характеристики (Додаткова таблиця S1).
Mer виражається в клітинних лініях AML. ( до ) Цілі клітинні лізати, отримані з клітинних ліній АМЛ, піддавали імуноблот-аналізу з антитілом Mer. Цей репрезентативний блот показує виявлення білка Mer (150-180 кД) у декількох клітинних лініях AML. Актин був виявлений як контроль навантаження. ( b ) Експресія Mer на клітинній поверхні визначалася за допомогою проточної цитометрії після фарбування первинним антитілом Mer проти людини та вторинним антитілом, кон'югованим з PE (сіра гістограма). Неспецифічне фарбування визначали за допомогою контрольного антитіла з ізотипу IgG1 та вторинного антитіла, кон'югованого з РЕ (біла гістограма). Показані репрезентативні Mer негативні (HL-60) та Mer позитивні (KG-1) клітинні лінії.
Повнорозмірне зображення
Mer виражається в більшості діагностичних зразків кісткового мозку, отриманих у хворих на ЛМЛ, але не в нормальному кістковому мозку. Мієлобласти, зібрані для діагностики хворих на ЛМЛ, аналізували за допомогою проточної цитометрії на експресію Mer. ( до ) Клітини, що експресують людські CD33 та CD45, аналізували після фарбування антитілом Mer людини проти мишей та вторинним антитілом, кон'югованим з РЕ, для експресії Mer (сіра гістограма). Неспецифічне фарбування визначали, використовуючи антитіло для контролю ізотипу IgG1 миші та кон'юговане з РЕ вторинне антитіло (біла гістограма). Репрезентативні профілі проточної цитометрії показані для Mer-позитивних (> 20% позитивних клітин), Mer-dim (10-20% позитивних клітин) та Mer-негативних (
Повнорозмірне зображення
Інгібування Mer за допомогою нокдауну Mer shRNA
Для вивчення функціональної ролі Mer в AML, ми ввели коротку шпильку РНК (shRNA), спрямовану проти Mer, у дві клітинні лінії, використані вище. Номо-1 і Касумі-1 трансдукували лентівірусами, що кодують одну з двох різних конструкцій shRNA (shMer1 та shMer4), щоб зменшити експресію Mer, або була розроблена не заглушуюча shRNA (shControl) та розроблені стабільні клони. Для оцінки ефективності інгібування Mer проводили імуноблот-аналіз цільноклітинних лізатів. Обидва клони делеції ефективно зменшували експресію Mer, при цьому клон shMer4 з кожної клітинної лінії мав дещо ефективніший кліренс Mer, ніж клон shMer1 (рис. 4а). Ці висновки були підтверджені проточним цитометричним аналізом експресії Mer на клітинній поверхні, який продемонстрував ефективний кліренс для обох конструкцій із дещо більшим гальмуванням у клітинах shMer4 (падіння на 70–80%), ніж shMer1 (падіння на 60%) порівняно з shControl (рис. 4b)
Експресія білка Mer зменшується за рахунок експресії shRNA в клітинних лініях AML. Клітини Kasumi-1 та Nomo-1 інфікували лентівірусними частинками, що містять конструкції короткої шпильки РНК (shRNA), що націлюються на Mer (shMer1, shMer4), або GFP як контроль, що не мовчить (shControl). Видалення Мер було підтверджено ( до ) імуноблот-аналіз цільноклітинних лізатів та ( b ) проточна цитометрія з використанням анти-Mer антитіл. Значення представляють середні значення та отримані в результаті трьох незалежних експериментів. ( c ) Батьківські та shRNA-вмісні клітини Kasumi-1 та Nomo-1 інкубували у безсироватковому середовищі протягом 2–3 год з подальшою 10-хвилинною обробкою 200 нМ rhGas6 ((+) Gas6) або буфером (мертвий сироватковий голод) . Цілісноклітинні лізати піддавали імуноблот-аналізу з антитілами, специфічними для фосфорильованих та загальних білків, проаналізованих на малюнку 3е. З них p38, ERK1/2 та CREB постійно демонстрували зниження фосфорилювання, що відповідає рівню Mer, при стимуляції за допомогою Gas6.
Повнорозмірне зображення
Інгібування Mer за допомогою shRNA зменшує фосфорилювання p38, ERK та CREB
Щоб оцінити, які подальші шляхи найбільше постраждали від інгібування Mer за допомогою shRNA, ми додатково проаналізували білки, які продемонстрували підвищене фосфорилювання після стимуляції Gas6 (тобто MSK1, p38, ERK, AKT, CREB, ATF1 та STAT6), використовуючи наші Merckdown Nomo-1 та Kasumi -1 клітинні лінії. Коли сироваткові голодні клітини стимулювали за допомогою Gas6, клітинні лінії знесення постійно демонстрували супутнє зниження фосфорилювання p38, ERK та CREB порівняно з клітинами, обробленими лише буфером (рис. 4в).
Інгібування Mer індукує апоптоз мієлобластів in vitro
Фенотипічні ефекти інгібування Mer на AML оцінювали in vitro. Клітини Номо-1 та Касумі-1 з конструкціями шРНК або без них фарбували йодидом Йо-Про-1 та йодидом пропідію через 18 годин голодування в сироватці та піддавали проточному цитометричному аналізу. Клітини, які приймали лише йодид Йо-Про-1 (ранній апоптоз) та ті, які приймали йодид Йо-Про-1 та йодид пропідію (пізній апоптоз та некроз), були включені в аналіз; Клітини, що приймали лише йодид пропідію (мертві клітини), виключали, щоб виключити можливість аналізу клітин, які загинули до аналізу. Клітинні лінії зі зниженим рівнем Mer продемонстрували вищий ступінь апоптозу; ∼ 35% (shMer1) та 55% (shMer4) клітин вважалися апоптотичними у відповідь на сироваткове голодування. Це було значно більше, ніж 15-20% апоптозу, який спостерігався в контрольних клітинних лініях (P
Меркдаун надає схильність до апоптозу. ( до ) Батьківські, не заглушуючі контроль shRNA (shControl) та Merckdown (shMer1, shMer4) Клітини Kasumi-1 та Nomo-1 голодували або культивували в повному середовищі протягом 18 годин до йодиду пропідуму та йодиду I-Pro-1. Апоптотичні клітини ідентифікували за допомогою проточної цитометрії. Показані репрезентативні профілі проточної цитометрії. Показано відсотки ранніх апоптотичних клітин (нижній правий квадрант; Yo-Pro +/PI−) та пізнього апоптозу/некрозу (верхній правий квадрант; Yo-Pro +/PI +). ( b ) Сукупні дані демонструють значне накопичення апоптотичних клітин у клітинах Касумі-1 та Номо-1, коли Mer інгібується shRNA (* P
Видалення Mer зменшує потенціал утворення колонії AML. Батьківські, невимкнені контрольні шРНК (shControl) та Merckdown (shMer1, shMer4) Номо-1 та Касумі-1 клітини культивували в метилцелюлозі протягом 13 днів. ( до ) Показані репрезентативні зображення бляшок клітинної лінії Nomo-1. ( byd ) Загальну кількість колоній визначали, продемонструвавши статистично значуще зменшення утворення колоній, коли Mer (* * P
Інгібування експресії Mer подовжує виживання у мишачої моделі AML. Мишей NOD-SCID-гамма опромінювали 200 cGy і трансплантували п'ять мільйонів батьківських NRNA-1 (Parental, n = 8), неорієнтованих shRNA (shControl, n = 8) або Merckdown (shMer1 n = 16, shMer4 n = 14 ) клітини шляхом внутрішньовенного введення. Показано, що аналіз Каплана-Мейєра, що порівнює виживання, демонструє статистично значуще подовження (Р 20
Механізм надмірної експресії Мер при AML незрозумілий; Можливі механізми включають адаптації на рівні транскрипції або трансляції, такі як змінене метилювання промотору або регуляція мікроРНК. Встановлено, що підвищена експресія Axl, іншого члена сімейства тирозинкінази Tyro-3/Axl/Mer, в мієлоїдному лейкозі після хіміотерапії збігається із посиленим метилюванням промотору Axl. 21 При раку молочної залози приглушення супресора мікроРНК Mer було пов'язане зі збільшенням метастазування. 22 Аномальна експресія Mer при лейкемії ще не пов'язана зі специфічними епігенетичними змінами, і подальша оцінка механізму надмірної експресії Mer при AML є необхідною.
Ці результати також свідчать про те, що клітинні лінії AML залежать від сигналізації Mer, щоб підтримувати життєздатність в умовах стресу та in vivo. Крім того, ці дані демонструють обгрунтування цілеспрямованої терапії проти Мер як у дорослих, так і у педіатричної ОМЛ. Потенційно інгібування Mer може мати клінічно значущий ефект у пацієнтів на обох кінцях вікового спектра AML, як монотерапія, так і в поєднанні із сучасною терапією AML.
В даний час існує кілька трансляційних агентів, націлених на Мер у доклінічному розвитку. Одним із них є нещодавно описане моноклональне антитіло Mer, яке показало зниження міграції пухлини та виживання в мультиформних клітинних лініях гліобластоми. 32 На початку розвитку також є селективні інгібітори тирозинкінази невеликої молекули Mer, які ефективно зменшують фосфорилювання Mer in vitro та in vivo. 33
Наші дані забезпечують підтвердження концепції, що Mer є терапевтичною мішенню при ОМЛ, і, ймовірно, призведе до подальшого розвитку препаратів, націлених на Mer, включаючи додаткові антитіла та/або специфічні інгібітори малих молекул. Ці нові види терапії можуть впливати на пацієнтів з ОМЛ, а також на пацієнтів з іншими злоякісними пухлинами, що характеризуються залежністю від Мер, і можуть забезпечити засіб для поліпшення виживання зі зниженою токсичністю щодо сучасних стандартних схем хіміотерапії.
- Причина, чому авокадо сприяє схудненню
- Причиною того, чому авокадо сприяє схудненню Salud La Revista El Universo
- Самоконтроль допомагає підтримувати вагу
- Інгібітори DPP-4 проти; Логотипи рецепторів GLP-1 після відмови монотерапії
- Недолік сну змінює обмін речовин і сприяє набору ваги Ель Діаріо Васко