Перегляньте статті та зміст, опубліковані в цьому носії, а також електронні зведення наукових журналів на момент публікації
Будьте в курсі завжди, завдяки попередженням та новинам
Доступ до ексклюзивних рекламних акцій на підписки, запуски та акредитовані курси
Іспанська хірургія є офіційним органом Іспанської асоціації хірургів (AEC) та Іспанського товариства торакальної хірургії (SECT), обидва наукові товариства охоплюють більшість загальних та грудних хірургів, а також інші субспеціальності іспанської хірургії. Журнал є найкращим показником технічного та концептуального розвитку іспанської хірургії таким чином, що на його сторінках, подібно до еволюції, яку пережила хірургія у світі, все більше уваги приділяється біологічним та клінічним аспектам хірургічної патології, перевищуючи таким чином оперативну дію, яка в минулому була головним акцентом уваги в цій галузі медицини. Зміст журналу структуровано за розділами «Оригінали», «Огляди», «Клінічні примітки» та «Листи до редактора», а статті відібрані та опубліковані після ретельного аналізу відповідно до міжнародних стандартів.
Індексується у:
SCIE/JCR, Index Medicus/Medline, IBECS, IME
Слідкуй за нами на:
Фактор впливу вимірює середню кількість цитат, отриманих за рік за твори, опубліковані у виданні протягом попередніх двох років.
CiteScore вимірює середню кількість цитат, отриманих за опубліковану статтю. Читати далі
SJR - це престижна метрика, заснована на ідеї, що всі цитати не рівні. SJR використовує алгоритм, подібний до рейтингу сторінок Google; є кількісним та якісним показником впливу публікації.
SNIP дозволяє порівняти вплив журналів з різних предметних областей, виправляючи відмінності у ймовірності цитування, які існують між журналами різних тем.
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Вступ
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Вступ
- Методологія
- Гістопатологія
- епідеміологія
- Клініка та діагностика
- Лікування
- Висновки
- Конфлікт інтересів
- Бібліографія
Аденокарцинома (АДК) анального каналу - рідкісна сутність, яка представляє 5% усіх аноректальних новоутворень та 1,5% шлунково-кишкових пухлин. За даними Всесвітньої організації охорони здоров’я, можна виділити 3 типи: перший походить із перехідної слизової оболонки верхнього каналу, другий походить від анальних залоз (проток), а останній - від хронічної перианальної нориці. Пацієнти з АЦП анального каналу мають вищий відсоток запущеного захворювання, віддалені метастази та загальну виживаність, ніж у хворих на плоскоклітинний рак. Мізерна опублікована казуїстика щодо цього новоутворення свідчить про відсутність повністю перевіреної схеми терапії. Більшість авторів виступають за лікування неоад'ювантної хіміотерапії (ЕПТ) з подальшою радикальною операцією. Метою цієї статті є огляд існуючої літератури щодо клініко-патологічних характеристик та управління АЦП анального каналу.
Аденокарцинома (АДК) анального каналу є рідкісним захворюванням, яке охоплює лише 5% усіх аноректальних новоутворень та 1,5% усіх пухлин шлунково-кишкового тракту. Всесвітня організація охорони здоров’я класифікує анальний АЦП на 3 типи: перший може виникати із слизової оболонки перехідної зони у верхньому каналі, другий - з анальних залоз (проток), а останній може розвиватися в середовищі хронічної аноректальної нориці. У пацієнтів з АЦП анального каналу високий рівень тазової недостатності, віддалене метастазування та нижча загальна виживаність, ніж у хворих на епідермоїдну карциному. Через обмежену кількість випадків захворювання на цю неоплазію стратегії управління не були чітко сформовані. Більшість авторів суміжних досліджень рекомендують передопераційну хіміорадіотерапію (ЕПТ) з подальшою радикальною операцією. Метою цього дослідження є огляд особливостей клінікопатології та управління АЦП анального каналу.
Анальний канал є кінцевою частиною товстої кишки і відповідає трубчастій структурі 3-4 см, що простягається від перианальної шкіри до кінця прямої кишки. У верхній частині він вистелений слизовою оболонкою ректального типу, в середній ділянці (що збігається з лінією пектинеального інтерфейсу) перехідною слизовою оболонкою, а в нижньому відділі - слизовою оболонкою з багатошаровим плоским епітелієм 1 .
Карциноми в цьому регіоні класифікуються як карциноми анального каналу, і закономірності диференціації - це, в основному, базаліоїдний тип (в основному плоский за своєю природою, схожий на омонім у верхніх відділах травного травного тракту), епідермоїдний тип, аналогічний шкірним пухлинам, а також лінія диференціації до аденокарциноми 1 .
Завдання цієї статті - провести огляд літератури з гістопатології, симптомів, діагностики та лікування АЦП анального каналу.
Огляд існуючої літератури був проведений з використанням баз даних MEDLINE Pubmed та Ovid з 1997 по 2012 рр. Використовувались ключові слова: «анальна аденокарцинома», «анальне новоутворення», «карцинома анальної залози», «Карцинома анальної протоки», «анальна канал »,« імуногістохімія »,« хіміотерапія »та« радикальна хірургія ».
Хоча анальний канал короткий, він представляє велику різноманітність пухлин, що відображає анатомічну, ембріологічну та гістологічну складність цієї структури. Забезпечення локалізації цих пухлин та інтерпретація морфологічних знахідок є суперечливим та, часом, дуже важким 2 .
Аденокарцинома (АДК) анального каналу - рідкісна сутність. Більшість із них мають колоректальний фенотип і являють собою пухлини, що походять з верхньої частини анального каналу або з клітин із залозистими характеристиками перехідної зони. Відрізнити справжній АЦП анального каналу від АЦП з низьким вмістом ректального каналу з розширенням анального каналу може бути надзвичайно складно. За даними Всесвітньої організації охорони здоров’я (ВООЗ), можна виділити 3 типи АЦП по відношенню, головним чином, до їх походження: ті, що беруть початок у верхній частині анального каналу, ті, що походять від анальних залоз або проток, та ті, що пов’язані з ними при хронічних аноректальних свищах 2,3:
-
-
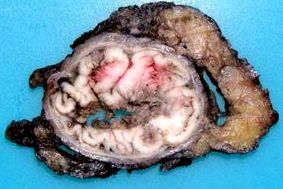
Пухлини, що виникають у слизовій оболонці верхнього відділу анального каналу, є найбільш поширеними (рис. 1) і мають колоректальний фенотип. На надзвичайних стадіях надзвичайно важко відрізнити їх від дистального ректального АЦП. Його основне клінічне значення базується на місцевій здатності до розширення, що стосується подвійного лімфатичного дренажу в напрямку до пахового та стегнового ланцюгів. Звичайний імуногістохімічний фенотип збігається з імуногістохімічним профілем ADC низького ректального сегмента, що складається з CK20 +, CK7- та CDX2 +. CK7 іноді є позитивним, оскільки він також може траплятися виключно при ректальному АЦП, але, як і в цьому випадку, він буде характерним для спільної експресії CK20 2,4,5 .
Поперечна поверхня аденокарциноми (АДК), що походить із слизової оболонки верхнього сегмента анального каналу з окружним та ендолюмінальним зростанням.
Послідовні поперечні зрізи еволюціонулого внутрішньомурального АЦП анальних залоз А) середньої 1/3 анального каналу і близько до променевого краю, і Б) дистальної частини анального каналу з інфільтрацією перианальних м’язів.
Невпорядкована та інфільтративна канальцева проліферація залози, що лежить в основі неопухолевої плоскої слизової оболонки анального відділу при ендоскопічній біопсії АЦП анальних залоз (гематоксилін та еозин × 10).
А) Підслизовий новоутворений залозистий компонент в АЦП анальних залоз (гематоксилін та еозин × 20). Б) АЦП анальних залоз з позитивною імуноекспресією в залозах на СК7 (цитокератин 7 × 10). В) АЦП анальної залози негативний на CK20 (цитокератин 20 × 10). D) CDX2 негативний ADC анальної залози (CDX2 × 10).
Нарешті, АЦП, пов’язаний із хронічними колоректальними свищами (вродженими або набутими), тривалої еволюції (10-20 років), як правило, є вторинним щодо хронічних запальних процесів, таких як хвороба Крона або інші розвинені доброякісні перианальні захворювання. Іноді нориці є вторинними щодо розширення залоз анального каналу або його проток, і морфологія та імуногістохімія пухлини будуть ідентичними аналогічним характеристикам АЦП анальної залози/протоки. Джонс і Морсон 9 припустили, що деякі з цих асоційованих з фістулою карцином походять від вродженого дублювання дистального кінця задньої кишки (задньої кишки). Як правило, вони приймають добре диференційований муцинозний АЦП, але точне гістогенетичне походження часто неможливо продемонструвати і може належати до будь-якого з попередніх підтипів. Крім того, його слід відрізняти від АЦП прямої кишки з низьким вмістом муцину. У цьому сенсі імуногістохімічне дослідження (CK20, CK7 та CDX2) може бути змінним, і лише поєднуючи морфологічні, імунофенотипові та клініко-еволюційні характеристики, можна вважати те чи інше походження 2,4,5,7–9 .
Пухлини анального відділу - це рідкісні новоутворення шлунково-кишкового тракту, на які припадає 5% всіх аноректальних новоутворень та 1,5% шлунково-кишкових пухлин. Мікроскопічні підказки при пухлинах анального каналу поступово змінювались протягом багатьох років. Збільшення досвіду та підтримки імуногістохімічних методів та молекулярних досліджень призвели до численних змін у номенклатурі. Найбільш поширеним ураженням як анального каналу, так і перианальної шкіри є плоскоклітинний рак, який становить від 70% до 80% 10–13. На анальний АЦП припадає близько 10% усіх злоякісних анальних уражень (5-19%): він має більш агресивний природний анамнез, ніж плоскоклітинний рак, з меншим виживанням і вищими показниками рецидивів, як місцевих, так і віддалених 2,6,10, 13– 15 .
Хоча хороші результати були описані у пацієнтів з новоутвореннями, які виявляються на ранніх стадіях еволюції, клінічна схожість з іншими доброякісними захворюваннями та нижча експресія пухлинного компонента в слизовій зазвичай є причинами, що затримують діагноз і, отже, збіднюють прогноз 16. У пацієнтів з АЦП анального каналу більший відсоток спостерігається із запущеним захворюванням, віддаленими метастазами і, як наслідок, меншою загальною виживаністю проти плоскоклітинного раку. Дані Національної бази даних ракових захворювань (NCDB) показують, що 9,8% пацієнтів з анальним АЦП мають стадію IV при презентації порівняно з 5% плоскоклітинних карцином. Таким же чином віддалені ураження спостерігаються у 28,1% пацієнтів з АЦП порівняно з 11,8% плоскоклітинних. П'ятирічна виживаність у пацієнтів з АЦП гірша на всіх стадіях, ніж у пацієнтів з плоскоклітинним раком, що підтверджує більшу різницю у стадії IV (13% для пацієнтів з АЦП і 29% для хворих з плоскоклітинним раком). .
Вік презентації становить приблизно шосте десятиліття життя, з рівним розподілом за статтю 3,14. Запропоновано безліч факторів ризику, таких як ВПЛ та ВІЛ, тютюн та імунодепресія 10,17. Наявність хронічних перианальних нориць, пов'язаних із хворобою Крона чи ні, є важливим фактором ризику, особливо коли вони перевищують 10-річну історію 17,18. Венерична лімфогранулема (LGV), як причина проктиту, може спричинити перианальний стеноз та свищі, а також пов'язана з підвищеним ризиком ректального АЦП 19 .
Клініка та діагностика
Клінічні прояви, як правило, неспецифічні. У пацієнтів може спостерігатися біль, ущільнення, абсцеси, свищі або відчутна маса. Інші симптоми включають кровотечу, свербіж, кров’янисті виділення, випадання та втрату ваги 6,13. У серії Клайн та співавт. 20, 15% пацієнтів протікали безсимптомно. Типово наявність перианальної нориці з еволюцією понад 10 років або наявність рецидивуючих свищів навіть після операції 6 .
Рання діагностична підозра має вирішальне значення, щоб уникнути затримки діагностики та лікування. Хоча клінічні характеристики можуть змусити нас підозрювати цей тип пухлини, остаточний діагноз можна встановити лише за допомогою біопсії та гістологічного дослідження. При запущеному свищевому захворюванні незрозуміло, чи слід проводити біопсію з анального каналу поблизу внутрішнього відділу язика або шляхом кюретажу зовнішнього відділу нерва 17 .
Крім того, слід дослідити пахові аденопатії, оскільки, як зазначалося раніше, це агресивні ураження з високою здатністю до місцевої та віддаленої інвазії. Місцеве поширення має тенденцію бути більшим у тих пухлинах, що походять із залоз анального каналу або свищевих шляхів, оскільки, будучи розташованим поза стінки кишечника, розповсюдження починається з більш розвиненого положення.
Інші діагностичні методи вивчення його місцевого та віддаленого розширення включають ендоанальне ультразвукове дослідження, магнітно-резонансну томографію тазу та комп’ютерну томографію 17,18 .
Дефіцитна опублікована казустика щодо АЦП анального каналу свідчить про відсутність повністю перевіреної терапевтичної схеми. До 1990-х років більшість авторів рекомендували радикальну хірургічну операцію (абдоміноперинеальна ампутація [AAP]) як обраний спосіб лікування АЦП анального каналу 21–23 .
У ретроспективному аналізі 192 хворих на рак анального каналу, які проходили лікування в Університеті Міннесоти, Klas et al. 24 описують свій досвід роботи з 36 пацієнтами з діагнозом АЦП. Двадцять два (61%) були проліковані лише хірургічним шляхом (6 ПАА та 16 місцевих резекцій) та 14 (39%) хірургічним втручанням з подальшою хіміотерапією (ЕЛТ). П'ятирічна виживаність та місцеві рецидиви становили 63 та 21% відповідно. Вони не порівнювали терапевтичні методи між собою через недостатню кількість пацієнтів. Хороші результати вони пояснюють тим, що більшість уражень (78%) були меншими за 5 см, і захищають лікування до- або післяопераційною ЕПТ для більших уражень (> 5 см).
Ретроспективне багатоцентрове дослідження, яке включає 82 пацієнта з діагнозом Анальний АЦП, які отримували лікування в різних європейських центрах 3, рекомендувало комбіновану ЕПТ як найкраще лікування, резервуючи радикальну хірургічну операцію (ПСА) лише як порятунок. У цьому дослідженні пацієнти отримували комбіновану ЕПТ, променеву терапію (РТ) плюс хірургічне втручання або лише хірургічне втручання. Загальна виживаність та відсутність захворювань була вищою у тих пацієнтів з ЕПТ, порівняно з тими, хто страждав від РТ, плюс хірургічне втручання або лише операція. Багатофакторний аналіз показав, що стадії T і N, гістологічна оцінка та терапевтична модальність є незалежними прогностичними факторами виживання. Однак у цього дослідження є чимало недоліків: неоад'ювантна терапія не застосовувалась в жодній групі, ад'ювантна хіміотерапія не застосовувалась після операції, пацієнти, які увійшли в групу РТ та хірургічного втручання, були значно старшими за пацієнтів у комбінованій групі ЕПТ та у 75 років % оперованих пацієнтів перенесли місцеву резекцію. Ці фактори можуть бути причиною високого ступеня місцевих та віддалених рецидивів у групі з РТ та хірургічним втручанням.
Папагікос та ін. 15 досліджували 16 пацієнтів з анальним АЦП, яким лікували РТ із хіміотерапією або без неї з лікувальною метою. Результати цього лікування порівнювали з групою пацієнтів з плоскоклітинним раком, які отримували ЕЛТ. Середнє спостереження становило 45 місяців для пацієнтів з АЦП та 44 для пацієнтів з епідермоїдом. Хоча у пацієнтів з плоскоклітинним раком були більш розвинені первинні пухлини, місцеві та віддалені рецидиви були значно вищими у пацієнтів з АЦП. Крім того, 5-річне виживання без хвороби після ЕПТ становило 19% у пацієнтів з АЦП порівняно з 77% у пацієнтів з плоскоклітинним раком. Це дослідження робить висновок, що остаточне лікування ЕПТ, яке виявилося корисним при плоскоклітинних пухлинах, має поганий місцевий контроль та велику кількість віддалених рецидивів у пацієнтів з АЦП. Вони рекомендують передопераційну ЕПТ з подальшим AAP, щоб максимізувати тазовий контроль захворювання. Ад'ювантна хіміотерапія може розглядатися при мікрометастатичній хворобі.
Ретроспективне дослідження Лі та співавт. 25, який включає 49 пацієнтів з АЦП анального каналу, робить висновок, що ААП разом із ЕПТ є рекомендованим лікуванням. П'ятирічна виживаність у пацієнтів лише з АРА, ЕПТ, АРА плюс ЕПТ та без будь-якого лікування становила 34,4, 0, 37,5 та 0% відповідно.
Чанг та ін. 6 демонструють серію з більш ніж 20-річним досвідом у своїй серії з 34 пацієнтів, у яких потенційно виліковних лікували за допомогою місцевої хірургічної операції з подальшою RT або CRT, або радикального хірургічного лікування (PSA), а також перед- або післяопераційної ЕЛТ. Виживання без хвороб становило 13 місяців після місцевої резекції та 32 місяці після радикальної операції, а загальна 5-річна виживаність становила 43% для місцевого лікування та 63% для пацієнтів, які отримували радикальну операцію (табл. 1).
- Некардіольні аспекти; gicos стенозу a; rtica в м; s старший; Я переглянув; n Іспанський журнал
- Операція брахіопластики для зменшення контуру рук
- Екстремальна пластична операція Брітні Спірс, яка змінила її обличчя
- Близько 40% дорослого населення Іспанії має надлишкову вагу, а 21% страждає ожирінням
- ЗЕРНОВІ - Іспанська асоціація виробників зернових