Предмети
Ця стаття оновлена
Резюме
Вступ
Ожиріння набуло масштабів епідемії у всьому світі, щорічно щонайменше 2,8 мільйона людей помирають внаслідок надмірної ваги або ожиріння (ВООЗ). Ожиріння також є найважливішим фактором ризику інсулінорезистентності, серцево-судинних захворювань та діабету 2 типу (T2D) 1. Пацієнти з T2D зазвичай гіперглікемічні та страждають на такі ускладнення, як гіпертонія, інсульт, атеросклероз та рак 2. Стратегії, що зменшують ожиріння, обіцяють зменшити смертність та покращити якість життя постраждалих людей.
Ми показали, що системне введення білірубіну підвищує чутливість до інсуліну за рахунок придушення стресу та запалення ER у мишей DIO 35. Зараз ми розширили ці спостереження та дослідили, чи регулює білірубін метаболізм ліпідів, як це спостерігається у пацієнтів із хворобою Гілберта 34, і чи регулює білірубін рівень адипокіну в сироватці крові у мишей DIO. Ми також оцінили довгострокові наслідки лікування білірубіном на обмін ліпідів та рівень адипокіну через 7 тижнів після завершення лікування білірубіном.
Результати
Введення білірубіну зменшує масу тіла та покращує резистентність до інсуліну у мишей DIO
Повний розмір таблиці
( до ) Печінкова вага мишей DIO + BR, DIO + V та CHOW. ( b ) Епідидимальні ваги жиру від мишей DIO + BR, DIO + V та CHOW. ( c ) Фракції площі вакуолі у печінці мишей DIO + BR, DIO + V або CHOW. ( d ) Діаметри жирових бульбашок (мкм) епідидимальних адипоцитів DIO + BR, DIO + V або CHOW. ( і ) Репрезентативні мікрофотографії H&E фарбування зрізів печінки та жирової тканини від мишей DIO + BR, DIO + V та CHOW. Шкала шкали = 200 мкм. Щонайменше 3 миші тестували в кожній групі; * стор
Рівні ТК у сироватці крові ( до ), ЛПНЩ ( b ), ЛПВЩ ( c ), TG ( d ), лептин ( і ), адипонектин ( F ), Загальний білірубін ( g ) і прямий білірубін ( h ) у мишей DIO + BR, DIO + V або CHOW вимірювали в сироватці відразу після завершення лікування білірубіном. Кожна група містила 3-4 миші; Дані є середнім значенням ± стандартне відхилення; *** стор
Відносна експресія мРНК рецептора інсуліну (Insr) ( до ), SREBP-1 ( b ), Фасн ( c ) та ACC ( d ) у печінці мишей DIO + BR, DIO + V та CHOW, як вимірювали методом RT-PCR аналізу. Значення представляють відносну експресію цільового гена порівняно з експресією ендогенного контролю. ( і ) Експресія білка PPARγ та C/EBPα, визначена в печінці мишей DIO + BR, DIO + V та CHOW методом Вестерн-блот. Гелі проводили в тих самих експериментальних умовах, і показані зрізані плями. ( F ) Відносна експресія білка PPARγ та ( g ) C/EBPα щодо контролю гліцеральдегід 3-фосфатдегідрогенази (GAPDH) (програмне забезпечення NIH ImageJ). Аналізували зразки від 3 особин. Дані є середнім значенням ± стандартне відхилення; *** стор
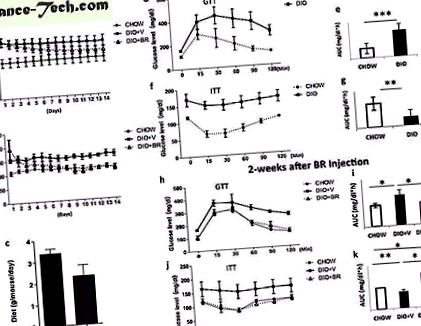
( до ) Вага тіла мишей DIO + BR, DIO + V та CHOW під час 9-тижневого експерименту. ( b ) Рівень глюкози в сироватці крові у мишей DIO + BR, DIO + V та CHOW протягом 9-тижневого експерименту. Печінка ( c ) і придатків придатків жиру ( d ) вимірюється через 7 тижнів після завершення лікування. ( і ) (ліворуч) GTT мишей DIO, виміряних через 7 тижнів після завершення лікування; (праворуч) значення площі під кривою над базовою лінією; ( F ) (зліва) ІТТ мишей DIO, виміряних через 7 тижнів після завершення лікування; (праворуч) значення оберненої площі на кривій нижче базової лінії. Принаймні 3 миші були включені в кожну групу. Дані є середнім значенням ± стандартне відхилення; *** стор
Найдраматичнішим результатом цього дослідження є те, що лікування білірубіном знижувало загальний рівень холестерину у мишей DIO. Зменшення може бути зумовлене зміною рівня ЛПВЩ та ЛПНЩ, хоча скорочення цих елементів не досягло статистичної значущості. Ці висновки узгоджуються з спостереженнями у осіб з синдромом Гілберта в тому, що незначно підвищений рівень білірубіну пов'язаний зі зниженням рівня загального холестерину, ЛПНЩ та тригліцеридів, а також пов'язаний зі зниженим прозапальним станом та зниженою експозицією при окисних станах. 31, 34, 37, 38, 39. Хоча ми не спостерігали зміни концентрації тригліцеридів у мишей, які отримували білірубін, через 14 днів після лікування білірубіном, через 7 тижнів після лікування спостерігалося зниження, що вказує на те, що вплив білірубіну на рівень тригліцеридів може затримуватися. Наше дослідження надало докази того, що екзогенно введений білірубін пов’язаний зі зміненим ліпідним профілем у мишей із ожирінням.
Ми виявили, що введення білірубіну значно знижує рівень лептину у мишей DIO. Вживання їжі мишами DIO, які отримували білірубін, не було фактором під час лікування білірубіном, і різниці у споживанні їжі після закінчення лікування не спостерігалося. Зниження рівня лептину у мишей, які отримували лікування білірубіном, може бути спричинене зменшенням жирової тканини, що підтверджується зниженням експресії SREBP-1. Ще два спостереження мають значення: лептин, як відомо, посилює запалення, регулюючи TNF-α 40, а лікування білірубіном зменшує експресію TNF-α у мишей DIO 35. Тому є розумним припустити, що вплив білірубіну на ожиріння є наслідком зміни синтезу ліпідів, зниження рівня лептину та зменшення продукції TNF-α. Що має клінічне значення, білірубін слід досліджувати як потенційне лікування зниження синтезу ліпідів, як пропонують дослідження на людях 34 .
У цьому дослідженні ми виявили, що короткочасне лікування білірубіном було пов’язане зі зниженням загального холестерину та збільшенням PPARγ та адипокінів. Ці результати дають механічні докази того, що змінений білірубін або білірубіновий метаболізм (наприклад, часткові інгібітори UGT1A1 49) можуть бути корисними як терапевтичний підхід для зменшення ожиріння та поліпшення резистентності до інсуліну та толерантності до інсуліну.
Методи
Тварини
Самці мишей C57BL/6 (віком 6 тижнів) були придбані в Інституті генетики та біології розвитку Китайської академії наук (Пекін, Китай). Мишей годували дієтою з високим вмістом жиру (таблиця 1) або стандартною дієтою CHOW (10% калорій з жиру) протягом 24 тижнів до лікування. Комітет з догляду за тваринами Циндаоського сільськогосподарського університету схвалив усі експерименти на тваринах. Методи проводились відповідно до затверджених керівних принципів.
Приготування та введення білірубіну.
Білірубін (Frontier Scientific, Logan, UT) розчиняли в 0,1N NaOH і рН доводили до 7,4 за допомогою HCl. Білірубін вводили внутрішньочеревно по 20 мкмоль/кг (11,7 мг/кг) двічі на день протягом 14 днів. Контрольні миші DIO або CHOW отримували транспортний засіб за однаковим графіком введення.
Моніторинг мишей після лікування.
Рівень сироватки глюкози в крові та вагу тіла мишей вимірювали щодня о 9:00 ранку. Краплю цільної крові (приблизно від 5 до 10 мкл) збирали з мінімального розрізу на хвості з кінця мишачого хвоста та аналізували за допомогою глюкометра Sannuo (San Nuo Inc., Чанша, Китай). Фізичні навантаження мишей (включаючи поведінку, прийом їжі, вживання алкоголю та облизування) спостерігали щодня, як описано 35. Споживання їжі (за винятком випоту) вимірювали протягом 24 годин через 7 днів після лікування та щотижня протягом 7 тижнів після лікування білірубіном.
Внутрішньочеревна толерантність до глюкози (IPGTT) та тест на толерантність до інсуліну (ITT)
Щодо IPGTT, мишей голодували протягом ночі, а потім вводили 2 г/кг розчину глюкози (ip). Для ІТТ мишей голодували протягом 5 годин, а потім вводили 0,75 ОД/кг інсуліну (ip; Eli Lili, Indianapolis, IN). Рівні глюкози в сироватці крові вимірювали через 0, 15, 30, 60, 90 та 120 хвилин після ін’єкції глюкози або інсуліну.
Збір тканин, підготовка сироватки та хімія крові.
В кінці кожного експерименту мишам знеболювали, а кров збирали шляхом ретроорбітальної кровотечі в гепаринізовану трубку. Плазму отримували центрифугуванням і зберігали при -80 ° С для подальшого аналізу. Мишей евтаназували, а печінку та жирові тканини придатка яєчка видаляли, зважували та швидко заморожували у рідкому азоті для подальшого аналізу. Рівні TC, TG, HDL, LDL та білірубіну в сироватці крові вимірювали за допомогою специфічних наборів реагентів (Sigma Aldrich, Saint Louis, MO). Рівні лептину, інсуліну та адипонектину вимірювали методом ІФА (R&D Systems, Міннеаполіс, Міннесота).
Аналіз у реальному часі (RT) -PCR
Експресія рецептора інсуліну, рецептора лептину, аполіпопротеїну A-IV (Apoa4) та SREBP-1 у печінці була кількісно визначена за допомогою RT-PCR-аналізу, як описано раніше [50]. Експресію β-актину кількісно визначали за допомогою RT-PCR у кожному зразку та використовували як ендогенний контроль. Праймери RT-PCR у реальному часі були придбані у Life Technologies (Invitrogen Trading Co., Ltd., Шанхай, Китай).
Вестерн-блот-аналіз
Вміст білка в цілих клітинних лізатах визначали кількісно за допомогою аналізу BCA, і 30 мкг білка від кожного зразка поділяли на 4-12% гелі Bis-Tris (Інститут біотехнології Бейотіме, Хаймен, Китай). Білки переносили на мембрану Hybond-P (GE healthcare, Piscataway, NJ), блокували 5% знежиреного молока та інкубували з наступними первинними антитілами: PPARγ, C/EBPα (Abcam, США). І GAPDH (Санта-Крус) Biotechnology Inc., США), протягом ночі при 4 ° C. Плямки зондували з міченими пероксидазою хрону вторинними антитілами (Sangon Biotech Ltd., Шанхай, Китай) 45 хвилин при кімнатній температурі та візуалізували за допомогою набору для виявлення ECL (Amersham Pharmacia Biotech, Little Chalfont, Великобританія). Інтенсивність кожного сигналу визначали за допомогою програмного забезпечення Image J (NIH).
Фарбування гематоксиліном та еозином (H&E)
Імуногістохімію печінки мишей та жиру епідидиму проводили, як описано [35]. Коротко, зрізи печінки або жирової тканини фіксували протягом ночі у 10% забуференному формаліні, вкладали у парафін та розтинали. Гірки замочували у відфільтрованому гематоксиліні протягом 6 хвилин, промивали водою та забарвлювали еозин ще 1-2 хвилини. Зрізи промивали водою та зневоднювали у висхідних спиртових розчинах, промивали ксилолом та встановлювали покривним склом на марковану предметну скляну плівку. Слайди досліджували за допомогою трансфлективного мікроскопа подвійного використання Olympus BX51 (Olympus, Токіо, Японія), а зображення знімали цифровою камерою Olympus DP72. Площу вакуолі в загальній площі тканини печінки визначали в печінці за допомогою програмного забезпечення для аналізу Image-Pro Plus. Діаметри окремих жирових клітин (n = 75 у кожній групі) вимірювали за допомогою стандартного програмного забезпечення CellSens (Olympus).
статистичний аналіз
Дані виражаються як середнє значення ± стандартне відхилення. Відмінності між двома групами порівнювали для статистичної значущості за допомогою неспарених t-критеріїв Стьюдента з корекцією Бонферроні. Відмінності вважали суттєвими, коли с
- Зелена кава для схуднення, підвищує обмін речовин та нормалізує рівень цукру в крові
- Вчені CSIC створюють дієту; пастка; що вдається знизити рівень холестерину; поганий; у свиней
- 10 продуктів, що знижують рівень холестерину
- Інсулінова бомба
- Іспанські вчені пов'язують гормон GLP-1 з резистентністю до інсуліну у пацієнтів