МАДРІД, 23 лютого (EUROPA PRESS) -
Дослідники з Технічного університету Мюнхена (TUM), Німеччина, виявили нову стратегію дизайну пептидів - типу молекул, що складаються з коротких ланцюгів амінокислот, що використовуються проти численних, що дозволило б їх приймати всередину, а не шляхом ін’єкції, як і раніше.
Автори цього висновку, опублікованого в останньому номері журналу "Angewandte Chemie International Edition", вважають його "Святим Граалем" хімії цих молекул, які контролюють багато функцій організму як сигнальних молекул.
Найвідоміші приклади включають інсулін, який містить 51 амінокислоту і контролює метаболізм цукру, або циклоспорин, пептид з 11 амінокислот, який, як було показано, запобігає відторгненню органів після трансплантації.
"Пептиди дуже придатні як ліки", - визнав Горст Кесслер, професор Інституту перспективних досліджень ТУМ ім. Карла фон Лінде, оскільки "коли вони виконають свою роботу, вони можуть перероблятися організмом, щоб запобігти їх накопиченню або спричиненню. токсичний комплекс ".
В даний час розслідується близько 500 ліків на основі пептидів, а ті, які вже були затверджені, приносять дохід у мільярди євро, визнають дослідники. Однак той факт, що їх не можна вводити як таблетки, є недоліком для більшості цих видів терапії.
Оскільки білки є важливою частиною раціону, у шлунку та кишечнику містяться незліченні ферменти, що руйнують пептидні зв’язки, тому жоден препарат на основі немодифікованих пептидів не матиме шансів вижити після проходження через травний тракт.
Однак навіть якщо пептидні сполуки можна було б модифікувати для подолання цієї стадії, тоді на них чекала б нова перешкода - клітин кишкових стінок, що перешкоджають їх всмоктуванню в кров. Дві причини, чому такі типи сполук вводяться через ін’єкції.
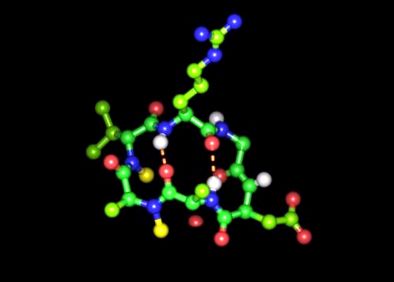
Спочатку команда Гесслера вирішила ці проблеми, використовуючи кільцеподібну пептидну модель, яка включала шість молекул найпростішої амінокислоти - аланіну.
Вчені використовували його для дослідження його оральної доступності для заміщення атомів водню в пептидних зв’язках метильними групами, і вони отримали понад 50 варіацій.
Клітинні тести, проведені у співпраці з дослідниками із Ізраїлю, показали, що лише певні варіанти пептидів всмоктуються дуже швидко. "Здається, що циклічні гексапептиди зі специфічною структурою можуть використовувати існуючу транспортну систему", - говорить професор Кесслер.
Команда вибрала рецептори інтегрину, які контролюють різноманітні функції клітинної поверхні, як мішень для своїх пептидів. Послідовність трьох амінокислот аргініну, гліцину та аспарагінової кислоти є ключовою для зчеплення з цими рецепторами. Співробітники Kessler включили ключові послідовності в різні позиції у своєму модельному пептиді, створюючи таким чином нові варіанти.
Однак і негативно заряджений бічний ланцюг аспарагінової кислоти, і позитивно заряджений аргінін виявились критеріями елімінації при використанні транспортної системи. Однак команді вдалося замаскувати заряджені групи обох амінокислот захисними групами.
ВІДНОВИТИ ФАРМАКОЛОГІЧНИЙ ЕФЕКТ, КОЛИ ВИ ПРИБІГТЕ В ВАШЕ ПРИЗНАЧЕННЯ
Хоча з цією альтернативою пептид спочатку втрачає здатність зв'язуватися з молекулою-мішенню, якщо вибрати правильні захисні групи, вони зможуть знову відокремлюватися ферментами, які є всюдисущими в крові. І фармакологічний ефект відновлюється при досягненні пункту призначення.
Клітинні тести показали, що новий гексапептид має біологічну дію, оскільки в низьких дозах він стимулює ріст судин. Коли мишей годують гексапептидом у масці, ефект такий же, як і у тих, яким вводили гемапептид, що не маскувався.
"У минулому експерти розглядали доступність пероральних препаратів на основі перорального препарату як" святий грааль пептидної хімії ". І наша робота надає стратегію вирішення проблем стабільності, засвоєння в організмі та біологічної ефективності. З них сполуки ", - говорить Кесслер.
Насправді він впевнений, що в майбутньому ця стратегія може значно спростити створення пептидних препаратів, "які можна легко вводити у вигляді рідини або таблетки".
- Cient; фізики створюють математичну модель; щоб схуднути, і з ними можна проконсультуватися в Інтернеті
- Бісакодил (оральний та ректальний) Cigna
- Німці побоюються війни між НАТО і Росією
- Британські вчені виявили ефективний трюк для схуднення HISPANTV
- Німецькі вчені виявляють, що Віагра може допомогти вам схуднути