Фабіола Ернандес-Росас 1, Хуан Сантьяго-Гарсія 2 *
1 Докторант, Інститут біологічних досліджень, Університет Веракрузани з біомедичних наук, Інститут біологічних досліджень.
2 Старший науковий співробітник біологічних досліджень, Інститут біологічних досліджень, Університет Веракрузани.
* Листування: Хуан Сантьяго-Гарсія
Інститут біологічних досліджень, Університет Веракрузани
Електронна пошта: [електронна пошта захищена]
Анотація
Циркадні ритми - це біологічні ритми тривалістю близько 24 годин, вони регулюють нашу щоденну метаболічну, гормональну та поведінкову активність. Вони встановлюються завдяки внутрішній транскрипційній активності групи генів, званих тактогенами, які ритмічно експресуються в мозку та периферичних тканинах. Недавні епідеміологічні дослідження показують, що порушення циркадного ритму є фактором ризику розвитку раку у людей. Цікаво, що у мишей-мутантів гена годинника Per2 було виявлено пухлини. За допомогою цих доказів були проаналізовані біопсії різних типів раку у людини, які показали, що експресія генів Per1, Per2 або Per3 значно знижена порівняно з нормальною тканиною. У цій статті ми розглядаємо дані, що свідчать про взаємозв'язок між змінами циркадних ритмів та експресією годинникових генів із розвитком раку.
Вступ
Життя - явище ритмічне. Діяльність і функції живих істот проявляються як періодичні або ритмічні варіації, а не як безперервний процес. Ці варіації відомі як біологічні ритми. У природі спостерігаються різноманітні біологічні ритми; ті, у яких періодичність менше 24 годин, називаються ультрадіаками, такі як: споживання їжі, частота серцевих скорочень, відпочинок та активність тощо Зі свого боку, біологічні ритми з періодичністю близько 24 годин відомі як циркадні, такі як: цикл сну та неспання, вивільнення певних гормонів тощо. У той час як біологічні ритми з періодичністю, що перевищує одну добу, називаються інфрадіанними, як, наприклад, менструальний цикл, еструсний цикл, сплячка серед інших.
У ссавців циркадні ритми породжуються центральним або «головним» біологічним годинником, розташованим у гіпоталамічних структурах, що називаються супрахіазматичними ядрами (NSQ) в центральній нервовій системі, і годинниками, розташованими в клітинах різних тканин, відомих як осцилятори., 2]. Разом ці годинники є системами, здатними генерувати часовий порядок в діяльності організму, вони коливаються з регулярним періодом і використовують ці коливання як внутрішню часову довідку для регулювання біологічного ритму багатьох функцій організму, таких як: сон і пробудження, відпочинок та активність, температура тіла, артеріальний тиск, серцевий викид, споживання кисню, рідинний баланс та секреція залоз внутрішньої секреції [1,3]
Гени годинника та молекулярний механізм циркадного годинника
Дослідження мутагенезу, проведені у плодової мухи (Drosophila melanogaster), дозволили ідентифікувати мутантів-мутантів із змінами в циркадному ритмі. Характеристика та аналіз цих мутантів дозволили виявити невелику кількість генів, що беруть участь у генерації та підтриманні циркадного ритму у цих комах. Цю групу генів називали годинниковими генами або «годинниковими генами». Згодом гомологічні гени клонували у ссавців та ідентифікували нові годинникові гени у мутантних хом'яків або мишей. У ссавців описано щонайменше дев'ять тактових генів: Per1, Per2, Per3, Cry1, Cry2, Clock, Bmal1, казеїнова кіназа Ie (CkIe) та Rev-Erb_ [1].
Молекулярний механізм центрального циркадного годинника та периферійних циркадних генераторів передбачає взаємодію позитивних та негативних сигналів, які регулюють ритмічну транскрипцію годинникових генів. Ця група генів відповідає за контроль циркадної активності у всіх живих істот [1,4]. Експресія цих генів регулюється за допомогою двох транскрипційних петель активації/репресії. Петля позитивного сигналу контролюється генами Clock та Bmal1, тоді як негативна петля - генами Per і Cry [1,5].
Найбільш широко прийнятою моделлю для пояснення молекулярного механізму циркадного годинника у ссавців є миша. Якщо ми розмістимо функціонування апарату центрального циркадного годинника (NSQ) миші в контексті цілодобового цілодобового дня, відбувається наступне: на початку циркадного дня (рано вранці) транскрипція генів Per та Cry є активується гетеродимерами, які утворюють білки CLOCK: BMAL1, які зв’язуються з регуляторними послідовностями, відомими як Е-бокси, розташовані в промоторах генів Pery Cry для активації їх транскрипції. Посланці цих генів перекладаються у відповідні їм білки (PER та CRY) у цитозолі. Ближче до середини добового дня (початку ночі) білки PER та CRY асоціюються та утворюють гетеродимери (PER: CRY), які фосфорилюються ферментом CKI, а потім переносяться в ядро, де накопичуються. PER: CRY гетеродимери секвестер ГОДИННИК: гетеродимери BMAL1, перешкоджаючи їх зв’язуванню з промоторним сайтом генів Per і Cry, інгібуючи їх транскрипцію. Отже, білки PER та CRY діють як негативні регулятори [1,5].
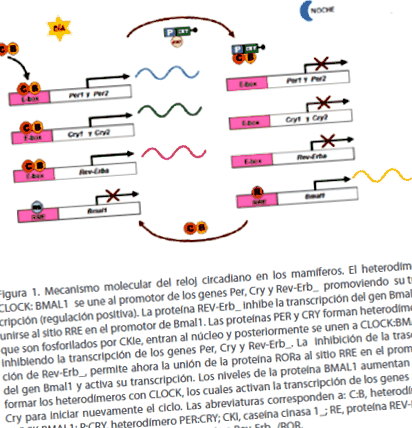
Гетеродимери ГОДИННИК: BMAL1 також активують транскрипцію гена, який кодує ядерний рецептор-сироту, відомий як Rev-Erb_. Потрапляючи в ядро, білок REV-ERB_ зв'язується з промотором гена Bmal1 і пригнічує його транскрипцію, викликаючи зниження рівня мРНК Bmal1. З іншого боку, коли димери білків PER: CRY потрапляють в ядро і інгібують транскрипцію Per і Cry, вони також інгібують транскрипцію Rev-Erb_ і опосередковано стимулюють транскрипцію гена Bmal1. За відсутності REV-ERB_ білок RORa (RAR-пов'язаний рецептор-сирота) зв'язується з промотором гена Bmal1 та активує його транскрипцію. Отже, рівні білка BMAL1 зростають наприкінці ночі, сприяючи утворенню гетеродимерів CLOCK: BMAL1, які активують транскрипцію генів Per і Cry, щоб знову запустити цикл (Фігура 1) [1,5].
Фігура 1. Молекулярний механізм циркадного годинника у ссавців. ГОДИННИК: Гетеродимер BMAL1 пов'язується з промотором генів Per, Cry та Rev-Erb_, сприяючи їх транскрипції (позитивна регуляція). Білок REV-Erb_ інгібує транскрипцію гена Bmal1 шляхом зв'язування з сайтом RRE на промоторі Bmal1. Білки PER та CRY утворюють гетеродимери, які фосфорилюються CKIe, потрапляють у ядро і згодом зв'язуються з CLOCK: BMAL1, інгібуючи транскрипцію генів Per, Cry та Rev-Erb_. Інгібування транскрипції Rev-Erb_ тепер дозволяє зв'язувати білок RORa з сайтом RRE в промоторі гена Bmal1 та активує його транскрипцію. Рівні білка BMAL1 зростають, утворюючи гетеродимери з CLOCK, які активують транскрипцію генів Per і Cry, щоб знову запустити цикл. Абревіатури відповідають: C: B, CLOCK: BMAL1 гетеродимер; P: CRY, гетеродимер PER: CRY; CKI, казеїнкіназа 1_; RE, REV-ERB_ білок; R, білок RORa; RRE, Елемент відповіді на Rev-Erb_/ROR.
Протилежні ефекти димерів CLOCK: BMAL1 та PER: CRY у транскрипції забезпечують коливання месенджерів Per та Cry коливань у протифазі з месенджером Bmal1. Максимальний і мінімальний рівні експресії цих генів відбуваються з періодичністю близько 24 годин, таким чином вони встановлюють циркадний ритм в організмах. Наприклад, у NSQ максимальний пік експресії Bmal1 припадає на середину ночі, тоді як максимальний пік месенджерів Per та Cry припадає на полудень [1].
Циркадні годинники в периферичних тканинах
Циркадні годинники або осцилятори існують у найрізноманітніших периферичних тканинах, подібних до тих, що працюють у нейронах NSQ [14,15,16]. І нейрони NSQ, клітини периферичної тканини, і культивовані фібробласти демонструють часові закономірності експресії генів годинника. Серія останніх досліджень показала, що гени Per, Cry та Bmal1 демонструють ритмічну експресію в різних тканинах, таких як: печінка, серце, легені, нирки, культивовані фібробласти та інші [1,2,15,16]. Однак, на відміну від NSQ, циркадні коливання в експресії годинникових генів у тканинах периферійних ссавців швидко зменшуються, коли вони зберігаються як експланти в культурі. У периферичних тканинах щурів циркадна експресія годинникових генів втрачається протягом 2–7 днів, тоді як у культивованих фібробластах через 3–4 цикли [15,17]. На відміну від них, циркадна експресія тактових генів у культивованих NSQ зберігається більше одного місяця [17,18]. Це призвело до постулату, що NSQ є головним або центральним годинником із власним циркадним ритмом, який через різні нервові та гуморальні сигнали синхронізує активність циркадних генераторів, розташованих у периферичних тканинах та інших областях мозку.
З іншого боку, було показано, що різні сигнали, такі як введення аналогів глюкокортикоїдів та зміна графіка годування, змінюють циркадні закономірності експресії тактових генів у печінці та інших периферичних тканинах, але не впливають на їх експресію у NSQ [15-17, 19, 20]. Це свідчить про те, що за певних метаболічних або фізіологічних умов місцевий контроль ритму периферичних генераторів може бути відокремлений від контролю NSQ для адаптації до конкретних умов, не впливаючи на центральний годинник. Це, в свою чергу, дозволить оптимізувати клітинну фізіологію таким чином, що експресія певних генів обмежується, коли потрібні їх продукти. Коли ці конкретні умови зникають, NSQ може синхронізувати периферійні генератори назад до їх нормального ритму [2,16,17,19].
Гени годинника та рак
Для того, щоб зрозуміти функцію кожного з тактових генів у молекулярному механізмі, відповідальному за генерацію циркадних ритмів, була розроблена серія мутантів або нокаутованих мишей, у яких функція цих генів. Ці миші-мутанти демонструють втрату циркадного ритму рухової активності та заковтування води. Дивовижна знахідка сталася при розробці мутантних мишей гена годинника Per2, які, крім втрати циркадного ритму, розвинули гіперплазії слинних залоз, лімфоми та шкірні тератоми [13]. Обробляючи мутантних мишей Per2 гамма-випромінюванням, агентом, який пошкоджує ДНК, розвиток пухлини пришвидшився, викликаючи передчасну загибель цих гризунів. На відміну від цього, цей фенотип не спостерігався у контрольних (немутантних) мишей, яким проводили таку ж обробку [13].
На основі цих спостережень перед різними дослідницькими групами по всьому світу було поставлено завдання характеризувати експресію годинникових генів у біопсіях різних видів раку у людини. У цих дослідженнях виявлено зниження експресії годинникових генів, зокрема генів Per1 та Per2, при раку молочної залози [21,22], раку легенів [24], раку ендометрія [25], раку передміхурової залози [ 26], рак підшлункової залози [27], серед інших (Таблиця 1).
Таблиця 1. Експресія генів Per у різних типах раку
Щоб спробувати пояснити зменшення експресії генів Per в біоптатах раку, були проаналізовані структури метилювання цих генів, оскільки відомо, що метилювання промоторів у послідовностях CpG становить епігенетичний механізм, який регулює експресію генів. У цьому сенсі було встановлено, що сайти CpG у промоторі гена hPer1 метильовані у понад 50% випадків раку молочної залози, що пояснює зниження рівня їх експресії [22]. Подібне дослідження у пацієнтів із хронічним мієлоїдним лейкозом показало, що метилювання промоторного сайту генів hPer1, hPer2 та hPer3 безпосередньо корелює зі зменшенням експресії цих генів [23,28]. Ці дані свідчать про те, що експресія генів Пер частково контролюється епігенетичними механізмами.
Гени Per1 та Per2 також є супресорами пухлини
Розмноження клітин є важливим процесом формування, відновлення та підтримки належного функціонування всіх тканин та органів в організмі. Гени, відомі як супресори пухлини, відповідають за організацію процесів, що стосуються контролю проліферації та загибелі клітин в організмі. Ці гени діють як негативні регулятори проліферації клітин, коли вони відсутні або неактивні внаслідок мутацій, вони заважають клітині нормально розмножуватися, набуваючи проліферативні властивості, характерні для пухлинних клітин.
Таблиця 2. Вплив змін на експресію генів Per1 та Per2 у клітинних лініях раку
Малюнок 2. Гени Per1 та Per2 беруть участь у контрольних пунктах, які зупиняють проліферацію клітин. Схема показує різні моменти, щодо яких накопичено експериментальні дані про можливу участь генів Per у контролі клітинного циклу. Абревіатури відповідають: Cdk, циклінозалежна кіназа; Банкомат, мутантна атаксія-телангіектазія-кіназа; ATR, пов'язана з білками ATR кіназа; Chk1, кіназа контрольної точки 1; Chk2, кіназа контрольної точки 2; Білок Gadd45a 45 альфа для індукції росту, виявлення та пошкодження ДНК; Cdc25, цикл поділу клітин фосфатаза 25.
Інші недавні дані, отримані Gery et al (2006), показали, що Per1 взаємодіє з ATM та Chk2-кіназами, які беруть участь у механізмах реагування на пошкодження ДНК [24]. Ці кінази мають великий вплив на кілька контрольних пунктів клітинного циклу та на реакцію проти агентів, що пошкоджують ДНК. Коли ATM-кіназа виявляє пошкодження ДНК, вона реагує збільшенням своєї біохімічної активності, яка модифікує інші білки, кожен з яких відповідає за певну реакцію при відновленні пошкодження ДНК, блокуванні клітинного циклу та індукції апоптозу.
Патології, пов’язані з порушеннями циркадного ритму. Людина має низку фізіологічних змін протягом циркадного дня (24 год). Наприклад, гормональні зміни, що відбуваються на початку дня, головним чином на рівні осі гіпоталамус-гіпофіз-наднирники, призводять до викиду катехоламінів у кров із відповідним їх активуючим впливом на органічні функції. Це дозволяє тілу залишатися неспаним та активним завдяки підвищенню м’язового тонусу та нервової діяльності. Вивільнення катехоламінів зменшується протягом ночі, що також зменшує його активізуючий ефект і настає сон - період, коли свідомі інтелектуальні функції скасовуються, поступаючись місцем несвідомим. Отже, цілісність циркадної біологічної структури є критично важливою для ефективного біологічного та когнітивного функціонування.
Перспективи ракової хронобіології та хронотерапії
Висновки
Показано, що зміни циркадного ритму є фактором ризику для розвитку різних патологій, включаючи рак, що свідчить про те, що цілісність циркадного ритму є важливим аспектом для здоров’я. Також було встановлено, що дефекти в експресії певних тактових генів, таких як гени Per, призводять до недоліків у контролі клітинного циклу та реакції на пошкодження ДНК, а також до розвитку пухлин у гризунів . Іншими словами, цілодобовий годинник не тільки організовує різні біологічні та поведінкові процеси, а й відіграє фундаментальну роль у клітинній фізіології. Однак необхідні додаткові дослідження для з’ясування ролі циркадних годин у проліферації клітин, апоптозі та механізмах злоякісної трансформації. Ці дослідження матимуть велике значення, оскільки дозволять отримати цінні знання для розробки нових терапевтичних варіантів проти раку.
Дякую
Національній раді з науки і технологій (CONACYT) за стипендію, призначену Фабіолі Ернандес-Росас (стипендіат №: 223273), та PROMEPSEP за фінансування, надане Хуану Сантьяго-Гарсії (PTC-270).
- Швидке схуднення Valley Medical; Доступні медичні програми для схуднення
- Т; цинічний дозорний вузол в хірургії; a з c; грудне вигодовування в лікарні без
- Годинник Rond Touch зі сталі
- Який тип тіла у вас: яблуко, груша чи пісочний годинник? Новий щоденник
- Swimmo - пульсометр і годинник для плавання, лічильник довжини, годинник для басейну • Swimmo