- Предмети
- Резюме
- Вступ
- Результати
- Зміна глікопаттерну в сироватках крові внаслідок ASD проти TD
- Ідентифікація MBG
- Аналіз онтології генів MBG
- KEGG Pathway and Protein Interaction Network Analysis
- Перевага мотиву послідовності MBG
- Експресія та сиалогікозилювання MBG в окремих зразках сироватки
- Обговорення
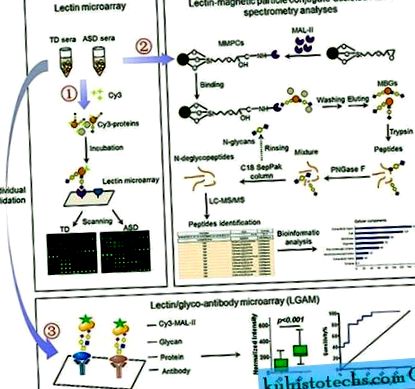
- Матеріали і методи
- Затвердження дослідження
- Предмети
- Збір та підготовка зразків
- Лектинові мікрочипи та аналіз даних
- Мікрочипи сироватки та аналіз даних
- Виділення та перетравлення МБГ
- LC-MS/MS аналіз
- Безмаркетна відносна кількісна оцінка за допомогою розрахунку спектрального індексу
- Видобуток даних та біоінформатика
- Мікрочипи лектину/гліко-антитіла та аналіз даних
- Додаткова інформація
- Додаткова інформація
- Файли PDF
- Додаткова інформація
- Файли Excel
- Додаткові таблиці
- Коментарі
Предмети
- Порушення спектру аутизму
- Біомаркери
- Глюкоміка
Резюме
Протеомічні інструменти забезпечують широкомасштабний автоматизований режим обстеження, керований технологіями, який надає можливість визначити весь протеом у даній рідині тіла без будь-яких попередніх припущень щодо молекул-кандидатів 12. Виходячи з цього, було встановлено, що загалом п’ять пептидних компонентів, що відповідають чотирьом відомим білкам [Аполіпопротеїн (апо) B-100, фактор комплементу H, пов’язаний білок (FHR1), комплемент C1q та фібронектин 1 (FN1)], виявляються вищими для аутизму порівняно з контролем 13. Три потенційні піки біомаркерів показали співвідношення m/z приблизно 4,40, 5,15 та 10,38 кДа, що суттєво диференціювало зразок ASD від контрольної групи при аналізі цілих білків та непептидів після триптичного перетравлення 14 .
Повнорозмірне зображення
Результати
Зміна глікопаттерну в сироватках крові внаслідок ASD проти TD
Конструкція лектинових мікрочипів та результуючі глікопаттерни сироваткових глікопротеїдів, визначені мікрочипами для груп ASD та TD, показані на рис. 2A, B. Вихідні дані були імпортовані в EXPANDER 6.0 для ієрархічного кластерного аналізу (рис. 2 C) . Нормалізовані флуоресцентні інтенсивності (NFI) та особливості зв’язування цукру для кожного з 37 лектинів з обох груп зведені в таблицю S1. В результаті диференціального аналізу п'ять лектинів продемонстрували значні відмінності між групами ASD і TD. MAL-II (Siaα2-3 Gal/GalNAc) та MAL-I (Siaα2-3Galβ-1, 4GlcNAc та Galβ-1, 4GlcNAc) показали найбільш суттєве збільшення NFI (зміна складок = 3,33 та 2,20, p
( ДО ) Конструкція лектинового мікрочипа. ( B ) Зображення білків сироватки, мічених TD та ASD Cy3, зв’язані з мікрочипами лектину. Флуоресцентні зображення сканували за допомогою 70% -ної помножувальної трубки та 100% налаштувань потужності лазера на конфокальному сканері Genepix 40 00B. Частина предметного стекла показана з трьома репликованими масивами лектину. Лектини демонстрували значні відмінності, позначені білими рамками. ( C. ) Ієрархічний кластерний аналіз NFI для 37 лектинів TD-1
5. Зразки вказані в стовпцях, а лектини - у рядках. Колір та інтенсивність кожного квадрата вказують на рівні вираження щодо інших даних у рядку. Червоний, високий; дивіться нижче; чорний, середній. Жовта та блакитна рамки відзначали вищу та нижчу інтенсивність зв’язування лектину в ASD проти сироваток TD. ( D ) Диференціальний аналіз NFI для п’яти лектинів TD-1
( A, B ) Ідентифікація пептидів та відповідних їм глікопротеїдів у сироватках TD та ASD за допомогою LC-MS/MS. ( C. ) Частка N-глікопротеїнів (NY) та O-глікопротеїнів (OY), відомих з бази даних UniProtKB/Swiss-Prot, та прогнозованих глікопротеїнів з потенційними сайтами N-глікозилювання (NP) та потенційними сайтами O-глікозилювання (OP) () D ) Аналіз шляху KEGG ідентифікованого GBM (позначеного червоною зіркою) в каскадах комплементу та коагуляції 60. Червона стрілка, регулювання вгору MBG; зелена стрілка, низьке регулювання GBM в ASD. Аналіз мережі взаємодії білків ідентифікованих GBM (червона куля), які регулювались вгору (червона стрілка) або вниз (синя стрілка) при регуляції ( І ) та негативне регулювання ( F ) процесів реакції стимулу в сироватках ASD. ( G ) Можливі мотиви N-глікозилювання та O-глікозилювання навколо залишків аспарагіну та серину для α2-3-зчепленого доміну сиалільованого глікопептиду. WebLogo згенерував графіки відносної частоти мотиву значущої послідовності. Висоти залишків приблизно пропорційні їх біноміальним ймовірностям.
Повнорозмірне зображення
Аналіз генної онтології MBG
KEGG Pathway and Protein Interaction Network Analysis
Загалом, 184 з 243 визначених MBG були прокоментовані в DAVID Bioinformatics Resources (версія 6.7). Ці GBM були зіставлені в 6 шляхів KEGG із порогами підрахунку ≥5 та значенням Р 30 (додаткова фігура S1). Порівнювали частотно-амінокислотні частоти оточуючих залишків аспарагіну (13 амінокислот в обох термінах), а мотив [AVH] [KR] xNxxNxSxxxY (де "x" означає будь-який залишок, [AVH] та [KR] представляють Було виявлено кілька залишків амінокислот, які могли з’явитися в цьому положенні, і віньєтка вказує на можливий глікозит) як можливий мотив N-глікозилювання навколо аспарагіну (рис. 3G). Цікаво, що мотиви xxxxxxQSDxxYK та xxxxxxHGSxSGx були значно перевизначені (збільшення в рази = 81,62 та 67,07) у даних MBG (рис. 3G), що могло представляти мотиви зв’язаного O-глікозилювання навколо залишків серину для сіалізованого домену глікопептиду до α2-3. Однак для подальшого підтвердження O-глюкозитів у MBG, вам все одно потрібні набагато більш детальні дослідження.
Експресія та сиалогікозилювання MBG в окремих зразках сироватки
Вестерн-блоттінг проводили для перевірки експресії C8B, серотрансферину (TF), C1QA та APOD в окремих зразках сироватки. Як результат, експресія C8B та TF зросла, а експресія C1Q зменшилась у чотирьох випробуваних зразках ASD порівняно з чотирма зразками TD, що відповідало результатам MS (рис. 4А). Однак експресія APOD не суттєво відрізнялася між зразками TD і ASD (рис. 4А). LGAM були розроблені для виявлення α2-3-зв’язаного сиалогікозилювання C8B, TF, C1QA та APOD у 15 окремих зразках сироватки TD та 15 ASD (рис. 4B). Як результат, не виявлено суттєвих відмінностей щодо сиалоглікозилювання C8B, TF та C1QA між двома групами. Однак APOD α2-3-сиолокозилювання значно збільшився у зразках ASD щодо зразків TD (p = 0,004) (рис. 4C). Аналіз кривої ROC показав, що сироваткові рівні α2-3 сіалогікозильованого APOD призводять до AUC 0,88 зі специфічністю 86,7% та чутливістю 80,6% для диференціації ASD від TD) (рис. 4D).
( ДО ) Вестерн-блот-аналіз експресії C8B, TF, C1QA та APOD у чотирьох зразках сироватки TD та чотирьох ASD. ( B ) Скануйте зображення, отримані з LGAM, для TD та ASD сироваток. ( C. ) Блок-графічний аналіз інтенсивності зв'язування для C8B, TF, C1QA та APOD 30 випадків TD та ASD у сироватці крові LGAM. Смужки помилок представляють 95% довірчі інтервали для засобів. Статистично значущі відмінності між групами позначаються значеннями Р ( D ) Аналіз кривої ROC α2-3 сіалогіколікованого APOD для диференціації зразків ASD від зразків TD.
Повнорозмірне зображення
Обговорення
Як правило, сиалова кислота виявляється компонентом олігосахаридних ланцюгів муцинів, глікопротеїдів та гліколіпідів, які займають нередукуючі кінцеві позиції N- або O-гліканів. Рівень сіалової кислоти в сироватці крові пов’язаний із захворюваннями печінки 46, ревматичними захворюваннями 47 та діабетом 2 типу 48. У цьому дослідженні Вестерн-блот-аналіз підтвердив зміну експресії C8B, TF та C1QA, але не експресії APOD, в окремих зразках сироватки ASD та TD (рис. 4А). LGAM виявили суттєво підвищену експресію сіалоглікозилювання APOD α2-3 в окремих зразках сироватки ASD, що значною мірою пояснило різницю в експресії білка APOD між сироватками ASD і TD, та підкреслили, що як MBG, так і їх α2-3 сиалогікозилювання пов'язані з ASD. Аналіз кривої ROC показав, що сіалогікозильований APOD може чутливо і конкретно розрізнити дітей з РАС від дітей з ТД як біомаркерів-кандидатів (AUC = 0,88), і вказав на важливість і необхідність вивчення зміни глікозилювання глікопротеїдів у сироватках для діагностики ASD.
На закінчення, експресія антигенів сіалозил-Т α2-3 була значно збільшена в ASD проти сироваток TD. Всього із сироваток TD та ASD було ідентифіковано 194 та 217 MBG, з них 74 білки були спеціально ідентифіковані або регульовані в сироватках ASD. Біоінформаційний аналіз показав, що аномальний каскад комплементу та аномальна клітинна регуляція реакції на подразник можуть бути новими творцями або маркерами АСД, забезпечуючи нову інформацію для подальших поглиблених досліджень патогенезу АСД. Що ще важливіше, LGAM виявили значно вищу експресію сіалоглікозилювання APOD α2-3 в окремих зразках сироватки ASD, що може служити потенційними біомаркерами для діагностики ASD.
Матеріали і методи
Затвердження дослідження
Збір і використання всіх зразків патології людини для представлених тут досліджень було схвалено Комітетом з етики Північно-Західного університету, Народної лікарні провінції Шеньсі та Четвертого військово-медичного університету (Сіань, Китай). Учасники отримали письмову згоду на збір усієї їх слини та сироватки. Це дослідження було проведено відповідно до етичних вказівок Гельсінкської декларації.
Предмети
Повний розмір таблиці
Схвалення цього дослідження було отримано від Комітету з етики та Комітету з огляду досліджень людини при Університеті Сіань Цзяотун (Сіань, Китай). Усі батьки учасників, які брали участь у дослідженні, дали письмову інформовану згоду. Всі експерименти проводились відповідно до затверджених рекомендацій.
Збір та підготовка зразків
Усі зразки крові відбирала педіатрична медсестра та венозна кров. Кров згущувались при кімнатній температурі протягом 25 хвилин. Потім згусток видаляли центрифугуванням при 1500 g протягом 10 хвилин у холодильній центрифузі. Отриманий супернатант негайно переносять у чисту поліпропіленову пробірку, додану з коктейлем-інгібітором без ЕДТА (інгібітор протеази Halt; Thermo Scientific Pierce Protein Research Products, Рокфорд, Іллінойс, США) при сироватковій концентрації 10 мкл/мл. Вироблену сироватку аликвотировали на невеликі порції, негайно заморозили на сухому льоду і зберігали при -80 ° C. Щоб нормалізувати відмінності між суб'єктами та перенести індивідуальні варіації, об'єднали 50 мкл 50 зразків сироватки від суб'єктів., для лектинових мікрочипів та виявлення LC-MS/MS. Інші 15 зразків з кожної групи зберігались індивідуально для подальшої перевірки.
Лектинові мікрочипи та аналіз даних
Мікрочип лектину отримували та інкубували з флуоресцентними міченими барвниками сироватковими білками Cy3 (GE Healthcare) згідно з попереднім протоколом 50, 51, 52, 53, який детально описаний у додаткових матеріалах та методах. Для виявлення мікрочипів лектину використовували зразки сироватки 50 TD і 50 ASD. Для формування підгруп TD-1 готували двадцять мікролітрів (20 мкл) кожного зразка та 10 зразків у пулі.
5. Отримані зображення аналізували при 532 нм для виявлення Cy3 за допомогою програмного забезпечення Genepix 3.0. Середній фон віднімається, і значення, менші за середній фон ± 2 стандартних відхилення (SD), були видалені з кожної точки даних. Медіана ефективної точки даних для кожного лектину була загально нормована до суми медіани всіх ефективних точок даних для кожного лектину в блоці. Кожну пробу спостерігали послідовно з трьома повторними слайдами, і нормували медіану кожного лектину з 9 повторних блоків, усереднювали і визначали SD. Нормалізовані дані для груп TD та ASD порівнювали згідно з наступними критеріями: зміна кратності ≥1,5 або ≤0,67 вказувала на регулювання вгору або вниз. Відмінності між двома довільними наборами даних перевіряли t-тестом спареного студента за допомогою статистики SPSS 19. Вихідні дані додатково аналізували за допомогою Expander 6.0 (//acgt.cs.tau.ac.il/expander/) для виконання ієрархічної кластеризації аналіз.
Мікрочипи сироватки та аналіз даних
Мікрочипи сироватки отримували, використовуючи 30 окремих зразків сироватки від 15 дітей TD та 15 ASD кожна. Мічений Cy3 MAL-II застосовувався для виявлення специфічної структури цукру в мінімальній кількості зразків сироватки, які іммобілізовані на предметних стеклах, згідно з протоколом виготовлення мікрочипів слини 51 з деякими модифікаціями. Детальна інформація міститься у додаткових матеріалах та методах.
Виділення та перетравлення МБГ
Кон'югати магнітних частинок MAL-II (MMPC) отримували, як описано 54, 55. Два міліграми (
30 мкл (виміряно реактивом Бредфорда) білка із об’єднаних сироваток TD та ASD інкубували з MMPC 54, 55. Отримані глікопротеїни (близько 150 мкг) перетравлювали трипсином та PNGase F, як описано раніше 54, 55, 56. Детальна інформація міститься у додаткових матеріалах та методах.
LC-MS/MS аналіз
МС-аналіз проводили за допомогою мас-спектрометра LTQ Orbitrap XL (Thermo Scientific). Детальні параметри, використані в цьому експерименті, наводяться в додаткових матеріалах та методах. Вихідні дані обробляли за допомогою Proteome Discoverer (версія 1.4.0.288, Thermo Fischer Scientific). Спектри MS/MS шукали за допомогою механізму SEQUEST щодо повної бази даних протеомів UniProt та бази даних забруднень (Випуск 2013_06, 88913 Білкові послідовності). Пошук проводили з такими параметрами: допуск маси попередника 20 ppm; Допуск маси MS/MS 0,6 Da; два пропущені розщеплення триптичних пептидів; змінні модифікації окислення (M), метилтіо (C), пептидні спектральні сірники (PSM) були перевірені за допомогою цільового пошуку в базі даних манок (FDR ≤ 0,01).
Безмаркетна відносна кількісна оцінка за допомогою розрахунку спектрального індексу
Після ідентифікації пептидів було застосовано алгоритм, подібний до ProteinExtractor у ProteinScape, який використовує заданий мінімальний бал пептидів (minPepScore) та мінімальну кількість пептидів на білок (minNrPeps), як описано 57. Серед перелічених білків екстрагували кожен збіг пептидного спектру (PSM). Спектральний індекс (SI) на основі спектрального та пептидного підрахунків розраховували, як описано раніше 58. Кількість необроблених спектральних показників для ідентифікованих білків нормалізували, використовуючи наступні формули (Формула 1 і Формула 2):
де C i - загальна спектральна кількість циклу i; y - усереднений загальний спектральний рахунок усіх пробігів, що порівнюються; N i та R i - нормалізована та необроблена спектральна кількість білка у пробігу i, відповідно. SI,/C i, використовувався для нормалізації загального спектрального підрахунку кожного циклу для зменшення варіабельності циклу до циклу.
Видобуток даних та біоінформатика
Аналіз даних та професійні програмні засоби, що використовуються у цьому дослідженні, докладно описані в Додаткових матеріалах та методах.
Мікрочипи лектину/гліко-антитіла та аналіз даних
Додаткова інформація
Як цитувати цю статтю: Цінь, Ю. та ін. Глікопаттер сироватки та зв'язування глікопротеїдів лектину-II з лектином Maackia amurensis при розладі спектру аутизму. Науковий співробітник. 7, 46041; doi: 10.1038/srep46041 (2017).
Примітка редактора: Springer Nature залишається нейтральним щодо юрисдикційних вимог на опублікованих картах та приналежності до інституцій.