предметів
Омолоджуючі кровотворні стовбурові клітини залежать від джерела їжі амінокислоти валін - знахідка, яка використовується для зменшення токсичності трансплантації кісткового мозку у мишей.
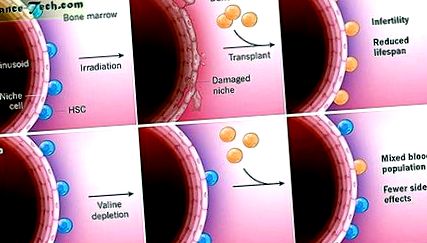
Трансплантація кісткового мозку є остаточним методом лікування багатьох порушень крові та клітин крові, оскільки гемопоетичні стовбурові клітини (HSC), які знаходяться в поглибленнях у кістковому мозку, можуть омолодити будь-яку лінію клітин крові. До трансплантації реципієнти, як правило, отримують хеморадіо - стабілізаційне лікування, що включає хіміотерапію з опроміненням цілого тіла або без нього. Це лікування усуває хворі HSC, видаляє ніші кісткового мозку, щоб бути сприйнятливими до HSC донорів, і пригнічує імунну систему, щоб запобігти відторгненню донорських клітин. Але кондиціонування може спричинити глибоку імунодепресію, пошкодження тканин і навіть смерть, а також спричиняє довгострокові побічні ефекти, такі як безпліддя. Writing in Science, Taya et al. 1 показано, що проста елімінація амінокислоти валіну з раціону здорових мишей веде до виснаження природних HSC, що вказує на менш токсичний спосіб для організму модифікувати стан трансплантації кісткового мозку.
Докази 2 показали, що негемопоетичні клітини в кістковому мозку відіграють вирішальну роль у підтримці здоров’я HSC або за допомогою безпосереднього контакту, або шляхом виведення розчинних факторів. Тая та співавт. досліджували, чи можуть вони виявити вразливі місця, які можуть бути використані при трансплантації кісткового мозку, порушуючи фактори в ніші HSC. Нахилені в роботі 1940-х років про те, що гемопоетичні клітини в кістковому мозку особливо чутливі до депривації білка 3, автори спостерігали значне збагачення розчинних амінокислот у кістковому мозку порівняно з периферичною кров'ю і виявили, що негемопоетичні клітини в кістковому мозку виділяються багато амінокислот.
На основі цього висновку дослідники запитали, яка з 20 амінокислот може знадобитися для функції HSC, якщо така існує. Окремі амінокислоти з HSC зберігались одна за одною in vitro і виявили, що для росту HSC необхідні валін та цистеїн.
Валін, але не цистеїн, є "незамінною" амінокислотою - немає метаболічних шляхів, які синтезують валін у людини чи миші. Тая та співавт. тому вони досліджували вплив обмеження дієтичного валіну на вироблення крові in vivo. Здорових мишей протягом чотирьох тижнів годували дієтою без валіну і виявили, що кількість білих кров'яних клітин, еритроцитів і HSC протягом цього періоду зменшувалася. Далі автори оцінили придатність HSC від мишей, що виснажили валін, шляхом вимірювання здатності клітин конкурувати з нормальними HSC при трансплантації реципієнтам, обумовленим радіацією. Автори виявили, що HSC, очищені від позбавлених валінових мишей, погано працювали в цьому аналізі.
Оскільки виснажені валіном HSC, схоже, функціонують погано, дослідники запитували, чи може депривація валіном порушити природні HSC до такої міри, що HSC донорів зможе зцілити, - по суті, перевіряючи здатність валінової депривації самостійно розміщувати реципієнта для трансплантації. Дослідники протягом двох тижнів годували мишей дієтою без валіну, а потім вводили тваринам здорового донора HSC, перш ніж реципієнти поступово повернулися до повноцінного раціону. Через дванадцять тижнів після трансплантації приблизно 10-15% зрілих клітин крові були присутніми у мишей, отриманих донорами HSC, тоді як жодного трансплантата HSC донора не було виявлено у реципієнтів, які харчувалися повноцінною дієтою. Важливо, що миші, трансплантовані після позбавлення валіну, запобігали поганому зростанню, скороченню тривалості життя та безпліддям після опромінення (рис. 1).
а) При звичайній трансплантації кісткового мозку мишам радіація використовується для абляції гемопоетичних стовбурових клітин (HSC), але це лікування також пошкоджує нішу, в якій HSC ростуть у безпосередній близькості від дрібних судин кісткового мозку, які називаються синусоїдами. Потім HSC здорового донора пересаджують у кістковий мозок і кров повністю відновлюють. Цей підхід ефективний для заміни системи кровотворення реципієнта, але спричиняє безпліддя та зменшує тривалість життя. b, Тая та співавт. 1 опишіть альтернативний підхід. Виснаження амінокислоти валіном з раціону спричиняє ступінь природного виснаження HSC та дисфункцію, яка дозволяє здоровим донорам HSC дотримуватися, мабуть, зберігаючи нішу. Розгорнуті HSC частково сприяють кровотворній системі, а деякі реципієнти HSC одужують, коли миші повертаються до звичного раціону. Миші, яким пересаджують за цією стратегією, мають нормальну життєздатність і фертильність.
Повнорозмірне зображення
Нарешті, Taya et al. проводили аналогічні експерименти з використанням клітин людини. Вони виявили, що HSC людини потребують не лише валіну, а й іншої необхідної амінокислоти - лейцину, щоб рости в культурі та підтримуватися при посіві мишам, які мають ослаблену імунну систему.
Загалом, це дослідження показує, що просте виснаження основного дієтичного фактора може глибоко погіршити функцію HSC і дозволити трансплантацію здорових донорів HSC. Ці висновки забезпечують альтернативну стратегію кондиціонування, яка може виявитися корисною у біологічних дослідженнях HSC, оскільки стандартні підходи до трансплантації кісткового мозку у модельних організмів використовують опромінення, яке порушує нішу HSC 4. Крім того, дані вказують на дражливе питання про те, як виснаження амінокислот можна використовувати для зменшення токсичності трансплантації кісткового мозку людини.
Однак слід зазначити, що порівняно з методами, що використовують опромінення, виснаження валіну у реципієнтів трансплантатів дотепер досягло лише низького рівня репопуляції донорськими HSC. Цього було б достатньо для лікування деяких, але не всіх захворювань крові, таких як β-таласемія. Крім того, корисність виснаження валіну або лейцину при трансплантації кісткового мозку при лейкемії залишається корисною, оскільки стовбурові клітини лейкемії мають різні метаболічні потреби, ніж нормальні HSC (посилання 5), і вони не можуть залежати від цих амінокислот. Також незрозуміло, яким чином цю мету можна досягти третьою метою, а саме модифікацією імунної системи реципієнта.
У мишей, позбавлених валіну, протягом чотирьох тижнів з’являються симптоми білкового недоїдання, а іноді вони піддаються токсичній метаболічній реакції, яка називається синдромом повторного годування при повторному введенні валіну. Можливо, ідеальний підхід до кондиціонування поєднує коротший час депривації валіну та інші нові методи нетоксичного кондиціонування. Сюди входить використання антитіл проти HSC 6 та кон’югатів антитіло-лікарський засіб 7 для очищення природних HSC та модуляції імунної системи шляхом зміни сигналів через молекули цитокінів, щоб забезпечити трансплантацію донора 8 .
Мінімізація токсичності режимів кондиціонування може зробити трансплантацію кісткового мозку доступною для людей, хворих на лейкемію, які часто занадто хворі, щоб їх лікувати хеморадією. Крім того, це може відкрити можливість використання трансплантатів для лікування легких порушень крові, при яких нинішня хеморадія викликає більше ускладнень, ніж основне захворювання. Тільки час покаже, чи можуть ці нетоксичні підходи виконати обіцянку, яку вони дають мишам, продемонструвавши безпеку та ефективність у людей.
Примітки
Переглядайте всі новини та погляди
Пов’язані посилання
Пов’язані посилання в Дослідженнях природи
- Стовбурові клітини: перепрограмування знаходить своє місце
- Стовбурові клітини: переслідування крові
Коментарі
Надсилаючи коментар, ви погоджуєтесь дотримуватися наших Загальних положень та умов та Правил спільноти. Якщо ви вважаєте, що це образливий вчинок, який не відповідає нашим умовам чи інструкціям, повідомте про це як про недоречний.
- Рослинність під електричним світлом - Новини 2021
- Картина тіла (діти та підлітки) - Хвороби 2021
- Світлана Селезньова біографія, фільми та акторські ролі - Кіно 2021
- Ви є тим, що їсте, оскільки дієта впливає на самопочуття - Health Cure 2021
- Це не моя дитина. Як одна мала залоза може спричинити великі проблеми - симптоми 2021 року