Цей повний текст є відредагованою та переглянутою стенограмою лекції, виголошеної на XIV науковій нараді Міжамериканського товариства гіпертонії, 25-29 березня 2001 р., Сантьяго.
Науковий редактор: д-р Глорія Вальдес.
Вступ
Розглядаючи молекулярну діагностику та клінічні міркування при первинному альдостеронізмі, я вирішив не дивитися в минуле, а в майбутнє. Будуть представлені деякі можливі гени-кандидати та зроблена спроба врятувати деякі аспекти, про які не помічали протягом 30 та 40 років, незважаючи на те, що всі знають про їх існування.
У цій презентації будуть обговорені три теми: частота та сучасний діагностичний підхід, диференціація між різними типами та експериментальний підхід до патофізіологічного дослідження найпоширенішої форми - двостороння гіперплазія зональної клубочки.
Скринінг (скринінг)
Спочатку Кон підрахував, що 20% пацієнтів з гіпертонією мали первинний гіперальдостеронізм, що пояснюється, ймовірно, фактором відбору, оскільки він був одним з небагатьох у світі, хто міг вимірювати альдостерон. Тоді говорили, що це дуже рідко, і що дослідників було більше, ніж пацієнтів із первинним альдостеронізмом.
Дослідження, проведене в 1983 році, напрочуд показало, що Кон, швидше за все, мав рацію, оскільки у 7% пацієнтів було виявлено первинний альдостеронізм. Пізніше в багатьох регіонах світу і майже рівномірно було чітко продемонстровано, що це захворювання є досить поширеним явищем і що 7-10% пацієнтів з есенціальною гіпертензією мають первинний гіперальдостеронізм, який є найпоширенішою причиною гіпертонії середньої школи на цьому етапі . Це сталося через еволюцію критеріїв вимірювання. У минулому використовувались або не шукані, або дуже нечутливі критерії, які виявляли кілька випадків, таких як пригнічена активність реніну в плазмі та посилена екскреція метаболіту альдостерону, виміряного на рівні сечі у пацієнтів з гіпертонією та гіпокаліємією.
Потім для перевірки придушення використовували сольову інфузію і, нарешті, визнавши дані, доступні протягом багатьох років, опубліковані багатьма авторами, японська група просто розділила альдостерон у плазмі на ренін (співвідношення плазматичного альдостерону/реніну) і виявила, що У пацієнтів з первинним гіперальдостеронізмом це співвідношення змінюється, оскільки перше збільшується, а друге пригнічується. Нарешті, тест, який давав ту саму інформацію, але був більш складним, складався із завантаження пацієнта натрієм, на додаток до того, що флюдрокортизон утримував натрій, який повинен пригнічувати альдостерон.
Рекомендовані сьогодні критерії скринінгу засновані на вимірюванні активності альдостерону та реніну в плазмі крові, і якщо коефіцієнт перевищує 30, а альдостерон дещо підвищений, це означає, що існує велика ймовірність захворювання. Якщо співвідношення між 9 і 16, все ще існує можливість. Нарешті, якщо коефіцієнт низький, це малоймовірно, оскільки це співвідношення сильно залежить від рівня реніну.
Зрештою, для підтвердження діагнозу гіперальдостеронізму рекомендуються два різні методи: один просто вводить флудрокортизон і дієту, багату натрієм. Альтернативою, яку використовують багато груп, оскільки вона легка, хоча у деяких пацієнтів не вдається, є введення великої кількості солі, а потім вимірювання альдостерону в сечі; якщо це більше 12 мікрограмів за 24 години, підтверджується наявність у пацієнта первинного гіперальдостеронізму.
Класифікація
Існують різні типи первинного гіперальдостеронізму, які, як правило, відповідають пацієнтам, які мають аденому різних типів, або пацієнтам, які мають двобічну гіперплазію клубової зони, що є найпоширенішими причинами. Існують незначні варіації та рідкісні причини, які наразі не будуть розглядатися.
Сьогодні надзвичайний інтерес викликає альдостеронізм, що реагує на глюкокортикоїди, імовірно, перша моногенна форма гіпертонії.
Вплив видно дуже добре в інформації, яку надає Янг із клініки Мейо. Між 1955 і 1985 роками було лише близько 9 випадків на рік. Переважна більшість була аденомами, і 98% з них були гіпокаліємічними. Коли вони почали застосовувати співвідношення альдостерон/ренін, було визнано близько 120 випадків на рік, і переважна більшість із них мали гіперплазію. В інших закладах частота гіперплазії наближається до 95%. Це залежить від того, наскільки слабкою є хвороба при визнанні тієї чи іншої форми.
Гістологія при первинному гіперальдостеронізмі
На початку 1960-х з'явився опис гістологічного дослідження 153 надниркових залоз, вилучених у пацієнтів з первинним альдостеронізмом, проведене Невілом, в якому виявлено три типи морфологічних змін: пухлини, вузлики або гіперплазія. У пацієнтів, класифікованих як носії пухлини, найпоширенішою формою була аденома надниркових залоз, при якій решта залози мала гіперплазію. Інші мали аденому надниркових залоз і мали не тільки гіперплазію решти залози, але й інші вузлики, як правило, мікровузли, але деякі мали вигляд макронудулів. Нарешті, карциноми були рідкістю. З пацієнтів, які мали гіперплазію, у одних була лише гіперплазія, у інших гіперплазія з мікромодулями, у третіх - гіперплазія з мікро- та макровузлами; Нарешті, деякі мали лише мікромодулі (Рак 1966; 19: 1854-68).
Підхід до гіперальдостеронізму
Щоб з’ясувати, чи є у пацієнта аденома, вузликова чи ні, незначних гістологічних змін на її поверхні, одним із шляхів є пошук клональності гіперплазії з вузликами між аденомою та вузликами. Хворі аденомою, як правило, моноклональні; на відміну від них, люди з гіперплазією, як правило, є поліклональними у походження клітин.
Важливо це розрізняти, оскільки якщо у пацієнта з аденомою видаляється наднирник, він буде біохімічно вилікуваний з точки зору гіпертонії. На відміну від цього, у пацієнта з гіперплазією біохімічного поліпшення можна досягти шляхом видалення обох надниркових залоз; з цим, очевидно, ви отримаєте гіпоадреналову особу, але гіпертонія, як правило, не значно покращиться.
Методи дослідження еволюціонували від взяття проби у вені надниркових залоз, що було технічно дуже складно, до осьової томографії залози, яка була дуже дорогою і не дуже чутливою для діагностики гіперплазії та аденоми. У томографії надниркових залоз, яка застосовувалась багато років, дослідження пухлини з одного боку призвело до діагностики аденоми, але потім було встановлено, що багато разів це фактично був вузлик, схожий на пухлину в одній з наднирники залоз.
Зразок надниркових вен
Сьогодні зразки надниркових вен застосовуються знову. Теоретично найкращий спосіб це зробити, встановивши катетери в обох венах надниркових залоз для збору альдостерону та вимірювання альдостерону та кортизолу, щоб переконатися, що це надниркова вена. У закладах, які застосовують цей метод постійно, відсоток успіху, особливо у правому наднирниках, що важко, становить близько 95%; З іншого боку, в установах, які не мають такого великого досвіду, успіх наближається до 10%, тому метод не дуже корисний, з цієї точки зору, просто через технічні проблеми. Однак, чим більше вона виконується, тим більше вона вдосконалюється, особливо якщо вона відповідає за одного оператора, чого не відбувається, коли в установі 10 людей роблять процедуру кожен, і ніхто з нею не вчиться.
У випадку, описаному Янгом, було встановлено, що альдостерон на ураженій стороні був явно підвищений і що він не був підвищений на неушкодженій стороні; однак він був збільшений порівняно з нижньою порожнистою веною, що означає, що ця надниркова залоза все ще виробляє альдостерон, хоча, як передбачається, вона була пригнічена на контралатеральній стороні. Це дуже важливо.
З точки зору узгодженості, у дослідженні, нещодавно опублікованому Magill з групи Мілуокі, описано 15 пацієнтів з аденомою надниркових залоз, з яких вісім мають суперечливі результати за допомогою комп'ютерної томографії та двостороннього зразка надниркових залоз. Четверо представили суперечливі результати (пухлина з одного боку і підвищений альдостерон надходить з протилежної сторони), а три мають нормальне сканування, але їх можна встановити за допомогою венозного зразка. У 21 пацієнта з ідіопатичним гіперальдостеронізмом у чотирьох були суперечливі результати, оскільки сканування вказувало на гіперплазію, і вони отримали виділення з обох сторін. У восьми випадках були суперечливі результати: вони мали аденому, але насправді мали гіперплазію; а дев'ять мали звичайний сканер. Іншими словами, у 68% пацієнтів інформація на сканер була неточною або нульовою, що не обов'язково означає, що сканер не є корисним для прийняття терапевтичного рішення (J Clin Endocrinol Metab 2001; 86: 1066-71).
Важливо підкреслити, що згідно з даними, опублікованими Моссо та Фарделлою (J Clin Endocrinol Metab 2000; 85: 1863-7), у значній частині пацієнти з гіперплазією реагують на дексаметазон і не мають химерного гена, типового для генетичної форми гіперальдостеронізму, що реагує на глюкокортикоїди (рис. 1, 2). Механізм цього явища абсолютно невідомий, але він досить поширений. Значна кількість пацієнтів залишалася нормотензивною після прийому невеликої дози дексаметазону протягом тривалих періодів, що вказує на те, що це альтернативна форма, патогенез якої невідомий.
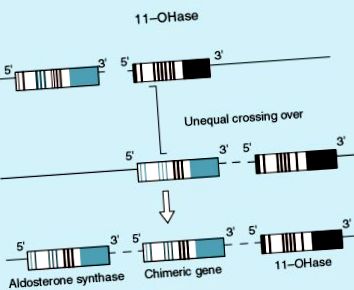 |
Фігура 1. Химерний ген альдостерон-синтетази, що реагує на АКТГ.
Малюнок 2. Локалізація нормального синтезу мінералокортикоїдів та його зміна в присутності химерного гена.
У 33 пацієнтів, які вилікували гіпертонію (49% від загальної кількості), близько 38% не вилікувались біохімічно. Цілком ймовірно, що більшість із цих пацієнтів мали гіперплазію і просто мали домінантний вузлик; З цієї причини комп’ютерна томографія може бути корисною, оскільки, хоча діагноз може бути втрачений у деяких пацієнтів, слід мати на увазі, що багато операторів не мають можливості зробити двосторонню вибірку, тому діагностика за допомогою візуалізації може бути досить точною у переважній більшості випадків.
Генетичні причини двосторонньої гіперплазії
Багато досліджували можливі генетичні причини двосторонньої гіперплазії зональної гломерулози та шукали поліморфізми гена альдестерону синтетази людини, але це було схоже на демократію: це було зроблено в багатьох частинах світу, і були отримані різні результати, тому практичні терміни досі були марними (деякі люди можуть не погодитися).
Згадана раніше гіпотеза полягає в тому, що у більшості пацієнтів з первинним альдостеронізмом спостерігається двостороння гіперплазія клубової зони з домінантними вузликами, які поводяться як аденома, а при видаленні механізм, що регулює секрецію альдостерону, залишається ненормальним.
На експериментальному рівні ми розробили дослідження з моноклональними антитілами проти альдостерон-синтетази, яка міститься лише в зоні гломерулози, та проти 11-бета-гідроксилази, яка міститься лише в зоні fasciculata. Встановлено, що альдостеронсинтетаза реагує лише приблизно на 25-30% клітин клубочкової зони при нормальному харчуванні натрієм. Якщо щур отримує дієту з низьким вмістом натрію, 100% клітин експресують альдостерон-синтетазу. Якщо ви даєте 1% хлориду натрію, що відповідає промисловим кількостям натрію, протягом місяця, ви побачите деякі гнізда клітин, які ніколи не пригнічують вироблення альдостерону. З цього випливає, що в межах нормальної надниркової залози існують різні клони клітин, які мають різну чутливість до придушення солі. Однією з гіпотез є те, що при гіперплазії зона гломерулози переважання ділянки, в якій не можна придушити альдостерон, призведе до надмірного вироблення альдостерону. Приблизно від 10 до 15% клітин не можна придушити великою кількістю солі.
Інший підхід використовував методи віднімання гібридизації та диференціальний показ РНК, з основною гіпотезою, що якщо спостерігається збільшення кількості клонів або гіперплазія в наднирниках, то повинні бути гени, які не є регульованими. Дуже ймовірно, що це гени, які зазвичай регулюються умовами з низьким вмістом натрію, і які дерегульовані лише в патологічних умовах. За допомогою цих методів, які продукують диференційовано експресовані гени, ми шукали гени, які експресуються лише в зоні гломерулози, які регулюються вгору або вниз.
Наразі ми знайшли низку нових генів, деякі з яких уже відомі, але вивчені недостатньо, наприклад, фосфодіестераза 2, яка експресується лише в області гломерулози. Це циклічна GMP стимулююча фосфодіестераза 2, точна роль якої незрозуміла. Ще одним дивовижним фактом було те, що у щурів існували індуковані інтерфероном гени, схожі на гени людини, присутні переважно в лімфоцитах, які відповідають за лімфоцитарну диференціацію. Ми виявили ще два гени, еквівалентні щурам, щурам 10 та щурам 16, а також у людини є три різні гени. Нарешті, іншим геном є RGS-4, який служить для виявлення імунореактивності головним чином у зональній клубочці та в кістковому мозку, і, схоже, регулюється шириною клубової зони, оскільки, коли вона зменшується, вона зменшується.
RGS-4 є регулятором сигналу білка G. На сьогодні описано більше 20 типів регуляторів сигналу білка G, які діють, в основному, стимулюючи гідроліз GTP первинного комплексу, щоб він міг відновити асоціюють і зменшують сигнальний каскад надниркових клітин. Одним з найбільш дивовижних генів, виявлених у гломерулозі, а також у кістковому мозку, є RGS-4, який раніше був знайдений у мозку, завдяки гібридизації in situ він чітко і сильно виражається в зоні гломерулози і менше сильно в кістковому мозку. Для Північна пляма він виражається в основному в зоні гломерулози, і при аналізі захисту рибонуклеази при дієті з низьким вмістом натрію спостерігається помітне збільшення експресії RGS-4. В даний час ми вивчаємо широкі біологічні функції, які може мати надниркова залоза, та їх наслідки.
Іншим геном, який ми виявили, є MIA, інгібуюча активність меланоми, знайдена іншою групою як диференціюючий фактор для хондроцитів, який був виділений незалежно. Він пригнічує ріст меланоми, і недостатньо добре зрозуміло, чому він не пригнічує ріст хондроцитів. Це невеликий пептид, який також сильно експресується в зоні гломерулози, а не в зоні фасцикуляти.
Висновок
Підводячи підсумок, первинний гіперальдостеронізм є дуже поширеним явищем, хоча багато клініцистів залишають його непоміченим, швидше за інерцією.
У більшості пацієнтів спостерігається двобічна гіперплазія зональної клубочки. Деякі з них поводяться як аденоми, і існує ризик поводитися з ними як з такими, якщо немає засобів поставити певний діагноз. Така ситуація, на жаль, трапляється в багатьох місцях. Легко зрозуміти, чому видалення наднирників із двосторонньою зоновою клубочкою покращує метаболічні відхилення; проте невідомо, чому не досягається нормалізація артеріального тиску.
Нарешті, фактори, що впливають на автономний ріст зональної клубочки та збільшення експресії альдостерогенних ферментів, досі невідомі. На додаток до ідентифікованих генів, у диференціальному відборі проб є ще 16 генів, половина з яких відома, багато з яких беруть участь у репарації ДНК. Про деяких з них ми знаємо лише, що вони перебувають у геномі людини. На них будуть спрямовані дослідження в нашій лабораторії в найближчі роки.
