Перегляньте статті та зміст, опубліковані в цьому носії, а також електронні зведення наукових журналів на момент публікації
Будьте в курсі завжди, завдяки попередженням та новинам
Доступ до ексклюзивних рекламних акцій на підписки, запуски та акредитовані курси
«Неврологія» є офіційним журналом Іспанського товариства неврології та публікує з 1986 р. Наукові праці в галузі клінічної та експериментальної неврології. Зміст неврології варіюється від нейроепідеміології, неврологічної клініки, неврологічного управління та допомоги та терапії до базових досліджень в галузі неврології, що застосовуються до неврології. Тематичні напрямки журналів включають дитячу неврологію, нейропсихологію, нейрореабілітацію та нейрогетріатрію. Статті, опубліковані в Neurology, піддаються подвійному сліпому рецензуванню, так що роботи відбираються відповідно до їх якості, оригінальності та зацікавленості, а отже, піддаються процесу вдосконалення. Формат статті включає редакційні статті, оригінали, огляди та листи до редактора. Неврологія є носієм наукової інформації визнаної якості для професіоналів, зацікавлених у неврології, які користуються іспанською мовою, про що свідчить включення її до найпрестижніших та вибіркових бібліографічних покажчиків у світі.
Індексується у:
MEDLINE, EMBASE, Web of Science, розширений індекс наукового цитування, служби оповіщення та неврологія, індекс цитування нейрологічних наук, ScienceDirect, SCOPUS, IBECS та MEDES
Слідкуй за нами на:
Фактор впливу вимірює середню кількість цитат, отриманих за рік за твори, опубліковані у виданні протягом попередніх двох років.
CiteScore вимірює середню кількість цитат, отриманих за опубліковану статтю. Читати далі
SJR - це престижна метрика, заснована на ідеї, що всі цитати не рівні. SJR використовує алгоритм, подібний до рейтингу сторінок Google; є кількісним та якісним показником впливу публікації.
SNIP дозволяє порівняти вплив журналів з різних предметних областей, виправляючи відмінності у ймовірності цитування, які існують між журналами різних тем.
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Бібліографія
Фіброз печінки та її заключна стадія - цироз представляють величезну глобальну проблему здоров’я. Печінкова енцефалопатія (ВІН) або портосистемна енцефалопатія є тривалим клінічним станом цирозу. У цьому огляді висвітлено молекулярні основи HD, а також роль окисного стресу у розвитку цієї хвороби.
Кілька досліджень вказують на те, що ВІН має багатофакторне походження, зміни гематоенцефалічного бар'єру, такі речовини, як амоній та марганець, а також зміни в нейромедіації дофаміну, глутамату та ГАМК, були втягнуті в патогенез цієї хвороби.
HD є важким ускладненням як гострої, так і хронічної печінкової недостатності. Невропатологічно він характеризується астроцитарними змінами, відомими як астроцитоз типу Альцгеймера ІІ, та зміненою експресією специфічних астроцитарних білків, таких як гліальний фібрилярний кислий білок, глутамін-синтетаза, інгібітори моноаміноксидази та периферичні рецептори бензодіазепіну.
HD - це складний нервово-психічний синдром, пов’язаний з печінковою недостатністю. Ці зміни є продуктом збільшення окисного стресу в мозку як наслідок дії нейротоксинів. Основна стратегія лікування ВІН спрямована на зменшення аміаку, або шляхом зменшення його всмоктування/вироблення, або сприяння його виведенню.
Фіброз печінки та її кінцева стадія, цироз, є величезною проблемою здоров'я у всьому світі. Печінкова енцефалопатія (ВІН) або портально-системна енцефалопатія продовжує залишатися основною клінічною проблемою тривалого цирозу. У цьому огляді ми підкреслюємо молекулярну основу ВІН та участь окисного стресу у розвитку цієї хвороби.
Кілька досліджень вказують на те, що патогенез ВІН може бути багатофакторним і містити різні фактори, такі як зміни гематоенцефалічного бар'єру, речовини; такі як аміак та марганець, порушення нейротрансмісії, такі як дофамін, глутамат та ГАМК.
ВІН є важким ускладненням як гострої, так і хронічної печінкової недостатності. Невропатологічно він характеризується змінами астроцитів, відомими як астроцитоз II типу Альцгеймера. Крім того, астроцити виявляють змінену експресію астроцитоспецифічних білків, таких як гліальний фібрилярний кислий білок, глутамінсинтетаза, моноаміноксидаза та бензодіазепінові рецептори периферичного типу.
ВІН - складний нервово-психічний синдром, пов'язаний з печінковою недостатністю. Ці зміни є результатом збільшення окисного стресу в мозку внаслідок активності нейротоксинів. Основна стратегія лікування ВІН спрямована на зменшення аміаку, що може бути досягнуто або зменшенням його всмоктування/вироблення, або збільшенням його виведення.
Клінічні ступені печінкової енцефалопатії.
| I клас | Відсутність обізнаності, ейфорії чи тривоги та зменшення тривалості уваги |
| ІІ клас | Млявість, апатія, мінімальна дезорієнтація часу та простору, зміни особистості та неадекватна поведінка |
| III клас | Сонливість, розгубленість та дезорієнтація |
| IV клас | Їсти |
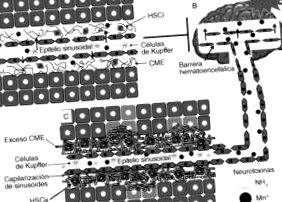
Патогенез ВІН включає дію нейротоксинів, таких як амоній та марганець, на додаток до різних явищ, які включають зміни в нейромедіації, проникність гематоенцефалічного бар'єру або енергетичний обмін (рис. 2). Незважаючи на те, що патогенез ХД складний і ще не до кінця зрозумілий, для вивчення розвитку цієї хвороби використовували численні тваринні моделі. Крім того, поява сучасних методів клітинної та молекулярної біології, а також використання методів візуалізації в нейрофізіології дозволило досягти значних зрушень у розумінні патогенезу ВІН 16 .
Зміни у розвитку печінкової енцефалопатії. Нормальна робота мозку в декількох аспектах залежить від нормальної роботи печінки. Хоча мозок захищений від нейротоксичних речовин гематоенцефалічним бар’єром (характеристикою кровоносних судин мозку, що перешкоджає проходженню багатьох сполук з крові в мозкову тканину), деякі нейротоксини можуть проникати через цей бар’єр після пошкодження печінки. як цироз. Ця хвороба печінки викликає збільшення нейротоксичних речовин, таких як амоній та марганець, які, в свою чергу, індукують окислювальний стрес, перетинаючи гематоенцефалічний бар’єр, спричиняючи пошкодження нейромедіації, збій у синтезі енергії та, нарешті, загибель клітин.
Астроцити займають близько третини об’єму кори головного мозку і утворюють бар’єр сегрегації для нейронів у зовнішньому середовищі. Вони беруть участь у різних процесах, необхідних для функціонування мозку, підтримують та регулюють позаклітинне середовище, беруть участь у поглинанні вільних радикалів, утриманні металів, модуляції імунної відповіді та запалення, впливають на збудливість та нейромедіацію нейронів. .18. Ці клітини мають різні морфологічні зміни. Під час цирозу печінки виникає астроцитоз Альцгеймера ІІ типу, і при гострій печінковій недостатності астроцити набувають вигляду набряклих клітин. Зафіксовано, що астроцити в HD змінюють експресію астроцитоспецифічних білків, таких як глієвий фібрилярний кислий білок (GFAP), ферменти, такі як глутамінсинтетаза (GS), інгібітори моноаміноксидази (MAO) та периферичні рецептори бензодіазепіну (PBR) 19 .
Роль астроцитів
Серед різних типів клітин центральної нервової системи (ЦНС) астроцити є важливим джерелом позаклітинних білків і молекул адгезії. Вони відіграють центральну роль у формуванні гліальних рубців після численних травм, щоб зберегти цілісність тканин і окреслити область пошкодження в процесі, який називається реактивним астрогліозом. Гліальний рубець навколо ураження намагається врятувати здорову тканину ЦНС від вторинних уражень; однак у той же час це гальмує можливу регенерацію аксонів після травми 20 .
Роль нейронів
На відміну від морфологічних змін, описаних в астроцитах, нейрони не демонструють змін у своїй клітинній архітектурі під час HD. Під час гістопатологічних досліджень мозку у пацієнтів із хронічним ураженням печінки нейрони спостерігаються в нормальних умовах і кількостях, а деякі маркери цілісності нейронів, такі як N-ацетиласпартат, у цих пацієнтів не змінюються. Дослідження на тваринних моделях HD дають переконливі докази того, що механізми нейрональної смерті подібні до тих, що спостерігаються при ішемії. Ці механізми включають опосередковану рецептором NMDA екситотоксичність, окислювальний/нітрозативний стрес, молочнокислий ацидоз та наявність прозапальних цитокінів. .
Амоній. Амоній (NH3) є ключовим нейротоксином, який бере участь у патогенезі HD. За останні роки було досягнуто важливого прогресу у визначенні його ролі у генезі набряку мозку під час фульмінантної печінкової недостатності 13,22,23. Застосування аміачних інфузій у щурів показало, що набряк мозку та внутрішньочерепну гіпертензію можна викликати експериментально, і що це явище можна гальмувати при застосуванні метоксиміну сульфату, інгібітору GS. Це призвело до концепції, що глютамін, отриманий з ЦНС, бере участь у детоксикації амонію, виробляючи осмотичний градієнт через гематоенцефалічний бар'єр, що призводить до набряку мозку та набряку астроцитів 11,22. Структурні та нейрохімічні зміни мозку в результаті впливу аміаку були предметом інтенсивних досліджень. Амоній індукує астрогліальні зміни, що сприяють набряку клітин, збільшуючи внутрішньоклітинний глутамін, що спричиняє зміни гематоенцефалічного бар'єру, що впливають на глутаматергічну нейромедіацію і збільшують експресію синтетази оксиду азоту нейрона .
Порушення функції дофамінергічної нейромедіації
Механізм зниження DA в HD вважається причиною накопичення помилкових нейромедіаторів. Підвищена конверсія DA у пацієнтів з енцефалопатією збільшує концентрацію ароматичних амінокислот фенілаланіну та тирозину в мозку, обох попередників нейромедіатора DA. Крім того, було описано, що Mn 2+ змінює дофамінергічну передачу через збільшення конверсії DA. .
Глутамат - це амінокислота і один з амінокислотних нейромедіаторів мозку з збудливим ефектом. В основному він складається з центрального атома вуглецю, приєднаного до карбоксильної групи (COOH) та аміногрупи (NH 3). Глутамат мозку отримують виключно з ендогенних джерел; головним чином з кетоглутарата, продукту циклу Кребса 37. Нейрональний глутамат діє як нейромедіатор під час зв'язку між нейронами. Ці нейрони можуть бути збудливими або гальмівними. Збудливу дію глутамату в головному та спинному мозку ссавців було відомо з 1950-х рр. 37, але лише наприкінці 1970-х рр. Глутамат був визнаний головним передавачем збудження в нервовій системі у хребетних 38 .
Гамма-аміномасляна кислота (ГАМК) є переважним інгібуючим нейромедіатором у ЦНС ссавців. Зміна GABAergic нейромедіації пов'язана з патофізіологією деяких неврологічних та нервово-психічних захворювань, таких як епілепсія, шизофренія, нейродегенеративні захворювання, розлади сну та печінкова енцефалопатія. GABAergic нейромедіація опосередковується GABA, який активує постсинаптичний рецепторний комплекс GABA A (GRC), специфічний ліганд хлоридно-селективних іонних каналів, після активації канал відкривається і дозволяє хлориду надходити для гальмування постсинаптичного нейрона. Зміна GABAergic нейромедіації в HD була запропонована більше двох десятиліть тому 39 .
Лікування печінкової енцефалопатії
Препарати, що застосовуються для лікування печінкової енцефалопатії.
- Ключові аспекти собачого хронічного бронхіту - Ateuves, для ветеринарного асистента
- 10 порад для зняття ци; етики
- Годування коня важливі аспекти - TUXE Life
- Хірургія; a та Est Medicine; tica в Барселоні, Granollers та Reus Cl; одинарний С; nons терапія тіла
- C; як зрозуміти результати аналу; жіноча гормональна етика