- предметів
- реферат
- Передумови:
- мета:
- методи:
- результати:
- висновок:
- вступ
- Матеріали і методи
- Тварини та дієта
- Прийом їжі, збільшення ваги та пероральний тест на толерантність до глюкози
- Збір тканин
- Експресія гена гіпоталамуса
- Аналіз концентрації фолатів
- Гіпоталамічний глобальний аналіз метилювання ДНК
- Статистичний аналіз
- результат
- Споживання їжі, збільшення ваги та реакція на глюкозу
- Експресія гена гіпоталамуса
- Статус фолієвої кислоти
- Глобальний стан метилювання
- обговорення
предметів
- Експресія гена
- гіпоталамус
- Харчові добавки
- Ожиріння
реферат
Передумови:
Сильно полівітамінні (10-кратні AIN-93G, HV) вигодовувані щури Wistar під час вагітності підвищують характеристики метаболічного синдрому у нащадків при відлученні від рекомендованої вітамінної (RV) дієти.
Визначити, чи впливає гестаційне харчування ВГ на обезогенні фенотипи у нащадків через змінений гіпоталамічний контроль поведінки годування та чи можна запобігти їх підвищеному споживанню їжі, подаючи їх на ВГ або дієти з високим вмістом фолатів.
методи:
Нащадків чоловіків, яких годували ВГ дієтою під час вагітності, відлучених від РВ, ВГ або HFol, порівнювали з тими, хто народився у РВ-матерів та відлучив від РВ-дієти протягом 29 тижнів. Споживання їжі протягом 72 годин та масу тіла вимірювали відповідно двічі на тиждень та щотижня. Відповідь глюкози на дозу глюкози вимірювали через 18 тижнів після відлучення. Експресія гіпоталамічного гена нейропептидів, пов’язаних із харчуванням, включаючи нейропептид Y, проопіомеланокортин (POMC), рецептор інсуліну, рецептор лептину, нейротрофічний фактор, отриманий з мозку (BDNF), рецептори допаміну (DopaR1/2/5) та серотонін (2A)). оскільки глобальне метилювання ДНК та концентрацію фолатів у мозку та плазмі вимірювали через 29 тижнів після відлучення.
результати:
Харчування цуценя HV або HFol збільшувало концентрацію фолатів у мозку та плазмі та запобігало збільшенню споживання їжі (5%, P = 0,03), маси тіла (8%, P = 0 0006) та реакції глюкози на навантаження глюкозою (36%, P = 0,02), виявлений у тих, хто годував РВ-дієту. Експресія анорексигенних POMC (P = 0,004) та BDNF (P = 0,02) була вищою, а DopaR1 була нижчою (P = 0,06) у цуценят, які годувались дієтою HV. Дієта для щенят HFol частково привела BDNF до рівня контролю (P = 0,02) та знизила рівень SeroR2A (P = 0,008). На експресію інших генів це не впливало. Глобальне метилювання ДНК було подібним між групами дієт.
висновок:
Обезогенний фенотип у нащадків із гнізд, що годуються ВГ, запобігається годуванням кормом для ВГ або HFol, ймовірно, внаслідок подальшої модуляції регуляторних механізмів прийому їжі після відлучення.
Дієта, що вживається під час вагітності та раннього постнатального життя, формує траєкторію розвитку нащадків. 1, 2 Хоча вітаміни сприяють усім стадіям розвитку, 3 впливу споживання полівітамінів вище вимог (але на нетоксичному рівні) під час вагітності як визначальних факторів фізіологічних фенотипів нащадків приділяється мало уваги. Нещодавно ми показали, що згодовування щурам Вістар під час вагітності дієти, що містить у 10 разів більше рекомендованого вмісту полівітамінів (високий полівітамін (HV)), призводить до збільшення споживання їжі, ожиріння та метаболічного синдрому у дорослих чоловіків 4 та 5 самок. відлучив від рекомендованої вітамінної (РВ) дієти. Оскільки гіпоталамус є важливим регулятором прийому їжі та контролю апетиту 6, можна припустити, що дієта з високим вмістом алкоголю змінює розвиток живлячих нейроцитів у нащадків, що призводить до обезогенного фенотипу. Порушення регуляції дієтичних шляхів може впливати на ріст і метаболізм, що, в свою чергу, призводить до розвитку метаболічного синдрому в подальшому житті. 7, 8
Матеріали і методи
Тварини та дієта
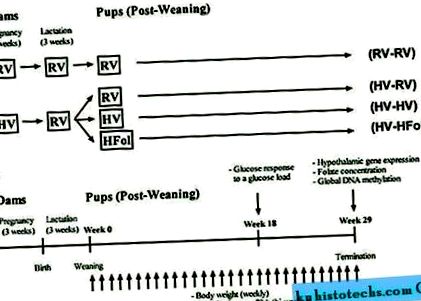
Схематичний малюнок дослідження a ) дизайн a b ) протокол для нащадків чоловічої статі від 0 до 29 тижнів після відлучення. Дієтичні скорочення: RV, AIN-93G дієта з рекомендованими вітамінами; ВГ, в 10 разів більша кількість рекомендованої полівітамінної суміші; HFol, RV + 10-кратний вміст фолієвої кислоти. Дієти, споживані під час вагітності, позначені перед рядком. Дієти, споживані нащадками, позначені за лінією.
Повнорозмірне зображення
Прийом їжі, збільшення ваги та пероральний тест на толерантність до глюкози
На малюнку 1b показано протокол дослідження. Споживання їжі протягом 72 годин вимірювали кожні 2 тижні від 0 до 29 тижнів після відлучення. Вагу тіла вимірювали при народженні та відлученні, а збільшення ваги обчислювали щотижня від 0 до 29 тижнів після відлучення. Відповідь глюкози на глюкозний зонд (0,375 г глюкози на мл, 5 г глюкози на кг маси тіла) вимірювали через 18 тижнів після відлучення. Щурів голодували протягом ночі протягом 10 годин перед зондом глюкози. Пробу крові відбирали з хвостової вени, і вихідну глюкозу негайно аналізували за допомогою комерційного глюкометра (MediSense Precision Xtra, Abbott Laboratories, Abbott Park, IL, USA). Після введення глюкози концентрацію глюкози в крові визначали через 15 і 60 хвилин і розраховували площу збільшення під кривою.
Збір тканин
Мозок цілих щурів швидко видаляли після обезголовлення через 29 тижнів після відлучення і негайно заморожували на сухому льоду, а потім зберігали при -80 ° C. Мозок розморожували на льоду, а праву та ліву сторони гіпоталамуса відокремлювали окремо, використовуючи метод описані вище. 14 Оптичний хіазм був використаний для визначення переднього гіпоталамуса. Це проходить через фронтовий комітет, який використовувався як горизонтальна межа. Лінія між заднім гіпоталамусом і тілами ссавців вважалася каудальною частиною. Розсічені гіпоталамусові блоки містили ядра допопептичних, супраоптичних, паравентрикулярних, передніх, супрахіазматичних, дорсомедіальних, вентромедіальних, дугових, ссавцевих, задніх та бічних складних ядер. Права сторона гіпоталамуса використовувалася для відносної експресії генів, а ліва - для статусу метилювання ДНК. Ліву частину мозку, що залишився, використовували для вимірювання концентрації фолатів. Тушку крові збирали і центрифугували, і до плазми додавали 0,5% аскорбінової кислоти для запобігання окисленню фолієвої кислоти.
Експресія гена гіпоталамуса
Кожен розсічений гіпоталамус гомогенізували за допомогою гомогенізатора тканинного руптора (Qiagen Tech., Mississauga, ON, Канада). РНК з гомогенізованих зразків виділяли за допомогою реагенту Trizol та екстракції хлороформу відповідно до протоколу виробника (Invitrogen, Гранд-Айленд, Нью-Йорк, США) і кількісно визначали за допомогою Nanodrop 1000. КДНК синтезували за допомогою високопродуктивного архівного набору кДНК в ABI (Applied Biosystems, Фостер-Сіті, штат Каліфорнія, США) Система генного підсилення ПЛР 2700.
RT-PCR у режимі реального часу проводили на системі виявлення послідовності ABI PRISM 7000, використовуючи аналізи Taqman для наступних генів, придбаних у ABI: нейропептид Y (кат. № Rn01410146_m1); про-опіомеланокортин (POMC; Кат. № Rn00595020_m1); рецептор інсуліну (кат. № Rn00567070_m1); рецептор лептину (кат. № Rn01433205_m1); нейротрофічний фактор мозку (BDNF; кат. № Rn02531967_s1); рецептор дофаміну 1 (DopaR1; кат. № Rn03062203_s1); рецептор дофаміну 2 (DopaR2; кат. № Rn00561126_m1); рецептор дофаміну 5 (DopaR5; кат. № Rn00562768_s1); рецептор серотоніну 1A (SeroR1A; кат. № Rn00561409_s1); рецептор серотоніну 2А (SeroR2A; кат. № Rn01468302_m1); рецептор серотоніну 2C (SeroR2C; кат. № Rn00562748_m1). Умови циклу становили 50 ° C протягом 2 хвилин, 95 ° C протягом 10 хвилин, 40 циклів при 95 ° C протягом 15 с і 60 ° C протягом 1 хвилини. Відносний метод кількісного визначення проводили з використанням гліцеральдегід-3-фосфатдегідрогенази (кат. № Rn99999916_s1) як ендогенного контролю, який був обраний попереднім скринінгом для найменших варіацій. Результати були виражені як зміна в два рази за допомогою методу 2- AATCT 15 та проаналізовані за допомогою програмного забезпечення ABI DataAssist версії 3.0.
Аналіз концентрації фолатів
Концентрацію фолатів у плазмі та мозку визначали мікробіологічним аналізом на мікропланшетах із використанням Lactobacillus casei. 16, 17
Гіпоталамічний глобальний аналіз метилювання ДНК
ДНК виділяли за протоколом, викладеним у DNeasy Blood and Tissue Kit (Qiagen Tech.). Для визначення концентрації було усереднено два спектрофотометричні значення зразків ДНК, які мали співвідношення А 260 до 280 між 1,8 і 2,0 і не містили забруднення РНК та білка.
Глобальний статус метилювання геномної ДНК гіпоталамусу визначали методом прийняття метилу in vitro, як описано вище. 18, 19 Цей аналіз включає 3 H-метил-S-аденозилметионін (New England Nuclear, Бостон, Массачусетс, США) як донора метилу, опосередкованого Sss1 ДНК-метилтрансферазою (New England Biolabs, Pickering, ON, Канада). Відомо, що здатність прийому метильних груп у всьому геномі опосередковано пов'язана з екзогенним включенням 3 H-метилу. Всі зразки аналізували двічі, і весь тест проводили двічі. Внутрішнє та між CV резюме становило 5%.
Статистичний аналіз
Вплив лікування на збільшення ваги та споживання їжі протягом 72 годин аналізували, використовуючи модельну процедуру PROC MIXED в SAS (версія 9.2, SAS Institute Inc., Carey, NC, USA), з основним раціоном, цуценятами та часом. фактори. Середні значення в кожну точку часу та експресію гена гіпоталамуса, статус фолієвої кислоти та реакцію глюкози порівнювали за допомогою одностороннього дисперсійного аналізу з використанням PROC GLM з подальшим пост-хок-тестом Тукі. Суттєві відмінності були відзначені для P
Прийом їжі через 72 години потомства чоловіків від 0 до 29 тижнів після відлучення. Дієтичні скорочення: RV, AIN-93G дієта з рекомендованими вітамінами; ВГ, в 10 разів більша кількість рекомендованої полівітамінної суміші; HFol, RV + 10-кратний вміст фолієвої кислоти. Дієти, споживані під час вагітності, позначені перед рядком. Дієти, споживані нащадками, позначені за лінією. Дієта (P = 0,033), час (P ab Суттєво відрізняється відповідно до моделі повторного вимірювання PROC MIXED. Значення середні ± sem, n = 12-14 для групи.
Повнорозмірне зображення
Вага тіла потомства від 0 до 29 тижнів після відлучення. Дієтичні скорочення: RV, AIN-93G дієта з рекомендованими вітамінами; ВГ, в 10 разів більша кількість рекомендованої полівітамінної суміші; HFol, RV + 10-кратний вміст фолієвої кислоти. Дієти, споживані під час вагітності, позначені перед рядком. Дієти, споживані нащадками, позначені за лінією. Збільшення ваги: дієта (P = 0 0006), час (P ab Суттєво відрізняється відповідно до моделі повторного вимірювання PROC MIXED. Значення середні ± sem, n = 12-14 для групи.
Повнорозмірне зображення
Реакція глюкози в крові на навантаження глюкозою (5 г глюкози на кг маси тіла) як площа під кривою (iAUC) чоловічих нащадків через 18 тижнів після відлучення. Дієтичні скорочення: RV, AIN-93G дієта з рекомендованими вітамінами; ВГ, в 10 разів більша кількість рекомендованої полівітамінної суміші; HFol, RV + 10-кратний вміст фолієвої кислоти. Дієти, споживані під час вагітності, позначені перед рядком. Дієти, споживані нащадками, позначені за лінією. ab P = 0,02 одностороннім дисперсійним аналізом з подальшим пост-хок-тестом Тукі. Значення середні ± sem, n = 8-12 на групу.
Повнорозмірне зображення
Експресія гена гіпоталамуса
Харчовий раціон HV, але не HFol, давав експресію POMC для контролю рівня у дорослих нащадків від матерів HV (P = 0,004) (рис. 5а). Щенята HV з дієтою HV привели експресію BDNF до контрольних рівнів, але дієта розщеплення HFol лише послабила зниження експресії, індукованої HV (P = 0,02) (рис. 5а). Тільки дієта для щенят HFol знижувала експресію SeroR2A порівняно з потомством HV, відлученим від щенят РВ (P = 0,008) (рис. 5b). У випадку потомства HV, відлученого від дієти для щенят HV, порівняно з потомством RV (P = 0,06), спостерігалась тенденція зниження експресії DopaR1 (рис. 5b). Вагітність або немовлята не впливали на експресію гіпоталамусу інших генів.
Експресія гена гіпоталамуса ( a ) нейропептид Y (NPY), проопіомеланокортин (POMC), рецептор інсуліну (InsR), рецептор лептину (LepR) та нейротрофічний фактор головного мозку (BNDF) та ( b ) рецептори дофаміну (DopaR1/R2)/R5) та рецептори серотоніну (SeroR1A/2A/2C) у нащадків чоловічої статі через 29 тижнів після відлучення. Дієтичні скорочення: RV, AIN-93G дієта з рекомендованими вітамінами; ВГ, в 10 разів більша кількість рекомендованої полівітамінної суміші; HFol, RV + 10-кратний вміст фолієвої кислоти. Дієти, споживані під час вагітності, позначені перед рядком. Дієти, споживані нащадками, позначені за лінією. ab Суттєво різний односторонній дисперсійний аналіз, що супроводжується пост-хок-тестом Тукі. Значення середні ± sem, n = 4-7 для групи.
Повнорозмірне зображення
Статус фолієвої кислоти
На рівні фолатів у мозку (рис. 6а) та плазмі крові (рис. 6б) дієта на дамбі не впливала, але підвищувалась за рахунок HV щеняти або HFol.
Новим спостереженням нашого дослідження є те, що шляхи живлення гіпоталамусу реагують на вміст вітамінів у їжі після відлучення. Годівля щенят ВГ відновило експресію POMC та BDNF для контролю рівнів у зрілих нащадків. Оскільки експресія цих анорексигенних нейропептидів нормалізована, можна припустити, що вміст вітамінів у раціоні після відлучення сприяє перебудові функції гіпоталамусу як у зрілих, так і у щурів, що розвиваються. Крім того, спостерігалася тенденція до зниження рівня експресії DopaR1 у потомства HV, відлученого від дієти HV, порівняно з контрольним потомством. У ядрі вентромедіального гіпоталамусу викид дофаміну необхідний для початку прийому їжі і позитивно пов’язаний з кількістю та тривалістю прийому їжі. 27, 28 Шляхом зменшення передачі сигналів дофаміну, дієта ділення при ВГ може забезпечити певний захист від надмірного споживання їжі, спричиненого гестаційною дієтою для ВГ. Хоча ми першими показали, що мозок дорослої людини реагує на вітаміни, наші результати обгрунтовані повідомленням про зміни гіпоталамусу в регуляторних генах споживання їжі внаслідок взаємодії дієти з високим вмістом жиру у матерів та після відлучення.
Хоча було показано, що фолат є активним учасником реакцій метилтрансферу, 12 гестаційних дієт не зазнали впливу глобального метилювання навіть після відлучення. Однак це не дивно, оскільки попередні дослідження повідомляли, що метилювання ДНК генів за відсутності помітних змін у глобальному метилюванні свідчить про те, що епігенетичні зміни є специфічними для певної ділянки. 33 Крім того, дієти RV, HV та HFol у нашому дослідженні містять велику кількість холіну, іншого фактора, що впливає на метилювання ДНК, 34, 35, і саме по собі може мати приховане виявлення впливу фолату на метилювання. Метаболізм холіну та інших вітамінів метильної групи (тобто фолатів, вітаміну В6 та В12) тісно пов'язаний. 36
Значна слабкість дослідження зумовлена відсутністю вимірювання експресії генів на різних етапах зрілості. Тому ми не знаємо, на якому етапі дозрівання відбулася зміна гіпоталамуса після їжі після відлучення. Окрім генів гіпоталамусу, вимірювання генів у ділянках мозку, що беруть участь у винагороді та мотивації, може сприяти більш повному розумінню загального впливу дієти на регулювання споживання їжі. Було показано, що миші, що харчуються дієтою з високим вмістом жиру (60% калорій з жиру) після відлучення, мають нижчу експресію гена опіоїдного рецептора, який впливає на схеми винагород у вентральній ділянці тегментального, ядерного накопичення та префронтальної кори. 37
На закінчення, обезогенний фенотип у нащадків із гнізд, що харчуються ВГ, може бути зумовлений зміненим гіпоталамічним контролем поведінки годування, але його можна запобігти, вигодовуючи їх курчат ВГ або HFol.
- Мініатюрні щенята OPTIMEAL з низьким зерном та дрібні породи з високим вмістом баранини 4 кг
- Ви не повірите, що це продукти з більш високим вмістом калорій, ніж гамбургер!
- Неймовірно добре підходить торт Bounty з великою кількістю білка та нижчих вуглеводів (рецепт)
- PIMA напої з г з натуральною стевією, без зайвих калорій; У кубі
- Нові інструкції з безпеки лікарських засобів, що містять диклофенак