- предметів
- реферат
- вступ
- Пацієнти та методи
- пацієнтів
- План трансплантації
- Оцінка ефективності
- Оцінка токсичності, пов'язаної з трансплантацією
- біостатистика
- результат
- Характеристика пацієнта
- Кінцеві точки ефективності
- Токсичність для паліфермінів
- Токсичність, пов’язана з трансплантацією
- ОС та EFS
- обговорення
предметів
- Трансплантація кісткового мозку
- хіміотерапія
- Шлунково-кишкові захворювання
- Кровотворні стовбурові клітини
реферат
Паліфермін, рекомбінантний фактор росту кератиноцитів людини, зазвичай вводять для профілактики мукозиту після аутологічної трансплантації. Дані про безпеку та ефективність обмежені при алогенних трансплантаціях гемопоетичних стовбурових клітин (алло-HSCT). Ми провели ретроспективне дослідження на 251 пацієнтці, яка перенесла алло-HSCT, з яких 154 отримали периплантат паліфермін. У всіх пацієнтів паліфермін значно зменшував середню кількість днів загального парентерального харчування (TPN, 13 проти 16 днів, P = 0,006) та контрольовану пацієнтом анальгезію (PCA, 6 проти 10 днів, P = 0,023), а також тривалість початкового перебування в лікарні (LOS, 32 проти 37 днів, P = 0,014). Однак ефект паліферміну був значним лише у пацієнтів, які отримували схему хіміотерапії на основі ЧМТ, але не BU. У реципієнтів ЧМТ паліфермін зменшував середню кількість днів TPN (13 проти 17 днів, P 1) Хоча ступінь тяжкості може змінюватися в залежності від режимів кондиціонування, асоційований з алло-HSCT мукозит може призвести до значної захворюваності, включаючи біль у роті, що вимагає наркотиків для знеболення, анорексія вимагає повноцінного парентерального харчування (TPN), тривалого перебування в лікарні та, можливо, небезпечних для життя інфекцій, спричинених перенесеними слизовими бактеріями. 2, 3, 4
Фактор росту кератиноцитів - це ендогенний білок 28 кДа в серії факторів росту фібробластів, який діє як фактор росту клітин епітелію. Фактор росту кератиноцитів відіграє важливу роль у загоєнні епітелію після травми. 6 Паліфермін (Kepivance, шведський сирота-біовітрій) - це рекомбінантний фактор росту кератиноцитів людини, який є стабільнішим, ніж ендогенний фактор росту кератиноцитів завдяки видаленню 23 амінокислот з його N-кінця (інформація про продукт). Доклінічні дані на моделях мишей показали, що введення паліферміну захищає від хіміотерапії та радіаційного мукозиту. 7, 8, 9, 10 Клінічно показано, що паліфермін полегшує мукозит після хіміотерапії та аутологічного HSCT на основі ЧМТ. 11, 12 На підставі дослідження фази III у хворих на аутологічну трансплантацію, які продемонстрували знижену частоту та тривалість мукозиту III-IV ступеня Всесвітньої організації охорони здоров’я після кондиціонування TBI, Fif схвалив паліфермін для профілактики мукозиту під час аутологічного та алогенного лікування. HSCT. Однак опублікований досвід застосування паліферміну щодо алло-HSCT обмежений. 13, 14, 15
Щоб допомогти визначити, чи паліфермін безпечний та ефективний після ало-ГСКТ, ми провели ретроспективний аналіз нашого досвіду з паліферміном, який вводили дорослим пацієнтам, які перенесли алоело HSlat з виснаженням мієлоаблативних Т-клітин (ТХД) для гематологічних злоякісних пухлин. Параметр TCD був обраний для вивчення ефектів паліферміну за відсутності MTX, який зазвичай використовується для профілактики GVHD. Незважаючи на те, що TCD не використовується широко у Сполучених Штатах, останні позитивні дані кількох центрів підтримують більш широке використання. 16, 17 Це дослідження представляє найбільший опублікований досвід на сьогоднішній день з деталями використання паліферміну під час алло-HSCT.
Пацієнти та методи
пацієнтів
Повнорозмірне зображення
План трансплантації
Т-клітини видаляли з трансплантатів ВМ шляхом послідовної аглютинації лектину сої та виснаження еритроцитів овець (дев'ять пацієнтів). 19 Виснаження Т-клітин мобілізованих G-CSFs PBS проводили шляхом позитивного відбору CD34 + стовбурових клітин за допомогою магнітного сепаратора ISOLEX 300i з подальшим виснаженням овечих еритроцитів-розеток (231 пацієнт), 20 або позитивним відбором CD34 + стовбурових клітин з використанням системи Miltenyi CliniMACS без подальшого виснаження еритроцитарної розетки овець (11 пацієнтів). 16 виснажених кісткового мозку Т-клітин або PBSC вводили протягом 24-48 годин після завершення хіміотерапії. Режими кондиціонування включали антитимоцитарний глобулін (ATG) на 0-3 дози. Фармакологічна профілактика GVHD не проводилась, оскільки пацієнти отримували трансплантат TCD повністю ex vivo.
Пацієнти, які отримували паліфермін, отримували препарат відповідно до затвердженого режиму дозування. 12 Три добові дози (60 мкг/кг/добу) давали перед надходженням на трансплантацію, причому третя доза давалася принаймні за 24 години до хіміотерапії або променевої терапії. Через 6 годин після інфузії стовбурових клітин пацієнти отримували додаткові три добові дози паліферміну (60 мкг/кг/добу).
Оцінка ефективності
Були зібрані дані про кількість днів, коли пацієнтам потрібні ТПН та контрольована пацієнтом анальгезія (ПКА) з наркотиками. 12, 14 Лікуючим лікарем після трансплантації пацієнти були поміщені на PCA, коли пацієнти скаржились на будь-який біль у роті або горлі, який заважав ковтанню. PCA припиняли, коли пацієнтові не потрібні «необхідні дози» за відсутності базальної дози. Наш процес управління TPN описаний вище. Тривалість первинного перебування в лікарні (ЛОП) після трансплантації після надходження також була визначена для всіх пацієнтів.
Оцінка токсичності, пов'язаної з трансплантацією
Діагноз РТПХ був поставлений на клінічній основі та патологічно підтверджений по можливості. Гострий показник GVHD (aGVHD) оцінювали згідно з критеріями CIBMTR. 22 пацієнтів можна було проаналізувати на РПЗЗ після трансплантації. Хронічну РТПХ (cGVHD) можна оцінити у пацієнтів, які пережили> 100 днів. Хронічну РТПХ класифікували як обмежену чи велику за критеріями Саллівана. 23 критерії консенсусу NIH не використовувались у цьому дослідженні, оскільки їх ретроспективний характер обмежував доступні дані для класифікації cGVHD.
Первинна недостатність трансплантата визначалася як відсутність відновлення нейтрофілів (500500/мкл) до 28-го дня та біопсія БМ з -5% клітинності. Вторинна недостатність трансплантата визначалася як втрата АНК на 18
біостатистика
Ми порівняли безперервні результати використання PCA, TPN та LOS між реципієнтами паліферміну та нерецепторами за допомогою t-тесту. Для оцінки впливу паліферміну на кожен із цих наслідків, пов’язаних із мукозитом, моделі лінійної регресії коригували після корекції віку, використання АТГ та режиму попередньої терапії (на основі ЧМТ та хіміотерапії). Незважаючи на те, що використання ATG не впливало на мукозит, воно було перекладено у ці багатовимірні аналізи, щоб узгоджуватися з аналізом часу до розвитку AGVHD. Аналіз конкурентного ризику та багатоваріантне конкурентне управління контролем вікової регресії, використанням АТГ та попередньою обробкою використовувались для оцінки впливу паліферміну на час до гострої та хронічної РТПХ. Для оцінки впливу паліферміну на результати виживання використовували log-rank тест на OS та EFS. Регресійна модель Кокса застосовувалась до цих результатів час від часу до події, корекції віку, використання АТГ та режиму підготовки.
результат
Характеристика пацієнта
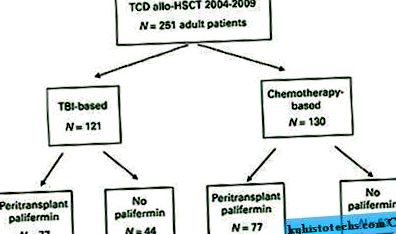
У таблиці 1 докладно описані характеристики пацієнта. Середній вік при трансплантації становив 55 років (діапазон 19-73 років). Діагнози варіювались і детально описані в таблиці 1. Загалом 121 пацієнт отримав кондицію на основі ЧМТ (48%, рисунок 1). З цих пацієнтів 77 (64%) отримували паліфермін. З 130 пацієнтів, які отримували алло-HSCT на основі хіміотерапії (52%), 77 (59%) отримували паліфермін. Дев'ять пацієнтів отримували БМ як джерело стовбурових клітин, а решта пацієнтів отримували трансплантати PBSC. Загалом 213 пацієнтів (85%) отримували ATG до інфузії стовбурових клітин, а два пацієнти отримували ATG після інфузії стовбурових клітин. ATG не вводили ще 36 пацієнтам, котрі були реципієнтами споріднених донорів і які отримували лікування TBI, тіотепи та флударабіну (n = 34) або TBI, тіотепи та CY (n = 2). 20
Стіл в натуральну величину
Усі, крім двох пацієнтів, досягли рівня виснаження клітин CD3 +
a ) Сукупна частота AGVHD у всіх дорослих із паліферміном. b ) Кумулятивна захворюваність на СГГВЗ у всіх дорослих із паліферміном.
Повнорозмірне зображення
ОС та EFS
При медіані спостереження 16, 3 місяці (діапазон 0, 03 - 75, 8 місяців) медіана ОС становить 53 місяці (95% ДІ: 32 місяці - не досягнуто), а медіана EFS становить 39 місяців (95% ДІ: 25 місяців - не досягнуто). Суттєвого впливу паліферміну на ОС (рис. 3а) або EFS (рис. 3b) не спостерігалося. Однак вік при трансплантації був значущим прогностичним фактором для ОС (HR 1, 02, 95% ДІ: 1, 00–1, 04, P = 0,05) та EFS (HR 1, 02, 95% ДІ: 1, 00– 1, 04, P = 0, 04), який контролював ATG. режим використання та підготовки.
a ) ОС при використанні паліферміну. b ) EFS з використанням паліферміну.
Повнорозмірне зображення
обговорення
Наші результати представляють найбільший опублікований на сьогодні досвід використання паліферміну у реципієнтів алло-HSCT. Через обмеження ретроспективного дослідження, включаючи можливе упередження лікаря, ми можемо вперше продемонструвати, що паліфермін не підвищує токсичність, пов’язану з трансплантацією, в алогенному трансплантаційному середовищі і ефективний після ало-HSCT на основі TBI. Попередні дослідження, що оцінювали паліфермін за допомогою алло-HSCT, були обмеженими, оскільки вони мали менший розмір, спрямовані на запобігання РТПШ, та/або не застосовували паліфермін у затвердженому в даний час режимі дозування. 13, 14, 15
У нашому дослідженні 154 пацієнти, які перенесли алло-HSCT, отримували периаран для трансплантації паліферміну. Оскільки це було ретроспективне дослідження, ми не змогли точно повідомити про вплив паліферміну на мукозит Світової організації охорони здоров’я. Окрім проспективних досліджень, спеціально розроблених для оцінки мукозиту, оцінка мукозиту, записана в медичній карті, є суперечливою. Були використані клінічні кінцеві точки, пов'язані з мукозитом, описані в попередніх дослідженнях 12, 14, 15, і ми продемонстрували значне зменшення використання TPN, використання PCA та тривалості перебування. В окремому аналізі реципієнтів ало-HSCT на основі ЧМТ та хіміотерапії користь паліферміну обмежувалась реципієнтами ТБІ. У цій групі пацієнтів паліфермін зменшив середню кількість днів, коли пацієнти отримували PCA та TPN на 5 днів (P = 0,033), та TPN на 4 дні (P 12
Наше дослідження також показало, що паліфермін не підвищував токсичність, пов'язану з трансплантацією, під час алло-HSCT. У цієї великої групи пацієнтів, які отримували дозу паліферміну, схвалену FDA, не спостерігалось явного збільшення частоти aGVHD та cGVHD або відмови трансплантата. Однак, оскільки всі пацієнти отримували TCD алотрансплантати ex vivo та ATG, не виключено, що паліфермін може впливати на розвиток GVHD при інших станах. Крім того, не було різниці в OS або EFS між двома групами (P = 0,74 та P = 0,463).
Даних щодо використання паліферміну під час алогенної трансплантації обмежено. 13, 14, 15 Блазар та ін. 13 опублікували рандомізоване, контрольоване плацебо дослідження I/II фази, що оцінює вплив паліферміну на профілактику AGVHD, на основі доклінічних досліджень, які свідчать про те, що паліфермін може запобігати AGVHD. 24, 25 шістдесят дев'ять пацієнтів отримували паліфермін, тоді як 31 пацієнт отримував плацебо. Не було різниці між двома групами за частотою AVVHD, часом трансплантації, рецидивом або виживанням, що узгоджується з нашими даними. Аналіз підгруп виявив істотно знижену частоту та середній ступінь тяжкості мукозиту у пацієнтів з ІГ та ЧМТ, але не з БО та СН. Це дослідження включало чотири різні режими дозування, причому вісім пацієнтів отримували менше, а 51 пацієнт отримував більше паліферміну, ніж поточна затверджена доза. Десять пацієнтів у дослідженні отримували паліфермін при одночасному дозуванні, затвердженому FDA.
Лангнер та ін. 14 також показує обмежену серію паліферміну в установці алло-HSCT. Вони лікували 30 пацієнтів паліферміном, які перенесли алло-HSCT на лейкемію, і порівняли їх з відповідною контрольною групою в минулому. У пацієнтів, які отримували паліфермін, частота розвитку мукозиту ІІ-IV ступенів була зменшена порівняно з контролем (60% проти 80%, Р = 0,04). У пацієнтів, які отримували паліфермін (6 проти 12 днів, Р = 0,003), також спостерігалось зменшення середньої тривалості мукозиту, зменшення середньої загальної дози опіоїдів (150 мг проти 378 мг, Р = 0,04) та застосування TPN. (15 проти 26 днів, P = 0,002). У цьому невеликому дослідженні не спостерігалося впливу паліферміну на гематологічне відновлення, розвиток AGVHD або ОС. Подібним чином Насіловська-Адамська та ін. 15 лікували 53 пацієнтів, яким трансплантовано гематологічні злоякісні пухлини, паліферміном та порівняли їх із відповідною історичною контрольною групою. Перевага для профілактики мукозиту була підтверджена, і не було різниці між групами у розвитку будь-якого AGVHD. Подальші алогенні аналізи, специфічні для трансплантації, були обмеженими, оскільки лише 24 пацієнтам, які отримували паліфермін, проводили алло-HSCT, тоді як решта пацієнтів отримували аутологічну трансплантацію.
Коротше кажучи, у цьому великому ретроспективному дослідженні ми демонструємо, що паліфермін ефективний під час алло-HSCT і не збільшує токсичність, пов’язану з трансплантацією, у цьому середовищі. Наше дослідження представляє найбільшу когорту пацієнтів, які отримували зазначену дозу, і тому вносить значний внесок у керівництво поточною клінічною практикою з цим препаратом при алло-ГСКТ. Оскільки використання паліферміну в цьому ретроспективному дослідженні плутають із датою ГСКТ та іншими клінічними факторами, для підтвердження цих результатів необхідно проспективне рандомізоване дослідження. В даний час ми плануємо велике багатоцентрове проспективне дослідження, що оцінює безпеку та ефективність паліферміну у популяції пацієнтів з мієлоаблативним TCD на основі ЧМТ алло-HSCT, щоб підтвердити наші висновки.