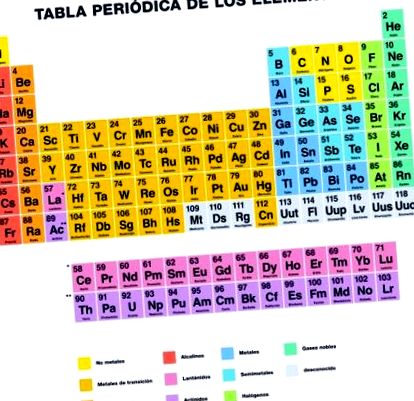
Що таке періодична система елементів?
Періодична система, або періодична система елементів, є a організований облік хімічних елементів за своїм атомним номером, властивостями та характеристиками.
Він складається з 118 елементів, підтверджених Міжнародним союзом чистої та прикладної хімії (IUPAC, для його скорочення англійською мовою), з яких
- 94 - це елементи, що існують у природі, і
- 24 елементи є синтетичними, тобто вони були створені штучно.
Його розвиток тісно пов’язаний з відкриттям нових елементів та вивченням їх загальних властивостей. Такі аспекти, як поняття атомної маси та взаємозв'язки між атомною масою та періодичними властивостями елементів, були основними для конфігурації сучасної періодичної таблиці.
Періодична система працює як фундаментальний інструмент для вивчення хімії, оскільки дозволяє послідовно і легко визначати відмінності та подібності між хімічними елементами.
Її створення приписується російському вченому Димитрію Менделєєву в 1869 р. З тих пір періодична система вдосконалювалась та оновлювалася іншими вченими в міру відкриття та вивчення нових елементів.
Як організована періодична система?
Періодична система представляє всі відомі на сьогодні елементи, які організовані та розташовані відповідно до їх характеристик та взаємозв'язку між ними в групі, періодах, блоках та металах, металоїдах та неметалах.
Групи
Періодична система складається з 18 груп елементів, організованих у вертикальні колони, пронумеровані від 1 до 18 зліва направо, починаючи з лужних металів і закінчуючи благородними газами.
Елементи, що належать до одного стовпця, мають подібні хімічні характеристики, засновані на структурі електронів в останньому шарі атома.
Наприклад, перший стовпець містить елементи, що мають електрон в останній оболонці атома. У цьому випадку калій має чотири оболонки, а в останній - електрон.
Хімічні елементи організовані в групи наступним чином:
- Група 1 (I A): лужні метали.
- Група 2 (II А): лужноземельні метали.
- 3 група (III Б): родина скандіїв.
- Група 4 (IV B): сімейство титанових.
- Група 5 (V B): сімейство ванадій.
- 6 група (VI B): сімейство хрому.
- Група 7 (VII B): сімейство марганцю.
- Група 8 (VIII B): сімейство залізних.
- Група 9 (VIII B): родина кобальтів.
- Група 10 (VIII B): сімейство нікелю.
- Група 11 (І Б): сімейство мідних.
- Група 12 (II Б): сімейство цинку.
- Група 13 (III А): землисті.
- Група 14 (IV A): карбоніди.
- Група 15 (V A): нітрогеноїди.
- Група 16 (VI A): халькогени або амфогени.
- Група 17 (VII A): галогени.
- Група 18 (VIII A): благородні гази.
Періоди
Періоди - це сім горизонтальних рядків, які має періодична система. У цих рядках групуються елементи, що мають кількість електронних оболонок, що збігається з номером періоду.
Наприклад, у першому ряду водень і гелій мають оболонку електронів. У період два існує вісім елементів, які мають дві оболонки електронів. У третьому ряду елементи мають три оболонки електронів тощо.
У шість періодів є елементи, які мають шість оболонок електронів, як нижній ряд лантаноїдів. У період сім є елементи, які мають сім оболонок електронів, а також останній ряд актиноїдів.
Метали, металоїди та неметали
Три категорії елементів, що входять до періодичної системи, можна відрізнити від їх хімічних та фізичних властивостей, а саме: метали, металоїди та неметали.
- Метали: це тверді елементи при кімнатній температурі за вирахуванням ртуті, що знаходиться в рідкому стані. Вони податливі і пластичні, і є хорошими провідниками тепла та електрики. Вони знаходяться на лівій стороні столу.
- Без металів: В основному це гази, хоча є і рідини. Ці елементи не є хорошими провідниками електрики. Вони знаходяться з правого боку столу.
- Металоїди або напівметали: вони мають властивості як металів, так і неметалів. Вони можуть бути блискучими, непрозорими і не дуже пластичними. Його електропровідність нижча, ніж металів, але вища, ніж неметалів. Вони знаходяться в правій частині таблиці, між металами та неметалами.
Блоки
Періодичну таблицю також можна розділити на чотири блоки на основі послідовності електронних оболонок кожного елемента. Назва кожного блоку походить від орбіталі, в якій знаходиться останній електрон.
- Блок s: групи 1 та 2 лужних металів, лужноземельних металів, водню та гелію.
- Блок p: охоплює групи 13-18 та металоїди.
- Блок d: складається з груп від 3 до 12 та перехідних металів.
- Блок f: не має номера групи та відповідає лантанідам та актиноїдам. Зазвичай їх розміщують під періодичною системою.
Тенденції періодичної системи
Періодичні тенденції стосуються основних фізико-хімічних властивостей, якими володіють елементи та які дозволяють їх організацію в періодичній системі. Ці тенденції пов’язані зі змінами, що відбуваються в атомній структурі кожного елемента відповідно до періоду або групи, до якої він належить.
Серед періодичних тенденцій можна виділити:
Основні дані про хімічні елементи
Періодичні таблиці зазвичай містять основні дані кожного з існуючих у ньому елементів, що дозволяє створити цілісну організацію на основі її характеристик, таких як символ, назва, атомний номер та атомна маса, для визначення його використання.
- Атомна маса: відноситься до маси атома, що складається з протонів і нейтронів.
- Енергія іонізації: - енергія, необхідна для відокремлення електрона від атома.
- Хімічний символ: скорочення для ідентифікації хімічного елемента.
- Ім'я: Назва, дана хімічному елементу, може бути похідною від латинської, англійської, французької, німецької чи російської.
- Електронна конфігурація: як структуровані або організовані електрони в атомі.
- Атомний номер: відноситься до загальної кількості протонів, які має атом.
- Електронегативність: - це здатність атома притягувати до себе електрони.
- Стани окислення: показник ступеня окиснення атома, що входить до складу складеного хімічного елемента.
Для чого потрібна періодична система?
Періодична система дуже корисна для наукових досліджень, враховуючи різні функції, які вона має.
- Це дозволяє виявити відмінності та подібності між різними елементами. Наприклад, він містить цінну інформацію, таку як атомна маса кожного елемента.
- Це дозволяє аналізувати хімічну поведінку елементів. Наприклад, при розрізненні електронегативності та електронної конфігурації елемента.
- Він служить фундаментальним інструментом для вивчення хімії, включаючи біологію та інші галузі науки, оскільки визначає основні характеристики хімічних елементів.
- Це дозволяє легко відрізнити елементи від їх атомного номера. Це пов’язано з тим, що елементи складаються з атомів, які отримують свою назву та диференціюються за кількістю протонів, електронів та нейтронів, які він містить.
- Він може бути використаний для прогнозування хімічних властивостей нових елементів, які будуть включені до таблиці, беручи до уваги характеристики вже визначених елементів.
Історія періодичної системи
Створення періодичної системи приписується російському вченому Дмитру Менделєєву, який у 1869 році зібрав у таблицю 63 відомі науці на сьогодні елементи.
Менделєєв організовував елементи у зростаючому порядку за їх атомними масами, дбаючи про розміщення в одній колонці тих, фізичні властивості яких подібні. Він навіть залишив порожні місця, передбачаючи існування інших елементів, ще не виявлених на той час, і які слід включити в таблицю.
Незабаром після цього німецький хімік Джуліус Лотар Майєр розташував елементи на основі фізичних властивостей атомів. Нарешті, його нинішня структура зумовлена швейцарським ученим Альфредом Вернером.
Останніми серйозними змінами в періодичній системі є робота лауреата Нобелівської премії з хімії Глена Сіборга, який, серед іншого, замовив серії актинідів нижче серії лантаноїдів.
- Телездоров'я Що це таке, як готувати, висвітлює Національний інститут старіння
- Як дізнатись, чи має моя собака ідеальну вагу
- Ваш смузі робить вас товстим. Ми знаємо, як цього уникнути
- Сурімі, з чого він зроблений, як виготовлений і що сприяє організму?
- Які мінерали втрачаються в поті і як їх замінити Супрадин®, вітамінний комплекс