- Вступ
- Про NŠC
- Новини
- Спорт
- Діагностика
- Освіта
- Шкільний спорт
- Інформаційна система
MUDr. Катаріна Берегендіова
Для підтримки психічного та фізичного здоров’я динамічний баланс дуже важливий для регуляції обмінних та фізіологічних процесів через нервову, ендокринну та імунну системи. Імунна система - це дифузний орган, який здатний координувати імунну відповідь, використовуючи велику кількість імунних клітин, розчинних факторів та транспортних молекул. Він є частиною нейро-ендокринно-імунної системи суперінформації.
Фізична активність спричиняє різні зміни імунологічних факторів, але ми все ще не знаємо, коли ці змішані та тимчасові зміни є біологічно значущими. Важливо відповісти на питання, коли вправи є загальнозміцнюючими для організму, а коли стресовими [Gleeson et al., 1995].
Зміни імунологічних показників при надмірних фізичних навантаженнях пояснюються кількома факторами. Реакція імунної системи така ж, як при сепсисі або травмі. Вважається, що ці ефекти спричинені місцевим ураженням м’язів, а також активацією гормональної та нейроендокринної систем [Straub et al., 1998].
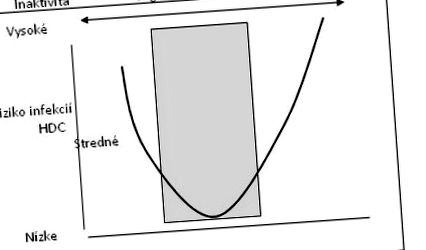
Рис.1: Залежність між інтенсивністю, обсягом тренувань та частотою появи
респіраторні інфекції [Петерс, 1997].
З початку 1960-х років докладаються зусилля для виявлення сигналу, який викликає нейроендокринну реакцію під час динамічної роботи. Протягом багатьох років увагу привертала кореляція між виходом лактату та ендокринною реакцією. Хоча взаємозв'язок між лактатом та нейроендокринною реакцією існує, результати ряду досліджень показують, що нейроендокринна реакція прямо пропорційна розміру задіяного м'яза [Vigaš et al., 1974]. При однаковому споживанні кисню нейроендокринна реакція була значно нижчою при роботі з верхніми кінцівками і вища, коли працювали важчі м’язи нижніх кінцівок [Kozlowski et al., 1983].
Згідно з останніми дослідженнями, під час роботи з м’язами спостерігається місцеве пошкодження м’язів. Ця пошкодження розвивається внаслідок запуску декількох механізмів, таких як зміна балансу внутрішньоклітинного рівня кальцію та порушення деградації м’язових білків. Ці зміни супроводжуються підвищенням рівня м’язових білків (КК, ЛДГ, міоглобіну та інших) у крові і є чудовими показниками пошкодження м’язів [Sorichter et al., 1999].
У той же час транспорт глютаміну в клітинах зменшується, і ці процеси спричиняють збільшення вироблення ІЛ-6 відразу після фізичного навантаження (приблизно в 100 разів), ІЛ-1ра через 1-2 години після фізичного навантаження (приблизно в 78 разів) та інших факторів такі як TNF-α, IL-8, IL-1b та інші. В результаті активації цитокінів експресія адгезивних молекул збільшується. Ці результати вказують на подібність між реакцією імунної системи на надмірні фізичні навантаження та реакцією цитокінів на сепсис [Pedersen, 1998].
На відміну від помірних фізичних навантажень інтенсивне тривале навчання може спричинити імунодепресію та зменшити захисні сили людини. Після гострих фізичних навантажень відбувається короткочасна транзиторна імуносупресія із зменшеною кількістю лімфоцитів та їх функцією. Ця короткочасна імуносупресія (так звана -імунодепресивне вікно - "відкрите вікно ") триває приблизно 3-12 годин. Недостатня регенерація та багаторазова перехідна імуносупресія може призвести до так званого перекриття відкритих вікон і, отже, до зниження імунної стійкості організму (рис. 2) [Fitzgerald, 1991]. У той же час відбувається взаємодія психічних та фізичних навантажень, які мають адитивний ефект. Наші результати [Sedláčková et al., 1999] показують, що протягом періоду імуносупресивного вікна кількість цитоксичних Т-лімфоцитів та NK-клітин значно зменшується залежно від зростаючого навантаження. Інші роботи також вказують на низький рівень лімфоцитів або імуноглобулінів. Наприклад Грін та ін. [1981] виявив низький абсолютний рівень лімфоцитів (нижче 1500 клітин/мл) у команді представників США на марафоні. Польські представники у велосипеді мали знижену неспецифічну імунну клітинну відповідь, а саме прилипання нейтрофілів та бактерицидну здатність [Lewicki et al., 1987].
Рис.2: Можливість перекриття повторної гострої імуносупресії під час фізичного навантаження
навантаження [Mackinnon, 1998].
Ці зміни можуть схилити людей до частих респіраторних інфекцій, синдрому хронічної втоми, вірусів личинок (CMV, EBV, герпес.) Або паразитарних інфекцій, про що свідчить епідеміологічне дослідження Петерса та Бутемана [1983]. Наприклад, у різних спортивних командах були повідомлення про збільшення захворюваності на інфекційний гепатит, поліомієліт, асептичний менінгіт та інші вірусні захворювання [Nieman et al., 1990]. З літератури відомо, що Себастьян Коу і Діана Едвардс, дві всесвітньо відомі спортсменки, страждали на токсоплазмоз - умовно-патогенну інфекцію, яка в основному вражає імунодефіцитних осіб [Fitzgerald, 1991].
Ознаки антигенів диференціації CD38 та CD122 свідчать про активацію лімфоцитів. Останній представляє β-ланцюг рецептора IL-2. Після фізичних навантажень кількість молекул статистично значно зросла CD38 та CD122, але після регенерації він опустився нижче початкових значень. Ці результати підтверджують теорію активації та подальшого перерозподілу лімфоцитів, в результаті чого продукція деяких цитокінів (головним чином IL-1, IL-6 та TNF-?) Також змінюється і експресія адгезивних молекул збільшується. Статистично значуще зниження CD122 після регенерації, ймовірно, вказує на зниження здатності лімфоцитів активуватися для імунної відповіді та причину можливого періоду зниження імунної резистентності ("відкрите вікно").
З параметрів гуморального імунітету ми зафіксували статистично найбільш суттєві зміни в IgA. У період 2 (березень 1998 р.) Рівень IgA в сироватці крові був значно вищим, ніж у період 3 (травень 1998 р.), Який був статистично значно нижчим, ніж у період 4 (липень 1998 р.), І це знову було значно вищим, ніж у період 5 (жовтень 1998 р.) ), який був статистично достовірно нижчим, значно нижчим, ніж у період 6 (квітень 1999 р.) - графік 3). Деякі дослідження не виявляють значних змін рівня імуноглобуліну, якщо вони не пояснюються зміною добового ритму або сезонними ефектами. Коливання фіксували лише після тривалих інтенсивних тренувань, таких як при перегляді найкращих плавців. Глісон та ін. [1995] описав довгострокове зниження рівня IgA, IgG та IgM у сироватці крові протягом семимісячного сезону у найкращих плавців, яке було значно нижчим у порівнянні з групою, що не займається спортсменами. MacKinnon and Hooper [1994] також виявили у дослідженні з найкращими плавцями, що вироблення IgA в основному знижується після тривалих та інтенсивних тренувальних періодів, особливо коли спортсмени перебувають у періоді можливого перетренування. Ми також оцінюємо зміни в нашому моніторингу, скоріше, як вплив сезонності (весна, осінь), а навесні також можливий вплив довготривалих інтенсивних тренувань на гоночний сезон.
Ці результати показують, що в наших вимірах ми зафіксували найбільш статистично значущі зміни залежно від періоду відбору проб в абсолютному вираженні. NK-клітини (CD16/56) і в сироваткових концентраціях IgA.
У елітних спортсменів, у яких підвищений ризик та частота фізичних вправ, ризик інфікування HDC може позитивно вплинути на ризик ускладнень, згаданих у попередніх розділах.
Однією з основних цілей профілактики та лікування наслідків короткострокової та довгострокової шкоди, спричиненої надмірним спортивним стресом, є мінімізація несприятливого впливу на імунну систему. Рекомендується кількісно та якісно скласти відповідним чином раціональне харчування, містять адекватну кількість білків і вуглеводів, що відповідає 60-70% вуглеводів, 12-15% білків і 15-25% жирів. На практиці переважний більший відсоток білків, менше вуглеводів і жирів. Несприятливе харчування призводить до негативного енергетичного балансу при зниженому споживанні вуглеводів і вітамінів, зневодненні та дисбалансі амінокислот.
На думку кількох авторів, із посиленим визнанням вуглеводи, під час фізичних навантажень спостерігається позитивний вплив на гормональну, а згодом і імунну відповідь. У дослідженні Bishop та співавт. [1999], коли 6% розчин вуглеводів вводили у кількості 400 мл до і 150 мл під час фізичних вправ, було виявлено зменшення зростання нейтрофілів та вплив на їх дегрануляцію. З цих результатів передбачається можливий вплив вуглеводів на зменшення стресу і, отже, імунну відповідь. Хоча вуглеводи позитивно впливають на ІС під час гострих фізичних навантажень, вони не перешкоджають зниженню рівня глутаміну і не впливають на імунні зміни внаслідок тривалих фізичних навантажень [Gleeson, 2000].
Вітаміниє необхідними органічними молекулами, які не синтезуються в організмі і тому повинні надходити з їжею. Вони виконують кілька функцій, найважливішими з яких є утворення попередників коферменту, які беруть участь в енергетичному обміні та беруть участь у синтезі білків та нуклеїнових кислот. Для підтримки нормальних імунних функцій вони по суті розчиняються в жирах вітамін А a Е і розчинний у воді вітамін В12 a C. Інші вітаміни (наприклад, В6 і фолієва кислота) також відіграють важливу роль, але їх дефіцит у людей надзвичайно рідкий [Gleeson, 2000]. Вважається, що споживання вітамінів у спортсменів є достатнім, але вітамінів із властивостями антиоксиданти (включати вітаміни С, Е та b-каротин) потрібно отримувати у збільшеній кількості. Вони мають захисний ефект при виведенні продуктів окисного стресу (вільних радикалів кисню, продуктів перекисного окислення ліпідів), що слідує за інтенсивними фізичними навантаженнями.
Вони також сприяють модулюючому впливу на імунну систему розсіяні елементи, найбільший цинку, залізо, селен a мідь.
У спортсменів не тільки фізична активність, а й неправильно підібране харчування діє синергічно на розвиток імуносупресії. Тому слід дотримуватися певних правил правильного харчування. Імунодепресивна дія надмірних фізичних навантажень зменшує споживання вуглеводів під час тренувань, а також адекватну кількість антиоксидантів. Однак слід зазначити, що перевищення дозволеного щоденного порогу рекомендованої дози може призвести до імуносупресії. Через це не рекомендується приймати підвищену кількість цих речовин у спеціальних таблетках, і вигідніше збільшити споживання овочів та фруктів. Як результат, найкращі спортсмени можуть допомогти запобігти імунодепресії за допомогою добре збалансованої дієти, що містить достатню кількість вуглеводів, білків, вітамінів та мікроелементів.
Завдяки їх імуномодулюючій дії також можуть застосовуватися деякі імуностимулюючі речовини, що регулюють, зокрема, природні імунні механізми. До таких речовин також належать пробіотики, які є живими мікроорганізмами або речовинами, які можуть впливати як на місцевий, так і на загальний імунітет. І слизова, і специфічна імунна реакція опосередковуються через ІС слизової. Пробіотики зв'язуються з М-клітинами, які переносять їх на бляшки Пайера. Вони стимулюють вироблення антитіл, активують лімфоцити та фагоцити та стимулюють вироблення певних цитокінів, зокрема IFN-g [Dugas et al., 1999]. Ференчик та ін. [1999] обстежив групу добровольців, яка протягом 6 тижнів отримувала пластину з пластинами, що містить 5,10 9 ліофілізованих ембріонів Enterococcus faecium M-74. У них було продемонстровано стимуляцію периферичних нейтрофілів до підвищеної настороженості фагоцитів, а В-лімфоцитів до збільшення продукції антитіл.
Внаслідок різних досліджень передбачається, що пробіотики мають кілька позитивних ефектів, як ми бачимо на малюнку 3.
Інші, дуже важливі фактори включають вплив зовнішніх умов (спека, холод), раціональне нарощування тренувального навантаження, підтримка збалансованості психічний стан і достатня сума спати.
Малюнок 3: Передбачуваний позитивний ефект пробіотиків [Dugas et al., 1999]
Наші результати, узгоджуючись з літературою, свідчать про перерозподіл лімфоцитів між периферичною лімфатичною тканиною та кровообігом, як можливий наслідок пошкодження м’язів, стимуляції нейроендокринної системи та збільшення експресії адгезивних молекул. Спираючись на ці висновки, ми можемо припустити, що надмірні фізичні навантаження без адекватної регенерації можуть схиляти людей до повторних респіраторних інфекцій, синдрому хронічної втоми та розвитку опортуністичних вірусних та паразитарних інфекцій.
Однак ці висновки поки відомі лише фрагментарно, і їх точний контекст відсутній. Потрібно відповісти на ряд питань, щоб пояснити та визначити взаємозв'язок між тренувальним навантаженням, змінами в імунній системі та рецидивуючими HDC-інфекціями, і тому необхідні подальші довготривалі контрольовані дослідження. Їх результати та нові знання мали б значне значення не лише для регулювання тренувального процесу або помірної фізичної активності, а й для визначення припущень конкретної людини щодо елітних видів спорту.
- Інформаційний центр П'єштяни; Національний сільськогосподарський та продовольчий центр - VÚRV Výskumný
- Порт і здоров'я Інтелектуальний електростимулятор з аксесуарами apple premium reseller - m zone
- Порт і фітнес
- Порт - чудовий доктор йоги, який займається ерекцією, айкідо від астми
- PORT BEURER PM 90 Монітор серцевого ритму