Написано 03 лютого 2020 року.
Індекс статті
- Ендометріально-матковий рак
- епідеміологія
- Фактори ризику
- Спадковий рак матки
- Патологічна анатомія та молекулярна біологія
- Ознаки та симптоми
- Діагностика
- Постановка
- Прогностичні фактори
- Лікування
- Слідувати
- Усі сторінки
АВТОР: драма Луїза Санчес Лоренцо
Матка - це м’язовий порожнистий орган, що має форму перевернутої груші. Він знаходиться в жіночому тазі перед прямою кишкою, позаду сечового міхура і стикається з піхвою. У верхню його частину з кожного боку входять маткові труби.
Він розділений на дві частини:
- Тіло матки: воно складається з верхніх двох третин і складається з двох частин: очного дна (заокруглена частина над входом в маткові труби) та перешийка (область безпосередньо над шийкою матки).
- Шийка матки або шийка матки виступає у верхню частину піхви.
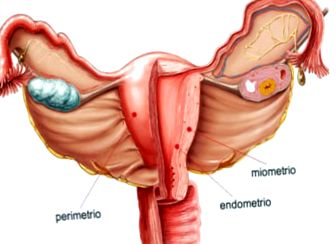
Стінка тіла матки складається з трьох шарів:
- Периметрій: зовнішня серозна туніка.
- Міометрій: оболонка оболонки, товстий шар гладком’язової тканини, розтягнутий під час вагітності. Тут розташовані магістральні судини і нерви матки.
- Ендометрій: внутрішня оболонка слизової оболонки, яка прилягає до міометрія. Ця підкладка оновлюється щомісяця після менструації.
Існують доброякісні ураження матки, які слід контролювати на предмет можливих ускладнень. Міома - це доброякісні пухлини, що походять із м’язової стінки матки. Ендометріоз - це наявність тканини ендометрію поза матки і може становити підвищений ризик розвитку інших пухлин. Пухлини матки здебільшого виникають в ендометрії через зміни в цих клітинах.
Епідеміологічні дані
У всьому світі рак матки є 7-м за частотою новоутворенням у жінок та 2-м гінекологічним новоутворенням після раку шийки матки. За підрахунками, у 2018 році було діагностовано близько 382 000 нових випадків (8,4 випадку/100 000 жінок) та зареєстровано майже 90 000 смертей (1,8/100 000 жінок). У розвинених країнах це найпоширеніший гінекологічний рак. Рівень захворюваності в цих країнах становить 14,7 випадків на 100 000 жінок із смертністю 2,3/100 000 жінок.
В Іспанії рак ендометрія є 4-м за частотою новоутвореннями у жінок із 6784 новими випадками захворювання у 2018 році, приблизно з частотою 13,7 випадків/100 000 жінок/рік та смертністю 3,6 випадків/100 000 жінок/рік.
Середній вік при постановці діагнозу становить 63 роки, але більше 90% випадків діагностується у жінок> 50 років. 4% пацієнтів ставлять діагноз до 40 років.
75-80% випадків діагностується на І стадії з 5-річним рівнем виживання 90%. На жаль, 5-річна виживаність нижча, коли існує регіональне (68%) або віддалене (17%) поширення.
Фактори ризику
Більшість випадків не можна запобігти, але зменшення факторів ризику може зменшити ймовірність розвитку захворювання.
Дуже важливо поінформувати всіх жінок про фактори ризику та симптоми раку ендометрія.
ФАКТОРИ РИЗИКУ
Надмірний вплив естрогенів:
Вік, середній вік при постановці діагнозу 62 роки.
-
Якщо є сімейна історія родички першого ступеня (матері, сестри чи дочки), ризик зростає з 50 років.
Попередня променева терапія малого тазу для іншого новоутворення.
Спадковий рак матки
Вважається, що із загальної кількості діагностованих в даний час раків ендометрія лише 2-5% є спадковими, якщо пацієнту був поставлений діагноз до 50 років, цей показник зростає до 10%.
Популяційний ризик у жінки розвитку раку ендометрія становить приблизно 2%, але коли це пов'язано із спадково-сімейним синдромом, ризик становить від 3-50%.
Спадковими синдромами, найчастіше пов’язаними з раком ендометрія, є Sd Лінча та Sd Коудена, останній рідше, оскільки є більш рідкісним.
В останні роки спадковий синдром раку молочної залози та яєчників (BRCA1/2) також був пов'язаний з розвитком раку ендометрія, особливо у BRCA1, тоді як зв'язок з BRCA2 залишається сумнівною. Іншими можливо пов'язаними спадково-сімейними синдромами є Peutz-Jeghers Sd та Li-Fraumeni Sd.
Sd лінч
BRCA 1/2
Sd cowden
Патологічна анатомія та молекулярна біологія
Класично класифікація пухлин є гістологічною, але оскільки нові знання набуваються на рівні молекулярної біології, ми можемо включити їх як додаткову інформацію, яка дозволить нам краще ідентифікувати.
Гістологічна класифікація:
Це дозволяє стратифікувати пухлини за кількістю мутацій, будучи здатним передбачити чутливість до імунотерапії (antiPDL-1), а також надавати прогностичну інформацію.
У клінічній практиці використовуються три імуногістохімічні методи (p53, MLH1, MSH2, PMS2, MSH6) та одна молекулярна техніка (мутації POLE) з метою наближення.
ПОЛЮС/надмірно
(5-7%)
MSI/гіпермутований
(28-30%)
Кількість копій низька
(39%)
Серозноподібний/p53 абн
(23-26%)
Ознаки та симптоми
- Аномальна генітальна кровотеча: кардинальний симптом (до 90% випадків)
1. У 45 років.
Діагностика
Зіткнувшись із будь-якими ознаками та симптомами підозри, пацієнтку слід направити в гінекологічний кабінет для оцінки.
1. Спрямований анамнез: складання особистих та сімейних факторів ризику пацієнта.
2. Гінекологічне обстеження: огляд за допомогою дзеркала і кольпоскопії, вагінально-абдомінальний огляд, що дозволить визначити розмір матки, і ректовагінальний огляд для наближення розмірів матки або інфільтрації прямо-вагінального підозра на перегородку та параметрію. Не забудьте пропальпувати гангліозні території.
3. Трансвагінальне ультразвукове дослідження: введення через піхву ультразвукового зонда, що дозволяє виміряти товщину ендометрія, точка відсікання товщини зазвичай встановлюється на рівні 3 мм, яка може бути різною залежно від того, перебуває пацієнт до та постменопауза. Якщо товщина більша або існує гінекологічна кровотеча, діагностичні дослідження будуть продовжені.
4. Гістероскопія: це візуальний огляд шийки матки та внутрішньої сторони матки за допомогою тонкої гнучкої трубки. Цей тест може мати діагностичну та терапевтичну цілі. Безпосередній огляд внутрішньої частини матки дозволяє зробити біопсію будь-якої підозрілої ділянки, виділення поліпів, фіброми або припікання ділянок кровотечі. Це може бути проведено з місцевою анестезією або без неї та є амбулаторною процедурою.
5. Аспіраційна біопсія ендометрію: мінімально інвазивна та амбулаторна техніка, що дозволяє проводити сліпі біопсії з лиць матки та маткових кутів. Висока чутливість специфічності у жінок до і після менопаузи.
6. Біопсія: взяття невеликого фрагмента ендометрію для підтвердження підозрюваного діагнозу.
Якщо діагноз раку ендометрію підтверджений, будуть запропоновані додаткові тести:
7. Пухлинні маркери: Зазвичай просять CA125, мінлива корисність залежно від типу гістології.
8. Ректоскопія та цистоскопія: дозволяють безпосередньо візуалізувати пряму кишку та сечовий міхур відповідно і будуть оцінені лише тоді, коли є висока підозра на інфільтрацію пухлини.
9. Тести зображень:
до. Тазовий магнітний резонанс (МРТ): вибір вибору для передопераційної стадії, оскільки саме він найкраще оцінює локорегіональне розширення пухлини, представляючи особливий інтерес товщину лінії ендометрія, наявність маси всередині міометрія, ступінь інфільтрація міометрія, ураження шийки матки чи ні та оцінка збільшення аденопатій.
b. Комп’ютерна томографія (КТ): дуже корисна для оцінки лімфаденопатії та наявності віддалених метастазів.
c. PET-CT: більша чутливість, ніж КТ або МРТ, для виявлення метастазів у лімфатичні вузли. В даний час, хоча воно широко прийнято як частина початкового розширеного дослідження, його основна роль полягає у виявленні рецидивів або у лікуванні місцевого рецидиву.
Постановка
Постановка пухлини дозволяє чітко визначити її розмір, локалізацію, місцеве та віддалене поширення (метастазування). Правильна постановка пухлини дозволяє нам розробити терапевтичну стратегію. Дві класифікаційні системи, що використовуються, - це система TNM та система FIGO, причому остання є більш розповсюдженою, але між ними існує кореляція. Останнє оновлення системи ендометрія FIGO відбулось у 2009 році, і саме воно зараз використовується для класифікації карцином матки та карциносаркоми. Саркоми маточного походження (лейоміосаркоми та строкові саркоми ендометрію) будуть дотримуватися іншої класифікації TNM та FIGO.
Постановка раку матки FIGO 2009
I етап
Пухлина, приурочена до тіла матки.
ШІ
Відсутність інвазії міометрія o Онкологічна стадія є одним з найважливіших прогностичних факторів.
- Ступінь 1: ≤5% неквамозного або немонулярного твердого росту (добре диференційований).
- 2 ступінь: від 6% до 50% неплоского або немонулярного твердого росту (помірно диференційований).
- 3 ступінь: 50% неквамозного або немонулярного твердого росту (погано диференційований або дедиференційований).
Лікування
Початкове хірургічне лікування раку ендометрія:
Хірургія є основою лікування. У пацієнтів з ендометріоїдним підтипом IAG1 на рак ендометрію та без виконаних генетичних побажань їх слід пройти обстеження в комітеті, щоб розглянути можливість відкладання остаточного хірургічного лікування.
Ад'ювантне лікування:
Придатність лікування після хірургічного підходу визначається виходячи з ризику рецидиву. Ці групи були складені на основі клініко-патологічних прогностичних факторів.
Лікування рецидиву:
У пацієнтів, у яких діагностовано місцевий рецидив (від 25 до 40%), перед тим, як запропонувати будь-яке лікування, біологію пухлини, інтервал без захворювань, кількість уражень та локалізацію, попередні методи лікування, резектабельність та загальний стан пацієнтів.
У пацієнтів із системним рецидивом лікування буде залежати від гістології та молекулярної біології. У пацієнтів з низькоякісними ендометріоїдними пухлинами та позитивними гормональними рецепторами буде розглядатися лікування гормональною терапією. При високоякісних пухлинах або неендометріоїдних гістологіях стандартне лікування складатиметься з карбоплатину та паклітакселу. Нещодавно лікування імунотерапією другої та третьої ліній показало високий рівень відповіді як монотерапії у пацієнтів з дефіцитом репараційних генів або мутацією POLE або в комбінації (пембролізумаб та ленватініб) незалежно від статусу репараційних генів. Вже проводяться випробування з імунотерапією першого ряду, для яких ми поки що не маємо результатів. В контексті метастатичного захворювання клінічні випробування завжди повинні бути розглянуті.
Терапевтичне майбутнє:
Для пацієнтів на початкових стадіях метою є:
- Розробити нові методи виявлення.
- Розробити протоколи управління сторожовим вузлом.
- Розробити нові гормональні методи лікування з метою збереження фертильності, особливо у молодих пацієнтів.
- Зменшити токсичність, пов’язану з променевою терапією.
- Інтеграція молекулярного профілю в ад'ювантне лікування, щоб залежно від профілю оцінювати придатність променевої терапії на початкових етапах і навіть з'ясовувати користь хіміотерапії у пацієнтів із високим ризиком.
Для пацієнтів у запущених стадіях:
- Найбільш вивчені шляхи - це імунотерапія та PI3K/AKT/mTOR (70% досліджень проти молекулярних мішеней при раку ендометрія).
- В імунотерапії переважають інгібітори контрольної точки. Вони представляють особливий інтерес для ультра- та гіпермутованих груп, оскільки мають більшу кількість неоантигенів, інфільтрацію лімфоцитів та експресію PD1/PDL1.
- Шлях PI3K/AKT/mTOR, мабуть, представляє особливий інтерес для підтипу з низьким числом копій та підтипу ендометріоїдів. Переважають поєднання з гормональною терапією. У клінічних випробуваннях із застосуванням темсиролімусу, летрозол-еверолімусу та темсіролімусу-бевацизумабу вже є деякі дані.
Калькування
Більшість рецидивів відбувається в перші три роки після постановки діагнозу. Мета спостереження складається з раннього виявлення рецидиву захворювання і додатково дозволяє контролювати вплив лікування на якість життя.
Більшість рецидивів є симптоматичними, найчастішими є наявність крові в сечі (гематурія), крові у калі (ректорія/гематохезія) та вагінальні кровотечі; у разі пред'явлення пацієнта слід направити на консультацію для оцінки.
Огляди визначатимуться залежно від ризику рецидиву, але загалом вони будуть проводитися кожні 3-6 місяців протягом перших двох років після закінчення лікування, а потім принаймні до п'ятого року кожні 6-12 місяців.
Кожен огляд повинен включати низку запитань, які можуть призвести до того, що ми можемо запідозрити місцевий рецидив, наприклад, чи була кровотеча, біль, шлунково-кишкові розлади чи дизурія. Ми також повинні запитати про короткочасні та довгострокові побічні ефекти лікування. Його слід використовувати для пропаганди звичок здорового способу життя в офісі. Повне фізичне обстеження повинно проводитися з пальпацією ганглієвих ланцюгів та оглядом живота, гінекологічне обстеження включатиме щонайменше огляд зі спекулем, бімануальне обстеження та біопсію будь-якого нового підозрілого ураження. Вагінальна цитологія при спостереженні за раком шийки матки не рекомендується, і навіть вважається неадекватною практикою. Визначення пухлинного маркера Ca125 під час спостереження можна розглянути у пацієнтів з підвищеним діагнозом або серозною гістологією, але це не є частиною звичайного спостереження.
Тести візуалізації (рентген грудної клітки, комп’ютерна томографія або УЗД черевної порожнини) у безсимптомних пацієнтів виявляють від 0 до 30% рецидивів, тому їх не рекомендують регулярно. Придатність проведення деяких візуалізаційних тестів під час подальшого спостереження також слід оцінювати індивідуально, наприклад, у випадках III-IV стадії FIGO на момент постановки діагнозу, де може бути рекомендована комп'ютерна томографія грудної клітини-живота тазу. Семестр протягом першого 2-3 роки.
Довгострокові побічні ефекти лікування:
- Холестерин ЛПВЩ, коли якість має значення більше, ніж кількість - Іспанське кардіологічне товариство
- Рослинні антиоксиданти, іспанське товариство дієти та науки Паркінсона та Альцгеймера
- Ми взяли участь у XIV зустрічі з питань ожиріння, діабету та харчування Іспанського медичного товариства
- Вісник Іспанського товариства біології
- Здорове та стійке харчування, виклик суспільства 21 століття - Gaceta Médica