Перегляньте статті та вміст, опубліковані в цьому носії, а також електронні резюме наукових журналів на момент публікації
Будьте в курсі завжди, завдяки попередженням та новинам
Доступ до ексклюзивних рекламних акцій на підписки, запуски та акредитовані курси
Мексиканський одонтологічний журнал, Офіційний орган Стоматологічної школи УНАМ, щокварталу публікує національні та міжнародні роботи, отримані в результаті оригінальних наукових досліджень, оглядових статей та звітів про клінічні, епідеміологічні та основні аспекти стоматології, іспанською або англійською мовами. Журнал був створений у 2004 році з метою відкриття простору в стоматологічній галузі, де, крім академічної спільноти факультету, братимуть участь колеги з інших установ, лікарень та асоціацій в країні та за кордоном. Система рівного арбітражу гарантує високі стандарти якості. Друковані копії розповсюджуються у бібліотеках понад 180 університетів світу, а онлайн-версія доступна безкоштовно.
Індексується у:
Бібліотека Університету Регенсбурга, Німеччина; Бібліотека Федерального університету Сан-Паулу, Бразилія; Бібліотека Інституту біотехнологій, UNAM; Цифрова бібліотека Університету Чилі, Республіка Чилі; Віртуальна бібліотека охорони здоров’я (VHL), Бразилія; LATINDEX (Регіональна інформаційна система для наукових журналів з Латинської Америки, Карибського басейну, Іспанії та Португалії); Академічний google; PERIODICA del CICH, UNAM; Медіграфічний; Біомедична література; SciELO
Слідкуй за нами на:
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Вступ
- Резюме
- Ключові слова
- Анотація
- Ключові слова
- Вступ
- Матеріал і методи
- Результати
- Обговорення
- Бібліографія
Метою цього дослідження була оцінка ступеня цитотоксичності in vitro, яку прополіс виявляє на поліморфно-ядерних лейкоцитах.
Матеріал і методи
Експериментальне, контрольоване дослідження in vitro. Статистична процедура: аналіз дисперсії повторних вимірювань та пост-хок Шеффе, встановлення статистичної значущості p Результати
Аналіз Шеффе з 95% надійністю для порівняння між контрольною групою та експериментальною групою: значуще з р 0,0001 для прополісу 1, контролю 1 та прополісу 2, контролю 2, для прополісу 1, прополісу 2, р 0,5002/контролю 1, контролю 2, р 0,9621.
Прополіс у розведенні 1: 4 наносився на поліморфно-ядерні лейкоцити протягом 1-2 годин в експерименті спричиняв загибель клітин на 70%; надаючи статистичну значимість.
Метою цього дослідження було оцінити ступінь цитотоксичності прополісу in vitro на поліморфно-ядерні лейкоцити.
Матеріали і методи
Це дослідження було експериментальним заходом in vitro, контрольованим. Статистична процедура передбачала аналіз дисперсії повторних вимірювань, а також пост-хок Шеффе. A p Результати
Аналіз Шеффе з 95% надійністю для порівняння між контрольною та експериментальною групами. Значимий з р 0,0001 для прополісу 1 контроль 1 і прополіс 2 контроль 2. Для прополісу 1 прополіс 2, р 0,5002/контроль 1 контроль 2, р 0,9621.
У цьому експерименті прополіс у розведенні 1: 4, застосовуваний протягом 1-2 годин до поліморфно-ядерних лейкоцитів, спричиняв 70% клітинної смерті. Це призвело до статистичної значущості.
Нещодавно матеріал під назвою прополіс виділяється в галузі досліджень природних продуктів, де література повідомляє, що він є бактерицидним, знеболюючим, фунгіцидним, протизапальним, загоюючим та антикаріогенним. 1
Ця смола виробляється бджолами, змішуючи речовини, зібрані з рослин, у пагонах, квіткових бруньках та смолистих ексудатах, створюючи матеріал для закриття прогалин, бальзамування мертвих комах всередині вулика та захисту від вторгнення комах та мікроорганізмів. 2 Інки виліковували гарячкові інфекції, тоді як в Європі це використовувалося французами у французів у 13-14 століттях для лікування болячок. Його терапевтичний ефект пояснюється різними фенольними сполуками, що входять до його складу, основними флавоноїдами та деякими фенольними кислотами, складними ефірами, альдегідами, спиртами та кетонами. 3-5
Фізико-хімічний склад прополісу:
-
•
Ароматичні смоли та бальзами 50-80%.
Ефірні олії та інші леткі речовини (від 4,5 до 15%).
Флавони, флавоноїди, флавонони, дигідрофлавони.
Бензиловий спирт, бензальценід та бензойна кислота.
Похідні коричного спирту, кумаринів, фенольних тригліцеридів.
Інші ароматичні елементи, монотерпени, гексатерпени, тритерпени.
Поліненасичені жирні кислоти та лінолева кислота.
Вітаміни А, В1, В2, В6, С, Е, нікотинова кислота, пантотенова кислота.
Мідь, марганець, магній, нікель, срібло, кремній, ванадій, цинк.
При народженні людина зазнає впливу незліченних мікроорганізмів, з якими він не контактував, вони можуть стати частиною її нормальної флори або спричинити захворювання, яке призведе до типу імунної відповіді, яка може бути неспецифічною, коли нейтрофільні поліморфно-ядерні лейкоцити (LPMN ) залучені або специфічні там, де і Т, і В-лімфоцити взаємодіють.6, 7
LPMN - основні фагоцитарні клітини, що знаходяться в периферичній крові, що відповідає 50-70% від загальної кількості клітин білого ряду. 7 Вони вважаються другою лінією захисту людського тіла, оскільки перша лінія захисту відповідає шкірі та слизовим оболонкам. 6 Період напіввиведення становить 8-20 годин у циркуляції, що збільшується при попаданні в інфіковані або запалені тканини. 8
Переміщення ЛПМН від капіляра до місця пошкодження складається з декількох етапів: 1. Маргінація: контакт ЛПМН зі стінками ендотелію. 2. Приєднання до ендотелію: через селектини та інтегрини. 3. Діапедез: трансендотеліальна міграція; Щоб це сталося, необхідно, щоб відбувся хемотаксис, тобто ЛПМН привертають до вогнища інфекції різні молекули, такі як: IL-8 (інтерлейкін 8), фактор комплементу C5a, LTB4 (лейкотрієн B4) та ін. . Фагоцитоз і загибель клітин. Руйнування мікроорганізму всередині нейтрофілу відбувається за двома механізмами: один залежить від кисню, а другий не залежить від кисню. 9
Після того, як нейтрофіл виконав свою функцію, він гине внаслідок апоптозу (запрограмованої загибелі клітин) з деякими характерними змінами, наприклад, збільшує експресію поверхневих маркерів фосфатидилсерину, що допомагає макрофагам їх усунути, запобігаючи тим самим можливому виділенню їх цитотоксичного вмісту до позаклітинного середовища, що становить перевагу апоптотичного нейтрофілу, оскільки зменшує невідповідну запальну реакцію, модель, яка базується на стратегії забезпечення переваги надмірної реакції при мікробній інфекції. 10 У нашому дослідницькому дослідженні ЛПМН ми розробили модель для виділення та очищення ЛПМН з периферичної крові, а потім протистояння їм різними речовинами, в даному випадку прополісом для вимірювання того, чи здатний він мати цитотоксичний ефект.
Матеріал і методи
Експериментальне, контрольоване дослідження in vitro зі статистичною процедурою: аналіз дисперсії повторних вимірювань та пост-hoc Scheffé, статистична значимість р 6 клітин на мл, досягнення кращого рівня лейкоцитів; за допомогою камери Нойбауера та світлових мікроскопів Leica та Van Guard та ручного лічильника.
Експериментальний дизайн. Наша система in vitro мала такі реагенти:
-
1.
Пробірку для зразків, що містила клітини, прополіс, середовище RPMI-1640, аналізували два рази на одну і дві години. Прополіс у розведенні 1: 4, що є мінімальною інгібуючою концентрацією; отримані в результаті попередніх експериментів, проведених Ларою, Тіноко та співавторами. одинадцять
Контроль життєздатності, який проводили з клітинами та культуральним середовищем RPMI-1640 як контрольної групи. По одному зразку з кожної групи залишали в інкубаторі при 37 ° C на одну і дві години. Результати спостерігали підрахунком мертвих і живих клітин з використанням 5% трипанового синього барвника, оцінюючи пофарбовані в синій колір клітини як мертві або нежиттєздатні, шляхом потрапляння барвника через клітинну стінку і мембрану та очищення живих клітин. фарбування і відсутність пошкодження клітин. У пробірки додавали 0,5 мл прополісу в концентрації 1: 4, 0,5 мл клітин плюс середовище. Після інкубації протягом однієї та двох годин спостерігали зображення, де спричинена аглютинація, та кілька поліморфно-ядерних лейкоцитів синього сигнального кольору, що вказує на загибель клітин.
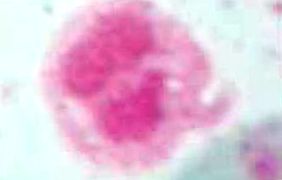
Чистота при отриманні LPMN, розділення нейтрофільних поліморфноядерних лейкоцитів проводили з чистотою від 95 до 100%, продемонстрованою плямою Райта під мікроскопією з 40-кратним об'єктивом.
На малюнку 1 ми бачимо лейкоцит, отриманий методом очищення декстрану, пофарбований Райтом, діапазон життєздатності цього методу був досить високим, досягаючи чистоти 95-100%.