Резюме
Доступ надано
Вступ
Повнорозмірне зображення
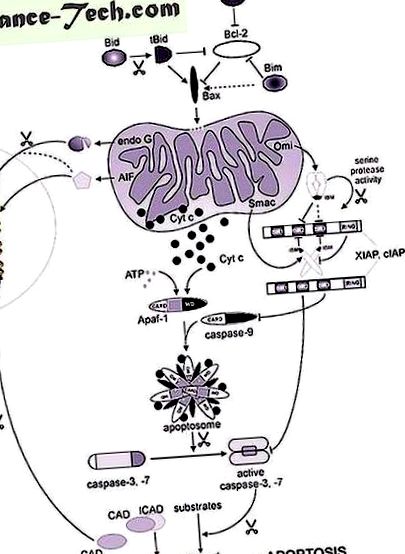
Спочатку ми описуємо цитохром с, перший мітохондріальний білок, що виділяється з мітохондрій в апоптотичних умовах. Цитохром c генерує каскадний каскад, сприяючи утворенню апоптосом, доки експресується фактор активації апоптотичної протеази 1 (Apaf-1). Далі ми зосередимось на ендонуклеазі G та факторі, що індукує апоптоз (AIF), що сприяє деградації ядерної ДНК. Його внесок у апоптотичне пошкодження ДНК обговорюється в контексті існування інших немітохондріальних нуклеаз, які активні в процесі апоптотичної загибелі клітин. Окрім цитохрому с, інші мітохондріальні фактори, такі як Smac/DIABLO та HtrA2/OMI, також можуть сприяти активації каспази, або опосередковано. Smac/DIABLO та HtrA2/OMI протидіють інгібітору білків апоптозу (IAP), сімейству клітинних інгібіторів каспази. Однак Smac та HtrA2/OMI також спричиняють незалежну від каспази загибель клітин через поки що невідомі механізми.
Цитохром c
Мітохондріальні медіатори конденсації ядерного хроматину та фрагментації ДНК.
Ендонуклеаза G
Фактор, що індукує апоптоз
Вивільнення відповідних гомологів AIF з мітохондрій та їх транслокація до ядра зберігається у Dictyostelium discoideum та нематоді C. elegans (Arnoult et al., 2001; Wang et al., 2002). Слід зазначити, що регулювання рівня експресії WAH-1, ортолога нематоди AIF, лише затримує програмовану загибель клітин нематод (PCD). Незрозуміло, чи взаємодіє AIF із стимулюючою активністю ендонуклеази G у ссавців, як це відбувається з аналогами C. elegans. .
Індуктор клітинної смерті, асоційований з мітохондріями, гомологічний AIF (AMID) та чутливий до p53 ген 3 (PRG3), пов’язаний з AIF (Ohiro et al., 2002; Wu et al., 2002). AMID - це гомологічний флавопротеїн AIF, який, як вважається, асоціюється із ВМО. Надмірна експресія AMID у клітинах 293T індукує апоптотичну загибель клітин, яка не може бути пригнічена Bcl-2, CrmA або zVAD-fmk. PRG3 знаходиться в цитоплазмі, і його передбачувана оксидоредуктазна активність не потрібна через його апоптотичну функцію. Молекулярний механізм дії AMID або PRG3-індукованої загибелі клітин незрозумілий.
Залежне від каспази вивільнення AIF діє незалежно від каспази та ендонуклеази G?
Smac/DIABLO та HtrA2/OMI: більше, ніж просто антагоністи IAP
Повний розмір таблиці
$ config [ads_text16] не знайдено
Повнорозмірне зображення
Смак/ДІАБЛО
Механізм, за допомогою якого Smac/DIABLO зв'язується з доменом BIR2 XIAP, незрозумілий, хоча для цього потрібні IBM та димерний Smac/DIABLO (Wu et al., 2000; Chai et al., 2001). Навпаки, взаємодія активної каспази-3 та -7 з доменом BIR2 XIAP не залучає вільного N-кінця або IBM. Як Smac/DIABLO може полегшити інгібування опосередкованих XIAP каспаз-3 та -7? Відповідь, схоже, полягає у димерній структурі, а отже, двовалентність Smac/DIABLO та наявність множинних доменів BIR у XIAP. Використовуючи аналізи активності каспази in vitro та зв'язування, Huang et al. (2003) нещодавно показали, що Smac/DIABLO взаємодіє як димер з молекулою XIAP, одночасно зв'язуючи домени BIR2 та BIR3. Ця взаємодія відбувається із субнаномолярною константою дисоціації (K D), тоді як взаємодія Smac/DIABLO з доменом BIR2 або BIR3 XIAP відбувається окремо з мікромолярним KD. Це хороший приклад авідності, сила зв’язку між двома молекулами, що визначається двома або більше місцями взаємодії. Ця сильна спорідненість до XIAP дозволяє Smac/DIABLO витіснити каспазу-7 (і каспазу-9) із XIAP in vitro, полегшуючи їх активацію.
Однак IAP можуть боротися зі Smac/DIABLO, щоб підтримувати антиапоптотичний стан у клітині. Повідомляється, що домен RING, присутній у XIAP, cIAP1 та cIAP2, має активність убиквітин-білкової лігази і може сприяти антиапоптотичній функції IAP, націлюючи Smac/DIABLO на деградацію, опосередковану протеасомами (MacFarlane et al., 2002; Hu та Ян, 2003). Однак у тимоцитах ця активність діє проти ВАП, оскільки було встановлено, що cIAP1 та XIAP самоубіквітуються та розкладаються у відповідь на лікування глюкокортикоїдами або етопозидом (Yang et al., 2000). Smac3, сплайс-варіант Smac, який також націлений на мітохондрії, містить IBM і вивільняється в цитозоль у відповідь на апоптотичні подразники, нещодавно показано, що він зв’язується з XIAP і сприяє повсюдному розвитку XIAP (Fu et al., 2003).
У протиріччя з цим елегантним Smac/DIABLO-IAP, антагонізм полягає в проапоптотичній природі Smac β, сплайсинговому варіанті Smac, який не має мітохондріальної послідовності націлювання і не зв'язує IAP, але сенсибілізує індукований лігандом апоптоз смерті та хімічні подразники. (Робертс та ін., 2001). Проапоптотична функція Smac β здійснюється його С-кінцевим доменом. Фізіологічна мітохондріальна функція Smac/DIABLO невідома, а миші Diablo -/- очевидно нормальні. Хоча лізати клітин Diablo -/- не виявляли обробки каспази-3 після додавання цитохрому с, миші та клітини Diablo -/- нормально реагували на апоптотичні подразники (Okada et al., 2002). Це спостереження свідчить про існування надлишкових факторів, які компенсують втрату Smac/DIABLO, можливо HtrA2/OMI (див. Нижче) або що Smac/DIABLO не відіграє суттєвої та загальної ролі в апоптозі під час розвитку.
HtrA2/IMO
Ядерно кодований HtrA2/OMI експресується як білок-попередник 50 кДа, що має N-кінцевий MLS, який видаляється при імпортуванні мітохондрій, а потім друга лідерна послідовність, що містить трансмембранний домен. Обробка цього другого лідера, яка відбувається в субпопуляції групи HtrA2/OMI, виявляє IBM і генерує 35 кДа зрілого HtrA2/OMI (Suzuki et al., 2001a; Hegde et al., 2002; Martins et al., 2002; van Loo et al., 2002b; Verhagen et al., 2002). Оскільки каталітично неактивний HtrA2/OMI у мишей mnd2 обробляється правильно, дозрівання HtrA2/OMI, ймовірно, каталізується іншими мітохондріальними протеазами (Jones et al., 2003).
Хоча мишей з дефіцитом HtrA2/OMI ще немає, експерименти RNAi пропонують внесок HtrA2/OMI в апоптоз, оскільки загибель клітин, індукована Fas, TRAIL, ставроспорином або УФ, значно зменшується (Hegde et al., 2002; Martins et al., 2002). На противагу цьому, фенотип mnd2, що приписується порушенню каталітичної активності HtrA2/OMI, характеризується підвищеною чутливістю до апоптотичних тригерів (Jones et al., 2003). Оскільки зниження регуляції експресії або рівня активності HtrA2/OMI буде впливати як на його мітохондріальну функцію, так і на її цитозольну роль у загибелі клітин, неможливо зробити тверді висновки щодо точного вкладу HtrA2/OMI у смерть. Клітинні, поки обидві функції не можуть бути пов'язані, наприклад, шляхом мутаційного втручання.
Інші мітохондріальні фактори
Висновки
Висловлення подяки
Ми дякуємо Аміну Бредану за його редакторську допомогу. Цю роботу підтримали Interuniversitaire Attractiepolen (IUAP-V), Fonds voor Wetenschappelijk Onderzoek-Vlaanderen (гранти 31.5189.00 та 3G.0006.01) та EC-RTD (Grant QLRT-CT-1999-00739), Гентський університет. співфінансування проекту ЄС (011C0300) та проекту GOA (12050502). X Saelens підтримується "Біотехнологічними фондами" та проектом GOA (12050502), L Vande Walle та N Festjens грантом від IWT, M van Gurp грантом від "Centrum voor Gezwelziekten", G van Loo отримав зарплату від El IUAP-V.
- Вісім найкращих протеїнових та гідратних шейків 2021 року - білкові коктейлі
- Кращий протеїновий коктейль 2021 Порівняння 7 найкращих
- Сім найкращих чистих сироваткових протеїнів 2021 року - білкові коктейлі
- Білки для вегетаріанців Повний список 【2021】
- Вісім найкращих фруктових і білкових коктейлів 2021 року - білкові коктейлі