Перегляньте статті та вміст, опубліковані в цьому носії, а також електронні резюме наукових журналів на момент публікації
Будьте в курсі завжди, завдяки попередженням та новинам
Доступ до ексклюзивних рекламних акцій на підписки, запуски та акредитовані курси
Місія гастроентерології та гепатології полягає у висвітленні широкого кола тем, пов’язаних з гастроентерологією та гепатологією, включаючи найновіші досягнення у патології травного тракту, запальних захворюваннях кишечника, печінки, підшлункової залози та жовчних шляхів, будучи необхідним інструментом для гастроентерологів, гепатологи, хірурги, терапевти та лікарі загальної практики, пропонуючи вичерпні огляди та оновлення на спеціальні теми.
На додаток до ретельно відібраних рукописів із систематичним зовнішнім науковим оглядом, які публікуються в розділах досліджень (наукові статті, наукові листи, редакційні статті та листи до редактора), журнал також публікує клінічні рекомендації та консенсусні документи основних товариств. . Це офіційний журнал Іспанської асоціації гастроентерології (AEG), Іспанської асоціації з вивчення печінки (AEEH) та Іспанської робочої групи з питань хвороби Крона та виразкового коліту (GETECCU). Публікація включена в Medline/Pubmed, в Розширеному Індексі наукових цитат та в СКОПУСІ.
Індексується у:
SCIE/Журнал цитованих звітів, Index Medicus/Medline, Excerpta Medica/EMBASE, SCOPUS, CANCERLIT, IBECS
Слідкуй за нами на:
Фактор впливу вимірює середню кількість цитат, отриманих за рік за твори, опубліковані у виданні протягом попередніх двох років.
CiteScore вимірює середню кількість цитат, отриманих за опубліковану статтю. Читати далі
SJR - це престижна метрика, заснована на ідеї, що всі цитати не рівні. SJR використовує алгоритм, подібний до рейтингу сторінок Google; є кількісним та якісним показником впливу публікації.
SNIP дозволяє порівняти вплив журналів з різних предметних областей, виправляючи відмінності в ймовірності цитування, що існують між журналами різних тем.
Аденоми - найчастіші новоутворення, розташовані в товстій кишці і прямій кишці, з поширеністю до 30-35% у віці від 50 років до 1,2 року. В даний час добре продемонстровано, що резекція цих уражень та подальше спостереження за допомогою колоноскопії зменшують ризик розвитку раку прямої кишки (КРР) 3-6. Відомо, що пацієнти з аденомами мають високу ймовірність розвитку метахронних аденом та КРР. З цієї причини всі товариства, що займаються профілактикою цього новоутворення, рекомендують проводити моніторинг пацієнтів, у яких виявлена колоректальна аденома через високий ризик розвитку метахронних уражень 7-10. Ця обставина, разом із прийняттям колоноскопії як скринінгової методики серед популяції проміжного ризику (особи старше 50 років, без особистих чи сімейних факторів ризику) та високого (із сімейною історією КПР або супутніх новоутворень) 10 збільшив попит на цю ендоскопічну техніку, що робить необхідним максимізувати її ефективність, щоб зменшити витрати, ризики та надмірне використання наявних ресурсів.
Періодичність ендоскопічного контролю після резекції аденоми визначається ризиком розвитку метахронних уражень. В даний час відомо, що певні ситуації збільшують цей ризик, такі як наявність 3 і більше аденом у початковій колоноскопії та наявність аденоми із заглибленим станом (АА) або КРР, 11 з цієї причини пацієнтам із цими ураженнями рекомендується інтервал між колоноскопіями коротше, ніж у тих, у кого лише 1-2 аденоми низького ризику 10 .
Однак наявна інформація щодо відносної важливості різних факторів, що визначають АА (розмір $ 1 см, ворсинковий компонент або наявність дисплазії високого ступеня [HGD]), залишається суперечливою. Знання того, чи не є будь-яка з цих характеристик додатковим ризиком порівняно з іншими, представляло б великий інтерес для досягнення кращої оптимізації стратегій нагляду. У цьому сенсі HGD визначено як основний маркер злоякісної трансформації аденоми 12, хоча його прогностичне значення щодо розвитку CRC або AA у підгрупі пацієнтів з AA у початковій колоноскопії невідомо.
Метою цього дослідження було оцінити, чи пов'язана наявність ХГД із підвищеним ризиком розвитку КРР або АА після ендоскопічної поліпектомії у пацієнтів з АА. Якби це було так, підгрупа пацієнтів із ХГД могла б проходити диференційоване спостереження від запропонованої для групи пацієнтів з АА.
МАТЕРІАЛ І МЕТОДИ
Були обстежені всі пацієнти, які проходили лікування у відділенні ендоскопії травлення лікарні Клінік-де-Барселона в період з січня 1996 р. По грудень 1997 р. Включені всі пацієнти з АА (розмір 1 см, наявність ворсинкового компонента або ХГД ) повністю резектована ендоскопічною поліпектомією. Пацієнти з особистим анамнезом ХРН або запального захворювання кишечника, сімейним анамнезом сімейного аденоматозного поліпозу або КРР, не пов’язаного з поліпозом, та пацієнти, у яких після первинної колоноскопії не проводився адекватний ендоскопічний контроль.
Усі пацієнти проходили спостереження в нашій службі з використанням загального протоколу спостереження, який передбачав проведення нової колоноскопії протягом перших 3 років після первинної колоноскопії, а потім кожні 3-5 років, залежно від результатів попереднього обстеження.
У початковій колоноскопії були зібрані такі змінні: вік, стать, показання до дослідження, інтубація сліпої кишки та загальна кількість, розмір та розташування поліпів, аденоми, АА та АА із виявленим ХГД. Визначення розміру уражень проводили шляхом порівняння розмірів відкритих щипців для біопсії (6 мм) з найбільшим діаметром поліпа. Ураження, розташовані в сліпій кишці, висхідні та поперечні, вважалися проксимальними, а дистальні - у низхідній товстій кишці, сигмовидної та прямій кишці.
Щодо досліджень, проведених під час спостереження, зібрані такі змінні: час, що минув з моменту базової колоноскопії та інтубація сліпої кишки, а також загальна кількість, розмір та місце розташування поліпів, аденом, АА та АА із ХГД виявлено., та наявність CCR.
У пацієнтів із декількома ураженнями вважали найбільш прогресивним з урахуванням гістології, розмірів, залозистого малюнка та ступеня дисплазії. Усі аденоми були класифіковані відповідно до класифікації ВООЗ 13 як дисплазія високого або низького ступеня. Розширена колоректальна неоплазія визначалася як наявність AA або CRC.
Пацієнтів класифікували на 2 групи на основі наявності або відсутності ХГД у початковій колоноскопії. Порівняння категоріальних змінних проводили за допомогою тесту x 2, тоді як для неперервних змінних використовували U-тест Манна-Уітні. Для розрахунку ймовірності розвитку запущеної колоректальної неоплазії під час спостереження були побудовані криві за допомогою методу Каплана-Мейєра та порівняні з використанням тестів логарифмічного рангу та індексу Бреслоу. Нарешті, були визначені базові параметри, пов’язані з появою запущеної та метахронної колоректальної неоплазії. Різниця вважалася статистично значущою, коли вона досягла р-значення РЕЗУЛЬТАТИ
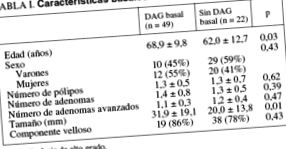
За період дослідження було зареєстровано 189 пацієнтів, у яких була діагностована наявність АА. З них 71 відповідало критеріям включення та були класифіковані у 2 групи за наявністю (n = 49) або відсутністю (n = 22) HGD. У таблиці I наведено базові характеристики цих пацієнтів. Суттєвих відмінностей між обома групами не виявлено щодо статі, кількості поліпів, аденоми, АА, наявності ворсинкового компонента або місця ураження. Однак вік (p = 0,03) та розмір АА (p = 0,01) були значно вищими у групі пацієнтів із ХГД.
Не було відмінностей у часі спостереження за пацієнтами із та без вихідного ХГД (56,5 ± 26,3 проти 61,6 ± 27,8 місяців відповідно; Р = 0,41). Подібним чином, кількість колоноскопій, проведених під час спостереження (3,1 ± 1,6 проти 2,6 ± 1,5, відповідно; p = 0,148), та інтервал між базовою колоноскопією та першим контрольним обстеженням (20,2 ± 17,8 [діапазон, 3,2-92,2] проти 26,6 ± 20,4 місяців [діапазон, 1,4-101,5] відповідно; p = 0,20) було подібним в обох групах.
У таблиці II порівнюються метахронні ураження, виявлені у пацієнтів із вихідним ХГД та без нього. Як бачимо, не виявлено відмінностей у кількості пацієнтів, у яких були виявлені поліпи, аденоми, АА, АА із ХГД або метахронні КРР, або щодо кількості цих уражень між обома групами. Ймовірність розвитку запущеної колоректальної неоплазії під час спостереження була однаковою в обох групах (log rank, P = 0,47; індекс Бреслоу, P = 0,58) (рис. 1). Подібним чином не спостерігалось різниці щодо ймовірності появи ХГД (логарифмічний діапазон, p = 0,47; індекс Бреслоу, p = 0,53) (рис. 2).
Рис. 1. Ймовірність розвитку запущеної колоректальної неоплазії під час спостереження, заснованої на наявності або відсутності високоякісної дисплазії (ХГР) у запущеній аденомі, виявленій у базовій колоноскопії.
Рис. 2. Ймовірність розвитку колоректальної неоплазії з високодисперсною дисплазією (HGD) або колоректального раку під час спостереження на основі наявності або відсутності HGD у запущеній аденомі, виявленій у базовій колоноскопії.
Розвиток запущеної колоректальної неоплазії під час спостереження не асоціювався з жодною з оцінених вихідних характеристик (стать [p = 0,33), вік [p = 0,08], розмір [p = 0,82], проксимальне розташування [p = 0,15], наявність ворсинкового компонента [p = 0,50] або HGD [p = 0,47], кількості поліпів [p = 0,76], аденоми [p = 0,95] або AA [p = 0,70] при початковій колоноскопії).
Важливо зазначити, що наша робота має певні обмеження. Перш за все, ті, що пов’язані з його ретроспективним дизайном, хоча всі змінні зібрані з комп’ютеризованого реєстру нашого підрозділу, що дозволяє нам уникнути або мінімізувати упередження відбору. По-друге, враховуючи те, що процес колоректального канцерогенезу відбувається повільно, більш тривалий період спостереження може збільшити ймовірність пошуку нових змінних, пов’язаних з розвитком розвиненої метахронної неоплазії. Нарешті, враховуючи низьку кількість включених пацієнтів, ми не можемо виключити, що відсутність відмінностей між цими двома групами не зумовлена низькою статистичною потужністю. Однак вичерпний аналіз, проведений з урахуванням не тільки появи CRC, але також аналізу AA з або без HGD під час спостереження, а також кількісна оцінка кількості виявлених уражень суперечить цій можливості.
На закінчення результати цього дослідження дозволяють припустити, що наявність ХГД не є додатковим фактором ризику розвитку передової метахронної колоректальної неоплазії у пацієнтів з АА. Якщо ці результати підтвердяться, не було б раціональної основи для зміни запропонованого інтервалу спостереження для всіх цих пацієнтів, незалежно від того, чи було це ураження віднесено до категорії АА на основі його розміру більше 1 см або наявності ворсинкового компонента . або DAG.
Реалізація цього дослідження стала можливою завдяки допомозі, отриманій від Фонду досліджень здоров’я (PI 05/1285) та Міністерства освіти і науки (SAF 04-07190). Франческо Балагер користується спеціалізованим контрактом після підготовки в галузі охорони здоров’я від Інституту Карлоса III, а Вікторія Гонсало - за контрактом на дослідження з лікарні Клінік, Інститут розслідувань біомедицини Августа Пі і Санєра (IDIBAPS).
- Ожиріння підтверджене як фактор ризику раку у жінок Instituto Gerontológico
- Кетогенна дієта як пусковий механізм розвитку еуглікемічного діабетичного кетоацидозу у пацієнта в Росії
- КУРС ВИКОНАВЦІВ ЗОН ВИСОКОГО РИЗИКУ - Сторінка 4 - Форум з питань розвідки, шпигунства та послуг
- Дієти з високим вмістом білків - переважно овочів - пов'язані з меншим ризиком розвитку
- Стрес як пусковий механізм ожиріння