Предмети
Резюме
Вступ
Аторвастатин - препарат, що знижує рівень холестерину, який зазвичай використовується для лікування гіперхолестеринемії. Він інгібує 3-гідрокси-3-метилглутарил-кофермент А-редуктазу (HMG-CoA), фермент, який каталізує граничний етап синтезу холестерину 11. Наскільки нам відомо, жодне опубліковане дослідження не пов'язувало зміни ГМ з лікуванням аторвастатином на моделі HFD-індукованої гіперхолестеринемічної щури. Завданням було дослідити, як ММ реагує на індуковане аторвастатином зниження рівня холестерину на моделі HHD-індукованої гіперхолестеринемічної щури. Зокрема, ми спробували з’ясувати, чи може медикаментозне лікування впливати на склад та різноманітність ГМ у щурів з гіперхолестеринемією щодо здорових людей контролю.
Результати
Гіперхолестеринемія та аналіз фармакологічних методів лікування.
Гіперхолестеринемія була підтверджена через 5 тижнів після годування HFD підвищеним рівнем холестерину в сироватці крові. Рівень холестерину (P 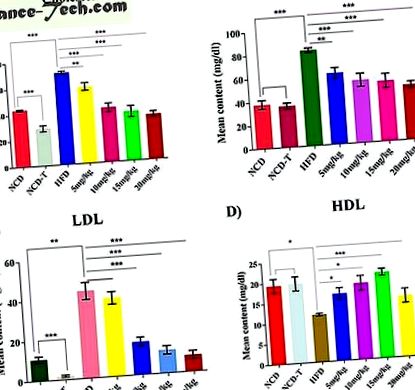
Відносна чисельність виражається у відсотках домінуючих та/або загальноприсутніх бактеріальних видів серед різних груп дієти та тих, хто лікується наркотиками. Точки відбору для відбору домінуючої філи були встановлені на рівні ≥1%, і загальноприсутні таксони були виявлені у> 50% щурів на групу. НИЗ, нормальна дієта чау; NCD-T, нормальна дієта чау + лікування аторвастатином; DFH, дієта з високим вмістом жиру; 5 мг/кг, HFD + 5 мг/кг аторвастатину; 10 мг/кг, HFD + 10 мг/кг аторвастатину; 15 мг/кг, HFD + 15 мг/кг аторвастатину; 20 мг/кг, HFD + 20 мг/кг аторвастатину.
Повнорозмірне зображення
Зміна мікробіоти кишечника у відповідь на HFD.
Дозозалежне зміна таксонів у групах, які отримували аторвастатин, порівняно з контролем
Відносна кількість протеобактерій значно зросла (P
Багатофакторний аналіз основних координат складу мікробних спільнот між різними групами. PCoA проводили з послідовностей на рівні OTU із подібністю> 97%, використовуючи незважену метрику відстані UniFrac. НИЗ, нормальна дієта чау; NCD-T, нормальна дієта чау + лікування аторвастатином; DFH, дієта з високим вмістом жиру; 5 мг/кг, HFD + 5 мг/кг аторвастатину; 10 мг/кг, HFD + 10 мг/кг аторвастатину; 15 мг/кг, HFD + 15 мг/кг аторвастатину; 20 мг/кг, HFD + 20 мг/кг аторвастатину.
Повнорозмірне зображення
Аналіз альфа-різноманітності послідовності читання. ( ДО ) Експериментально спостерігали криві розрідження OTU проти ( B ) за оцінкою Чао1. ( C. ) Біорізноманіття, оцінене за індексом Шеннона. НИЗ, нормальна дієта чау; NCD-T, нормальна дієта чау + лікування аторвастатином; DFH, дієта з високим вмістом жиру; 5 мг/кг, HFD + 5 мг/кг аторвастатину; 10 мг/кг, HFD + 10 мг/кг аторвастатину; 15 мг/кг, HFD + 15 мг/кг аторвастатину; 20 мг/кг, HFD + 20 мг/кг аторвастатину.
Повнорозмірне зображення
Як і в групах HFD, які отримували лікарський засіб, відносна велика кількість протеобактерій, сімейств (Porphyromonadaceae, Desulfovibrionaceae та Helicobacteraceae) та роду Helicobacter зросла в групі NCD-T порівняно з контрольною групою NCD-T. Крім того, Clostridiaceae, Lachnospiraceae, Spirochaetaceae та Eubacteriaceae продемонстрували значне збільшення групи NCD-T порівняно з контролем NCD (Додаткова таблиця 2). Подібним чином у групі NCD-T також збільшились роди Treponema, Lachnoclostridium, Barnesiella, Ruminococcus, Eubacterium, Desulfovibrio та Roseburia. У той час як серед домінуючих родів відносна кількість осцилоспір, превотелл, бактеріоїдів і парабактероїдів зменшилась у групі НИЗ-Т порівняно з контролем НИЗ (Додаткова таблиця 3).
Співвідношення статі та рівня холестерину.
Кореляцію статі з рівнем холестерину проводили за допомогою непараметричного кореляційного аналізу Спірмена. Встановлено, що домінуючі таксони, які були змінені в групах з NCD-T, HFD, 5 мг/кг, 10 мг/кг, 15 мг/кг та 20 мг/кг, корелюють з різними холестеролами. Роди, які негативно корелювали з рівнями ЛПНЩ (ρ> −0,17), TG (ρ> −0,14) та рівня холестерину (ρ> −0,27), включають Clostridium, Desulfovibrio, Roseburia, Blautia, Helicobacter, Ruminococcus та Lactobacillus (рис. 5). ). Однак було встановлено, що Превотелла, Копрокок, Превотелла [YRC22], Парапревотелла, Клостридії [SMB53] та Дорея позитивно корелювали з рівнями ЛПНЩ (ρ> 0,2), ТГ (ρ> 0,1) та холестерину (ρ> 0,26). (Рис. 5). Аналогічно, Осцилспіра (ρ> 0,33) показала позитивну кореляцію з рівнем ЛПВЩ (рис. 5).
Лікування аторвастатином у групі HFD збільшило відносну чисельність родів Bacteroides та Parabacteroides. Бактероїди та парабактероїди мали максимальну кількість у дозі 10 мг/кг та 15 мг/кг відповідно. Подібним чином введення волокон брусниці мишам ApoE -/-, що харчуються HFD, підвищувало рівень Bacteroides і Parabacteroids разом із зниженням рівня TG. Бактероїди пов’язані з метаболізмом жовчних кислот і сприяють декон’югації жовчних кислот, кон’югованих з таурином, присутнім у сироватці крові 18, 33. Дієта з високим вмістом холестерину/холінової кислоти модифікувала склад фекальних жовчних кислот 34, і, як повідомляється, змінена жовчна кислота асоціюється з дисбіозом 35. Рівень десульфовібріо (бактерії, що продукують ендотоксини та сульфати) 36, 37 продемонстрував збільшення відносної чисельності у групі NCD-T.
Подібним чином рід Parabacteroides, що включає 38 протизапальних бактерій, продемонстрував постійне збільшення відносної чисельності при різних дозах аторвастатину в групі HFD. Румінокок (бактерія, що продукує триптамін) 39 показав пригнічений рівень при лікуванні аторвастатином щурів, що харчуються HFD. Рід Oscillospira, до якого входять продукти, що продукують бутират, продемонстрував постійне збільшення груп HFD, які отримували лікарські засоби. Лікування рапаміцином (регулятором споживання та накопичення енергії) у індукованих HFD щурів із ожирінням призвело до збільшення кількості Turicibacter 41. У нашому дослідженні було виявлено зниження рівня Turicibacter у групах HFD, які отримували лікування. Подібним чином Clostridium (таксини, що продукують бутират) 42 показав знижений рівень у групі, яка отримувала препарат. Згідно з нашими результатами, Di Lucci et. Ал повідомили про збільшення кількості копрококів у метаболічному синдромі, спричиненому дієтою, багатою фруктозою, у щурів із ожирінням 43 .
Кетрі та ін. повідомили про підвищення рівня видів Lactobacillus після введення езетимібу та симвастатину мишам, які годували НИЗ 7. Ми спостерігали збільшення відносної чисельності лактобактерій у групі NCD-T. Знижуюча холестерин здатність бактерій роду Lactobacillus раніше була продемонстрована введенням Lactobacillus reuteri LR6, Lactobacillus reuteri NCIMB 30242 та Lactobacillus johnsonii BS15 у гіперхолестеринемічних щурів та пацієнтів та на мишачій моделі з неалкогольною печінковою недостатністю, печінка 4444, 45. Потенційна здатність до зниження рівня холестерину видів Lactobacillus потребує додаткових досліджень, щоб встановити його точну роль у метаболізмі холестерину. Ми спробували встановити кореляцію між рівнем холестерину у щурів та відносною кількістю потенційних бактерій, що знижують рівень холестерину під час лікування аторвастатином. Обмеженням нашого дослідження була відсутність метаболічних даних. Використання цього засобу може надати детальний зв’язок між складом метаболітів сироватки крові та мікробіомом у контексті лікування аторвастатином.
В цілому, це дослідження підкреслило вплив аторвастатину на ГМ на контрольній тварині з HFD. Зокрема, введення аторвастатину збільшило бактеріальне різноманіття та змінило відносну чисельність кількох домінуючих таксонів, які були модифіковані HFD у бік фенотипу НИЗ. Лікування аторвастатином також призвело до специфічного впливу препарату на розподіл певних бактерій у групах HFD та NCD-T, які отримували препарат. Різні класи препаратів, що знижують рівень холестерину, можуть впливати на мікробіом кишечника та забезпечувати потенційний зв’язок між складом ГМ, рівнем холестерину та медикаментозною терапією. На закінчення слід сказати, що препарати, що знижують рівень холестерину, які зазвичай призначають під час гіперхолестеринемії, слід зважити, щоб змінити вплив на мікробіоми, що може мати важливі наслідки для здоров’я господаря.
Матеріал та реактиви
Модель тварини та лікування.
Сорок два специфічних безпатогенних щури Wistar (100–120 г) були надані Будинком тварин Департаменту біохімії Університету короля Абдулазіза, Джидда, Саудівська Аравія. HFD містив 3% холестерину (Sigma Aldrich Co., США), 0,2% холевої кислоти (Sigma Aldrich Co., США), 15% яловичого жиру і 81,8% нормальних кормів. Всі додані компоненти приймали як відсоток від загальної дієти. Аторвастатин (Pfizer Inc., США) використовували як препарат, що знижує рівень холестерину 47. Всі експерименти на тваринах у цьому дослідженні проводились у приміщенні для тварин на кафедрі біохімії факультету наук університету короля Абдулазіза. Протокол дослідження був затверджений Комітетом з етичних досліджень Медичної школи університету короля Абдулазіза під номером угоди (реєстраційний номер HA-02-J-008). Експеримент проводився відповідно до затверджених рекомендацій.
Щурів адаптували до стандартизованих екологічних параметрів будинку для тварин протягом 7 днів, включаючи температуру (21 ± 1 ° C), відносну вологість (60 ± 10%) та 12-годинний денно-нічний цикл. Екологічні умови будинку для тварин зберігалися до кінця експерименту. Спочатку 42 щурів були випадковим чином розділені на дві групи і їх годували або звичайною чау-дієтою (NCD; n = 12), або дієтою з високим вмістом жиру (HFD; n = 30). Гіперхолестеринемія підтвердилася через 5 тижнів лікування ВЧС. З групи NCD шість щурів отримували дозу 10 мг/кг/день аторвастатину (NCD-T), тоді як інші шість щурів тримали як контролі проти NCD. У індукованій HFD групі гіперхолестеринемічної групи шість щурів служили контролями HFD, а решта 24 щури були розділені на чотири рівні групи та оброблені різними концентраціями аторвастатину (5, 10, 15 або 20 мг/кг/добу). Аторвастатин суспендували у розрахунковій кількості стерильної дистильованої води за допомогою магнітної мішалки, а препарат вводили внутрішньошлунково один раз на 24 години за допомогою катетерної трубки 47. Тварин лікували аторвастатином протягом 28 днів.
Забір зразків крові та тканин та аналіз рівня холестерину.
Зразки крові відбирали з орбітального сплетення два рази: через 5 тижнів для підтвердження гіперхолестеринемії у групі з HFD та перед жертвою для оцінки впливу медикаментозного лікування на рівень холестерину в досліджуваних групах. Сироватку виділяли із зразків крові центрифугуванням при 3000 об/хв при 4 ° С протягом 15 хв. Ліпідний профіль, включаючи сироватковий ЛПНЩ, холестерин, ТГ та ЛПВЩ, аналізували за допомогою автоматизованого біохімічного аналізатора (Aeroset 09D0501, американський). Вміст сліпої кишки збирали у всіх тварин відразу після жертвопринесення і зберігали при -80 ° C для виділення ДНК.
Послідовність 16S рРНК та обробка даних
Метагеномну ДНК витягували із вмісту сліпої кишки за допомогою набору AccuVisBio для виведення стільця з ДНК (AccuVisBio, Абу-Дабі) відповідно до інструкцій виробника, а концентрацію ДНК вимірювали за допомогою системи Qubit (Invitrogen, США). Зразки секвенували для 16 генів рРНК, націлюючи на область V3-V4 універсальними праймерами штрих-коду 341 F і 785 R, дотримуючись процедури Dowd et al. 48. Завдяки обмеженому циклу ПЛР для з’єднання зчитувань використовувались штрих-коди з подвійним індексом Illumina та адаптери послідовності. Після очищення бісером Agencourt AMPure (Agencourt, США) бібліотеки нормалізували, використовуючи протокол Nextera XT. Зразки об'єднували в одну проточну комірку для секвенування на платформі секвенування MiSeq (Illumina, Сан-Дієго) відповідно до протоколу виробника. Автоматизоване генерування кластера та парне кінцеве секвенування з подвійним індексом зчитування виконувались за один прогін з довжиною зчитування 2 х 300 bp.
Парне остаточне зчитування було зібрано за допомогою PANDAseq, а необроблені файли FASTQ отримані з Illumina MiSeq 49. Праймери та штрих-коди були видалені з послідовностей. Всі читаються з 'N', а ті з послідовностями 50. Очищені послідовності об'єднували при k = 10 (97% подібності) з наступним видаленням химер та однотонної проби 51,52. Нарешті, OTU класифікували за допомогою QIIME 1.9 щодо куратизованої бази даних, похідної від GreenGenes 53. Дані послідовності для цього дослідження доступні в Європейському архіві нуклеотидів за проектом №. PRJEB23060.
статистичний аналіз
Біорізноманіття та багатство ОТУ були розраховані за допомогою QIIME 1.9, реалізованого з непараметричним аналізом Chao1 та розрідженням, який показав рівномірність та розподіл ОТУ в різних групах. Дані були нормалізовані до рівної кількості зчитувань на зразок, і PCoA проводили з послідовностей рівня OTU із подібністю> 97%, використовуючи незважену метрику відстані UniFrac. Графік PCoA переглядав ІМПЕРАТОР. Односторонні ANOVA (для параметричних даних) та Крускала-Уолліса та Манна-Уітні (для ненормальних даних) проводили непараметричні тести для виявлення суттєво різних бактеріальних таксонів між різними групами, тоді як використовували тест Колмогорова-Смірнова D. для визначення нормальності даних. Для статистичного аналізу використовували версію 16 SPSS. Відмінності в рівні холестерину між контрольною та обробленою групою аналізували за допомогою критерію t Стьюдента (два хвости) за допомогою GraphPad Prism версії 6.01 (Graph Pad Software, Сан-Дієго, США), а суттєві відмінності позначали як * P
- Надлишок солі в раціоні пошкоджує мікробіоти кишечника
- Кишковий дисбіоз - мікробіота кишечника Барселони
- Два дуже поширені емульгатори змінюють мікробіоти кишечника мишей • Тенденції21
- Вплив введення бета-циклодекстрину в дієту на ліпідний профіль щурів
- Дізнайтеся, як мікробіота кишечника регулює кров’яний тиск
