предметів
реферат
У п’яти-10% дітей із ГМЛ de novo і до 23% пацієнтів із рецидивом ОМЛ мають рефрактерне захворювання, яке визначається як неможливість досягнення морфологічної ремісії після двох циклів хіміотерапії. 1, 2, 3, 4 Оскільки захворюваність на ПМЛ у педіатричної популяції у Великобританії становить 70 випадків на рік, 8-12 дітей на рік, як очікується, будуть тугоплавкими ПВК в країні. Історично прогноз для цієї підгрупи пацієнтів був нейтральним, нещодавні спільні дослідження свідчать про загальну виживаність (ОС) 22 та 14% для первинної рефрактерної та рефрактерної дитячої ОМЛ. 3, 4
Найкраще лікування для цих пацієнтів ще не визначено. Алогенна трансплантація гемопоетичних стовбурових клітин (SCT) є стандартом лікування фронтальної або рецидивної ЛМП високого ризику. 5, 6, 7 Однак дані про результати пацієнтів, які перенесли ТКЗ з приводу рефрактерної хвороби, є спотвореними. Різні підходи та суперечливі когорти дали дуже різні результати: показники виживання 0-35% та смертність від трансплантації (TRM) до 40%. 4, 9, 8, 9, 10, 11, 12, 13, 14
Зокрема, щодо дітей, які не перебувають у стадії ремісії при трансплантації, у чотирьох різних документах повідомляється про 160 пацієнтів. 4, 8, 10, 14 Три з цих документів (включаючи два проспективні національні дослідження) документують 0% довгострокової ОС для дітей з активними захворюваннями в СКТ. 4, 10, 14 На відміну від них, Бунін та співавт. 8 задокументованих випадків виживання без лейкемії (LFS) 12% для дітей із первинною рефрактерною ОМЛ та 20% для рецидивів рефрактерних пацієнтів. Крім того, про 19% ОС повідомлялося в аналізі реєстру, який поєднував дані CIBMTR для дорослих та дітей у 1428 пацієнтів з РМЛ у ремісії при трансплантації. У цьому контексті пропонується відсоток бластів при трансплантації, невідповідний або не пов’язаний донор, низький рівень продуктивності та цитогенетика з низьким ризиком як можливі комбіновані фактори ризику для гіршого результату.
Через несприятливий прогноз рефрактерної ОМЛ, нещодавній огляд не рекомендує поставляти SCT дорослим із відсотком бластів> 25% у кістковому мозку (ТМ) при трансплантації. Рекомендацій щодо лікування дітей з подібною ситуацією немає. Для більшості з цих пацієнтів не потрібні інші альтернативні варіанти лікування, тому необхідні додаткові дані для прийняття обґрунтованого рішення з урахуванням потреб пацієнта. Це багатоцентрове, ретроспективне дослідження мало на меті оцінити результати та виявити прогностичні фактори для дітей, які отримали першу SCT для первинної рефрактерної або рецидивуючої рефрактерної AML з активним захворюванням у SCT.
Матеріали і методи
пацієнтів
Пацієнти віком від 0 до 18 років, які пройшли першу алогенну SCT для первинної тугоплавкої або рецидивуючої тугоплавкої ПМЛ в 1 з 13 педіатричних центрів трансплантації у Сполученому Королівстві між 2000 і 2012 роками, і про них повідомлялося Британському товариству з трансплантації крові та трансплантації кісткового мозку ( BSBMT). для цього дослідження, якщо вони мали активне захворювання, задокументоване протягом 2 тижнів від початку режиму кондиціонування. Пацієнти з AML FAB M3 та ювенільним мієломоноцитарним лейкозом були виключені з дослідження. Рефрактерну хворобу визначали як> 5% бластів при БМ або морфологічно, або цитогенетично, або молекулярно, або доведеною екстрамедулярною хворобою
2 цикли індукційної/реіндукційної хіміотерапії.
Первинна індукційна недостатність визначалася як> 5% бластів у БМ або морфологічно, або цитогенетично, або молекулярними методами в кінці другого індукційного курсу.
CR визначали BM за нормального гемопоезу та морфологічно 6, 16
Вихідні дані були підтверджені для підтвердження діагнозу рефрактерної хвороби у всіх пацієнтів шляхом вивчення морфології та цитогенетичних/молекулярних результатів у значущі моменти часу, але централізованого морфологічного огляду аспірату кісткового мозку до проведення ССТ не проводили.
Згода на дані для реєстрації в реєстрі BSBMT для аналізу результатів та досліджень була отримана під час трансплантації відповідно до керівних принципів EBMT.
Трансплантація
Сумісність HLA із донором, пов’язаним із дорослим або не пов’язаним з ним, була визначена шляхом типізації з високою/середньою роздільною здатністю для локусів HLA-A, -B, -C, -DR, -DQ. Сумісність HLA з не пов'язаним шнуром визначали як типізацію з високою/середньою роздільною здатністю для локусів HLA-A, -B, -DR. Сумісність HLA із донором-братом або сестрою була визначена набором тексту з низькою роздільною здатністю для HLA-A, -B, -C, -DR, -DQ. Донори були визначені як однакові брати та сестри HLA, якщо вони успадкували ті самі батьківські гаплотипи, що і їх реципієнти. Пари донорів-реципієнтів визначали як відповідність HLA (MD), якщо вони складали 10/10 (дорослий донор) або 6/6 (кабель), і невідповідність HLA (MMD).
Режими кондиціонування визначали як "знижену інтенсивність" відповідно до критеріїв Чампліна, а мієлоаблативно - інакше. Коротко, режим кондиціонування вважався мієлоаблативним, якщо він викликав незворотну цитопенію без пошкодження стовбурових клітин та зі зниженою інтенсивністю, що призводило до оборотної мієлосупресії, пов'язаної з низьким рівнем негематологічної токсичності. 17
Кінцеві точки вивчення
Первинною кінцевою точкою дослідження була LFS через 5 років після SCT у дітей з первинною рефрактерною або рецидивуючою рефрактерною AML, трансплантованою в період ремісії. LFS визначали як час від трансплантації до рецидиву або смерті з будь-якої причини, залежно від того, що настає раніше. Вторинні кінцеві точки включали частоту гострих та хронічних РТПХ, частоту рецидивів, TRM та 5 років ОС. TRM визначався як будь-яка смерть, що сталася в Чеській Республіці; ОС визначався як час від SCT до смерті, незалежно від причини.
Статистичний аналіз
Дані пацієнтів збирали через базу даних BSBMT та перевіряли у кожному центрі. Дані перевіряли на узгодженість, а остаточний аналіз проводили за допомогою статистичного програмного забезпечення Stata (StataCorp. 2015. Stata Statistics Software: Release 14, College Station, TX: StataCorp LP) та R. Подальше оновлення оновлено 1 січня 2016 р. Результати описового аналізу наводяться як медіани та діапазони. Оцінки Каплана-Мейєра та довірчі інтервали використовувались для оцінки LFS та OS, а для порівняння використовували логарифмічний тест (дискретні змінні) та регресію Кокса. 18 Пацієнтів піддавали цензурі під час останнього спостереження, якщо ніяких подій не відбулося. Сукупна частота рецидивів та TRM була оцінена, враховуючи конкурентні ризики, використовуючи метод Fine-Grey. 19 Прокс-пропорційні регресійні моделі ризику Кокса були використані для оцінки впливу наступних змінних на вік рецидиву, ЛФС та ОС: вік, цитогенетична група ризику, первинний та рецидивуючий рефрактерний, відсоток бластів у БМ у СКТ, режим кондиціонування, тип донора (використання проти невідповідності).), використання виснаження Т-клітин, джерела стовбурових клітин та наявність гострої та хронічної РТПХ. Довірчі інтервали повідомляються на рівні 95%, а статистичні тести проводились на 0,05 (двосторонні).
результат
Характеристика пацієнтів
Шістдесят один пацієнт був ідентифікований за допомогою реєстру BSBMT як реципієнт SCT на рефрактерну ОМЛ не в Чехії в SCT між 2000 і 2012 рр. Двох пацієнтів виключили на підставі діагнозу ювенільного лейкозу мієломоноцитів, а 15 пацієнтів виключили як перевірку даних. не підтверджує діагноз рефрактерної ОМЛ. Були проаналізовані решта 44 пацієнтів, для яких перевірка вихідних даних підтвердила рефрактерну хворобу. Характеристики 44 пацієнтів, які взяли участь у дослідженні, зведені в таблицю 1.
Стіл в натуральну величину
Характеристика трансплантації
Стіл в натуральну величину
Процес після трансплантації
У таблиці 3 узагальнено результати нашої когорти після трансплантації. Один пацієнт помер на +10 день (септична подія) і один день + 14 (прогресування захворювання). З 42 оцінюваних пацієнтів 39 досягли прихильності (93%). Медіана часу до приживлення нейтрофілів становила 15 днів (діапазон 10-42). У двох пацієнтів спостерігався рецидив при трансплантаті (5%). Гострий GvHD був зареєстрований у 23 пацієнтів (52%) і був важким у восьми пацієнтів (19%). Один пацієнт мав обмежену та дві великі хронічні ГВСГ, загальна захворюваність становила 7%. GvHD вважався причиною смерті у двох пацієнтів нашої групи.
Стіл в натуральну величину
результат
Дев'ять пацієнтів померли в Чеській Республіці від причин, пов'язаних з трансплантацією (два пов'язані з РТПХ, одна серцева токсичність, одна інфекція грудної клітини Aspergillus, один енцефаліт, одна інфекція, пов'язана з CMV, один сепсис, один ендокардит, одна аденовірусна пневмонія). П'ятеро з цих восьми пацієнтів померли до дня +100 після SCT. TRM у день +100 та день +365 становив 11% (95% ДІ 4-23%) та 18% (95% ДІ 9-31%).
З 44 пацієнтів 30 (68%) досягли CR після SCT. Вісімнадцять людей живуть у Чеській Республіці, і 5-річний показник LFS у цій групі становив 43% (95% ДІ 28–57%) із середнім періодом спостереження 6 років та 9 місяців. Сімнадцять пацієнтів рецидивували в середньому за 61 день після SCT (діапазон 13 - 279) і всі померли від прогресування захворювання. Один пацієнт, що перехворів, вступив в інший КР після подальшого лікування, яке пройшло повторний ІКТ, після чого він перехворів і помер через прогресування захворювання. Сукупна частота рецидивів становила 32% через 5 років (95% ДІ 19–46%).
Аналіз підгрупи
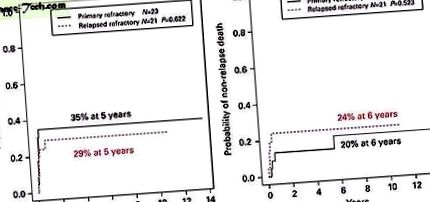
Ризик рецидивів та нерецидивної смертності був однаковим у пацієнтів із первинною рефрактерною та рецидивуючою рефрактерною хворобою (рис. 1). Як результат, 5-річна ШЛС та ОС у пацієнтів з первинною рефрактерною ОМЛ (43% (ДІ 22-62%) та 43% (ДІ 22-62%)) перекривались з пацієнтами з рецидивуючими рефрактерними захворюваннями (43% (ДІ 22 -62%)). –62%) та 43% (ДІ 22–62%)) (Малюнок 2). Аналогічним чином, пацієнти з несприятливою цитогенетикою не мали гірших показників, ніж пацієнти зі стандартною цитогенетикою (сукупний коефіцієнт рецидивів 29% проти 42%, Р = 0,345). На відміну від цього, у жодного з пацієнтів із сприятливим цитогенетичним профілем рецидив після трансплантації (рис. 3) та їх 5-річний ЗНС не становив 67% (ДІ 19–90%), хоча це не досягло статистичної значущості через низьку кількість пацієнтів в цьому випадку. (n = 6).
a ) Сукупна частота рецидивів після ТКЗ у дітей з первинною рефрактерною ЛМЛ та дітей з рецидивом рефрактерної АМЛ. ( b ) Кумулятивна частота нерецидивної смертності після ІКТ для дітей з первинною рефрактерною AML та дітей з рецидивуючими рефрактерними AML. Повнокольорова версія цього зображення доступна в Інтернеті в розділі Трансплантація кісткового мозку.
Повнорозмірне зображення
a ) Виживання без лейкемії після SCT для дітей з первинною рефрактерною AML та дітей з рецидивом рефрактерної AML. ( b ) Загальна виживаність після SCT для дітей з первинною рефрактерною AML та дітей з рецидивуючими рефрактерними AML. Повнокольорова версія цього зображення доступна в Інтернеті в розділі Трансплантація кісткового мозку.
Повнорозмірне зображення
Кумулятивна частота рецидивів після SCT у дітей з рефрактерною ОМЛ за даними групи цитогенетичного ризику під час діагностики. Групи цитогенетичного ризику згідно з Swerdlow et al. 16 та Кройциг та ін. 6 Повнокольорова версія цього зображення доступна в Інтернеті в розділі Трансплантація кісткового мозку.
Повнорозмірне зображення
У таблиці 4 узагальнено проаналізовані прогностичні фактори ЛФС, частоту рецидивів та частоту рецидивів смертності у нашій групі. Регресійний аналіз показав, що трансплантація з відсотком бластів вище 30% при БМ передбачала значно вищий ризик рецидиву (60% проти 15%, Р = 0,004), тоді як прийом мієлоаблативного препарату та розвиток гострої РТПХ позитивно впливали на результат у нас групі пацієнтів (рис. 4а). Жодні інші характеристики, пов’язані з трансплантацією (донор, джерело стовбурових клітин, виснаження Т-клітин) не впливали на довгостроковий результат. Пацієнти віком 10 років демонстрували тенденцію до збільшення смертності від трансплантації (5% проти 29%, Р = 0,05).
Стіл в натуральну величину
a ) Виживання без лейкемії у дітей, які отримують мієлоаблативну стабілізацію (MAC) і у яких розвивається гостра РТПХ, порівняно з дітьми, у яких не розвивається гостра РТПХ та у яких знижена інтенсивність кондиціонування (RIC). b ) Виживання без лейкемії у дітей віком 10 років, які перенесли ІМТ із> 30% бластів у кістковому мозку порівняно з усіма іншими пацієнтами групи. Повнокольорова версія цього зображення доступна в Інтернеті в розділі Трансплантація кісткового мозку.
Повнорозмірне зображення
Поєднавши вищезазначені фактори ризику, нам вдалося виявити групу дітей з дуже високим ризиком рецидиву. Пацієнти у віці 10 років з> 30% бластів у SCT показали значно гірший результат, ніж у решти населення, що виявилося майже не виявленим (LFS 10% проти 53%, P = 0,037, рис.
обговорення
Хоча SCT часто використовується для лікування AML високого ризику, його роль у контексті хіміотерапевтичного захворювання все ще обговорюється. У цьому дослідженні вивчалася роль SCT у педіатричних пацієнтів з рефрактерною ОМЛ та прогностичні особливості щодо цього. Наша серія показує, що SCT можна лікувати у значної кількості дітей, яким трансплантували активне ПВК, з 5-річним ВЗПС у 43%. Зокрема, ми показали, що пацієнти молодшого віку з низьким навантаженням на хворобу на СКТ досягли значного показника LFS у 53%. Одне з основних обмежень нашого дослідження полягає в тому, що природа реєстру виключає оцінку того, скільки випадків рефрактерної ЛМВ було діагностовано протягом досліджуваного періоду у Сполученому Королівстві, опускаючи важливу інформацію про те, скільки пацієнтів вважали непридатними для проведення ІКТ або померли під час лікування. в очікуванні SCT (за нашими підрахунками, приблизно 120 пацієнтів з рефрактерною ОМЛ діагностовано у Сполученому Королівстві протягом досліджуваного періоду). Це, в свою чергу, призводить до значної тенденції відбору в нашій когорті пацієнтів.
Крім того, у 18 пацієнтів нашої групи діагностували рефрактерну хворобу на СКТ на основі морфологічної оцінки однієї лише БМ без молекулярного або цитогенетичного підтвердження. Хоча морфологічна оцінка включає певний ступінь суб'єктивності, у цьому дослідженні частота рецидивів серед пацієнтів, яким діагностовано рефрактерне лікування, засноване виключно на морфології, статистично не відрізнялася від частоти пацієнтів з молекулярним/цитогенетичним підтвердженням (частота рецидивів 53% проти 30 %). P = 0, 1, CI 0, 8 - 6, 5).
В межах обмежень ретроспективного дослідження реєстру, наші дані вказують на те, що значна частина дітей з активною рефрактерною ОМЛ піддається лікуванню ІКТ, особливо тих, хто має сприятливу цитогенетику, пацієнтів віком до 10 років і менше 30% бластів при БМ у дітей. SCT. Це дослідження також припускає, що в цьому контексті може бути корисним режим мієлоаблативного кондиціонування, а також стратегії поліпшення ГВЛ. Згідно з нашими даними, трансплантація, мабуть, не дає значних шансів вилікувати пацієнтів віком старше 10 років та бластів більше 30% при БМ. Отже, цю групу дітей слід ретельно оцінювати, виходячи з фази 1/нового лікування або досліджень паліативної допомоги відповідно до їх клінічного стану та схильності до сім'ї.