Резюме
Цей протокол описує новий метод доставки вірусу до мишачої простати. Використовуючи технологію CRISPR/Cas9, надмірну експресію генів або доставку рекомбінази Cre, методика дозволяє ортотопічну зміну експресії генів та впроваджує нову модель миші при раку передміхурової залози.
Анотація
Зі збільшенням рівня захворюваності на рак передміхурової залози вирішальне значення має виявлення нових драйверів або модуляторів пухлини. Генетично модифіковані моделі мишей (GEMM) для раку простати утруднені неоднорідністю пухлини та її складною динамікою мікроеволюції. Традиційні мишачі моделі раку передміхурової залози включають, серед іншого, зародкові лінії та умовні нокаути, трансгенну експресію онкогенів та моделі ксенотрансплантата. Генерування мутацій de novo у цих моделях є складним, трудомістким і дорогим. Більше того, більшість традиційних моделей націлені на більшу частину епітелію передміхурової залози, тоді як рак людини передміхурової залози, як відомо, розвивається як поодинока подія лише в невеликій частині клітин. Цінні моделі повинні імітувати не тільки ініціювання раку передміхурової залози, але й прогресування до запущеного захворювання.
Тут ми описуємо метод атаки деяких клітин епітелію передміхурової залози - клітин-перетворювачів вірусних частинок. Доставка вірусу, спрямованого на мишачу простату, дозволяє змінити експресію генів в епітелії простати. Кількість і тип вірусу цим визначатимуть кількість конкретних клітин для генетичних змін шляхом трансдукції деяких клітин для ініціювання раку та багатьох клітин для генної терапії. Завдяки ін’єкції на основі хірургічного втручання в передню, дистальну частку сечовивідних шляхів пухлина в цій моделі може розширюватися, не порушуючи сечовидільну функцію тварини. Крім того, орієнтуючись лише на підмножину клітин простатичного епітелію, методика дозволяє клональне розширення пухлини і, таким чином, імітує ініціацію пухлини людини, її прогресування, а також інвазію через базальну мембрану.
Ця нова техніка пропонує потужну модель раку простати з більшою фізіологічною значимістю. Страждання тварин обмежене, а оскільки додаткове розведення не потрібно, загальна кількість тварин зменшується. Одночасно був прискорений аналіз нових генів-кандидатів і шляхів, що в свою чергу є більш економічним.
Вступ
Виявлення та лікування раку передміхурової залози значно покращилися за останнє десятиліття. Проте рівень захворюваності на рак передміхурової залози зростає через тривалість життя. За оцінками, 1,1 мільйона нових випадків у всьому світі це одна з найпоширеніших причин смертності від раку у чоловіків 1. Рак передміхурової залози розвивається повільно, але коли рак прогресує до розвиненого метастатичного стану, прогноз поганий через обмежені можливості лікування. На сьогоднішній день лише декілька генів визначені загальними рушіями цього раку, і їх неоднорідність та мультифокальність перешкоджають виявленню біомаркерів та драйверів, що піддаються націленню 2, 3 .
Класичні методи генерації GEMM часто погіршуються через їх складність, витрати часу та витрат. Умовні моделі широко використовувались для вивчення генів-кандидатів на рак передміхурової залози, що призводить до ембріональної смертності при інактивації в статевій лінії 4. Більш поширені моделі включають специфічну Cre-рекомбіназу простати, керовану або модифікованим промотором Probasin 5, або PSA 6, інтегрованим в GEMM додатковим кросинговером. У цих моделях ген, що цікавить, буде націлений на більшість клітин епітелію простати, генеруючи гіперплазію у всьому органі, що може погіршити функцію сечовивідних шляхів 7 тварини .
Вірусна доставка білка Cre шляхом ін’єкції в передню частку мишачої простати може вирішити цю проблему, орієнтуючись лише на кілька клітин 8. Враховуючи, метод використовує широкий спектр можливих варіацій, лабораторних технічних вимог, знань та цілей. Серед інших продемонстровано успішні підходи використання аденовірусу до JunB та Pten 9 або Лентивіруса до Pten та Trp53 10. Додавання трансгенів, таких як люцифераза, вірусна конструкція або GEMM, також дозволить неінвазивний моніторинг прогресування захворювання за допомогою біолюмінесцентної візуалізації 11 .
Редагування геному на основі технології CRISPR/Cas9 відкриває нову і швидку можливість для вивчення раку завдяки швидкому породженню соматичних нокаутів 12. Вірусна доставка єдиних провідних РНК (sgRNA), спрямованих на передню частку мишачої простати, встановлює більш відповідну фізіологічну модель раку простати. Таким чином, клітини з необхідними мутаціями можуть утворювати клони, здатні до експансії та інвазії. Крім того, використання керівних РНК для різних генів-мішеней генерує клітинні клони із змінами в різних генах. Це дозволить неоднорідність пухлини та тиск природного відбору на прогресування раку, що може виявити важливість кожної зміни генів або епістатичних механізмів.
Тут ми представляємо метод доставки вірусних частинок до мишачої простати для зміни експресії генів. Через невеликий розріз живота оголюють передню частку передміхурової залози миші та вводять в частку вірусні частинки. Через п'ять днів після операції хірургічні затискачі можна зняти зі шкіри, а рак простати можна проаналізувати через 8 тижнів. Загалом, це швидка та ефективна процедура, яка має незначний вплив на мишу та дозволяє збільшити кількість пухлин без шкоди для миші.
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Протокол
Цей протокол стосується хірургічної процедури на лабораторних мишах. Усі експерименти на тваринах повинні переглядатися та затверджуватися Інституційним комітетом з догляду та використання тварин (IACUC) окремо. Оскільки підхід заснований на виживанні та одужанні тварин, забезпеченні адекватної анестезії, управління болем та асептичному хірургічному середовищі у будь-який час. Використовуйте грілку, щоб запобігти переохолодженню під час операції та до виходу з наркозу.
1. з міркувань
2. доставка вірусу до мишачої простати
3. після оперативних втручань
- Тримайте клітку з мишами, яким зробили операцію, на нагрівальній подушці протягом 1 години після процедури, щоб запобігти переохолодженню до повного їх відновлення. Якщо застосовується антидот, тварина повинна прокинутися через кілька хвилин після ін’єкції.
- Щодня слідкуйте за тваринами на предмет належного загоєння ран та показників болю. За необхідності призначте додаткові засоби для знеболення відповідно до інструкцій з догляду за тваринами в установах.
- Видаліть затискачі зі шкіри через 4-5 днів, як тільки рана буде закрита.
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Репрезентативні результати
Щоб оцінити розподіл вірусу в мишачій простаті, зразки аналізували через три місяці після операції. 12 мишей Rosa26-LSL-Cas9-EGFP експресують GFP в клітинах, які зазнали дії білка Cre, експресованого вірусом. Зразки простати досліджували за допомогою флуоресцентного мікроскопа для виявлення ділянок із сигналом GFP (рис. 2А). Сигнал GFP вказує на активність Cre в епітелії передміхурової залози, але не в тому випадку, якщо редагування генів викликано керівництвом CRISPR. Імуногістохімічні зрізи продемонстрували вогнищеві зони клітин з високою експресією pAKT (рисунок 2B), що вказує на втрату Pten 13. Імунофлуоресцентне Co фарбування pAKT та GFP виявило подвійні позитивні клітини (рис.2). Це підтверджує трансформацію клітин простати вірусом, асоційованим з Адено. Загалом, ці результати демонструють, що редагування гена CRISPR/Cas9 in vivo може бути здійснено в епітелії передміхурової залози за допомогою аденоасоційованого вірусу та миші Rosa26-LSL-Cas9-EGFP.
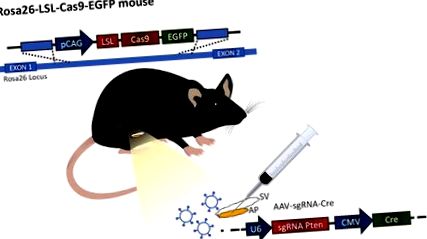
Рисунок 1: Ілюстрація процедури. Процедура проводиться на миші Rosa26-LSL-Cas9-EGFP, створеній Platt et al. 12 передня простата (АП) приєднується до насіннєвої бульбашки (СВ). Частинки вірусу експресують направляючу РНК і білок Cre вводять в передню передміхурову залозу, щоб змінити експресію гена. Клацніть тут, щоб переглянути збільшену версію цього малюнка.
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Обговорення
У цьому протоколі ми описуємо метод зміни експресії генів у передній частці мишачої простати шляхом ін’єкції вірусу, створюючи потужну нову модель миші для раку простати (Рисунок 2). Вперше про успішне введення аденовірусу розповіли Лео та інші в 2005 р. 8. Раніше ми показали, як аденовірус, що кодує білок Cre рекомбінази, може замінити трудомісткі схрещування алелю Cre для елімінації специфічних тканин 9 (Рисунок 2D). Оскільки вірус заражає близько 9 клітин, ця модель імітує сценарій клонального розширення людини 14, 15 і є оптимальною для досліджень раку (Рисунок 2B).
Відкриття технології CRISPR/Cas9 відкрило нові можливості для редагування гена в режимі реального часу. Тепер можна одночасно модифікувати кілька генів, забезпечуючи дуже цінну техніку для цього гетерогенного раку економічним та економічним способом. Дослідження на моделях на тваринах отримують вигоду від генерування генних змін не тільки в статевій лінії, але і в тканинах дорослих. Крім того, розвиток мишей, що експресують Cas9, дозволяє вірусну доставку Cre та sgRNA (рис. 1). Оскільки вказівки не впливають на геном без експресії Cas9, робота з цим вірусом не небезпечна.
Аденоасоційовані віруси індукують дуже низьку імунну відповідь, і хоча він присутній протягом року, вірус не інтегрується в геном хазяїна, що робить його кращим у дослідженнях нокауту in vivo 16. У цьому контексті слід зазначити, що різні серотипи можуть впливати на ефективність передачі сигналу в різних типах тканин. Тому дуже важливо досягти високої ефективності оптимізації тканини-мішені. З іншого боку, використання інтеграції геному Лентивірусу забезпечує тривалу експресію онкогену 10 .
Передміхурова залоза людини не розділена на окремі частки, і стверджується, що мишачі частки простати найкраще представляють простату людини. Незважаючи на те, що була запропонована бічна частка, не виявлено суттєвої різниці між різними частками щодо ініціювання пухлини 9, 17, 18, 19. Іншим важливим аспектом доставки вірусу є зараження інших клітин організму. Ми спостерігали клітини простати, які були трансдуковані. Ризик можна мінімізувати під час процедури ортотопічної доставки, минаючи кровоносні судини та запобігаючи витоку під час ін’єкції. Конструкція вірусу, включаючи специфічний для простати промотор, такий як пробасин пробазину та серотип, може ще більше збільшити специфічність клітин.
Потрібна передплата. Будь ласка, порекомендуйте JoVE своєму бібліотекареві.
Розкриття інформації
Авторам нічого розкривати.
Подяка
Лорд фінансувався грантом Датського онкологічного товариства (R146-A9394-16-S2). MFB та MKT фінансувалися AUFF NOVA (AUFF-E-2015-FLS-9-8). Лорд та МФБ фінансували Градська школа, Охорона здоров'я, США. E.F.W. підтримується стипендіями Міністерства економіки (SAF2015-70857, що співфінансуються ЄСФРР ЄС) та авансовим грантом ERC (741888 - CSI-Fun).
Ми хочемо подякувати Ліліані Фахардо Меллор (Гени, розвиток та хвороби; Національний центр дослідження раку) за критичне прочитання рукопису.
- Великобританія попереджає про можливий спалах вірусу блюту у великої рогатої худоби
- Виживе вірус у заморожених продуктах WebSalud
- У мене вірус папіломи людини, як це впливає на мого партнера
- TABATA 30 хв для схуднення - Доставка підходить
- ТАТІАНА ОРТЬЗ ГОЛУБАЄ СЕРЦЯ І РІВАЛИ НА ПОДІЙНИКІ І КОЛЬЦІ - ВІРУС БОКСУ
