Цей повний текст є відредагованою та переглянутою стенограмою конференції, даної в рамках IV конгресу Чилійської асоціації клінічного харчування, що відбувся в Сантьяго з 28 по 30 квітня 2005 р. Захід була організована Чилійською асоціацією клінічного харчування.
Президент Чилійської асоціації клінічного харчування: д-р Жульєта Классен.
Наукове видання: Дра Еліана Рейес.
Вступ
Критичні пацієнти охоплюють широкий спектр серйозних медичних та хірургічних патологій, лікування яких повинно здійснюватися у відділенні інтенсивної терапії. Харчова підтримка пацієнта в реанімації має наступні цілі, як тільки пацієнт досягне гемодинамічної стабільності:
- Запобігання неправильному харчуванню: Пацієнт буде перебувати на нульовому режимі принаймні від 5 до 10 днів (період, рекомендований чинними стандартами Американської асоціації ентерального та парентерального харчування для ініціювання підтримки), оскільки недоїдання пов’язане з більшою захворюваністю.
- Сприяти синтезу білка, щоб можна було відновлювати рани, м’язи та кишечник, а також виробляти білки, які беруть участь у захисті від інфекції.
Маючи на увазі ці цілі, слід пам’ятати кілька визначень:
- Гіперметаболізм - збільшення витрат енергії в стані спокою; є причиною втрати м’язів у важкохворих пацієнтів.
- Катаболізм Це втрата тканини з негативним балансом азоту внаслідок збільшення втрат азоту. Це відбувається із скелетних м’язів та забезпечує амінокислоти для глюконеогенезу та синтезу білків гострої фази.
- Анаболізм означає синтез тканини, і для цього необхідно досягти позитивного азотистого балансу.
Коли енергозабезпечення достатнє (1500 кал/добу), збільшення споживання азоту може покращити азотний баланс; Це відбувається лише тоді, коли споживання калорій є достатнім, навіть якщо споживання білка збільшено, як показало дослідження, опубліковане в 1981 році.
У критичного пацієнта відбуваються серйозні метаболічні зміни, які призводять до більшої захворюваності через стан гіпотрофії, який вони викликають. Відомо, що 1 г втрати азоту в сечі еквівалентно втраті 30 г сухої тканини; тобто пацієнт з 15 г азоту сечовини в сечі втрачає півкілограма худої маси. Було показано, що 0,64 г нежирної маси втрачається після операції на добу (Shizal H. Хірургія 1979; 85: 496-503).
Необхідно оцінити взаємозв'язок між ризиком та користю від встановлення дієтичної підтримки у критичного пацієнта. Ризик підвищується у нестабільних пацієнтів, оскільки об'ємне перевантаження, гіперглікемія, порушення електролітного та кислотно-основного стану або діарея можуть бути легко викликані.
Основи харчової підтримки
Харчова підтримка була б виправдана наступними елементами:
- Існує зв'язок між станом харчування та клінічною еволюцією, про що свідчать проспективні та ретроспективні дослідження ефективності харчової підтримки у цих пацієнтів.
- Поживна підтримка, іноді, також покращує маркери недоїдання.
- Слід пам’ятати, хоча це здається очевидним, що живі організми можуть загинути, якщо їх позбавляти поживних речовин протягом певного часу.
- Нарешті, іноді краще щось робити, ніж нічого не робити, оскільки можна досягти певної вигоди і, крім того, це зменшує почуття безпорадності перед пацієнтами (Koretz R. Am J Respir Crit Care Med дев'ятнадцять дев'яносто п'ять; 151: 570-3).
Однак ці основи містять кілька помилок:
- Не доведено, що ця асоціація є причиною; недоїдання може бути наслідком основного захворювання пацієнта.
- Поліпшення маркерів не означає або гарантує клінічне покращення.
- Смерть, спричинена виключно недоїданням, порівняно з основним захворюванням, настає, коли втрачається більше 40% ваги.
- Неконтрольовані дослідження не гарантують того, що відбувається, коли втручання не проводиться.
- Шкідливе для пацієнта втручання гірше, ніж нічого не робити.
При огляді поточної літератури з метою визначення того, чи впливає харчова підтримка на еволюцію критичних пацієнтів, з’являються невтішні дані для тих, хто використовує цей захід, оскільки деякі метааналізи показують, що при парентеральному харчуванні смертність зростає; крім того, немає дискусій про те, що кількість інфекцій зменшується при ентеральному харчуванні порівняно з парентеральним харчуванням. Що стосується ентерального харчування, шлункове харчування матиме більше ускладнень, ніж харчування тонкої кишки.
Оскільки одна з піктограм харчової підтримки, парентеральне харчування, пов’язана зі збільшенням смертності, різні аспекти цієї процедури почали переглядати. В першу чергу парентеральне харчування застосовується, коли спостерігається тимчасова або постійна втрата функції органу; У цьому сенсі це слід тлумачити так само, як використання діалізу (тобто, коли нирки недостатньо) або встановлення ШВЛ (коли у пацієнта спостерігається дихальна недостатність).
Проаналізувати результат парентерального харчування проти стандартної допомоги критичним пацієнтам було проведено метааналіз 26 досліджень, з яких лише 6 проведено у пацієнтів реанімації, і два з них стосувались ентерального харчування, тому залишилось 4 дослідження, деякі досить старі та з кількістю зменшення кількості хворих: Абель, 1976 р., 44 пацієнти з недоїданням, кардіохірургія; Sax, 1987, 54 пацієнти; Рейлі, 1990, 18 недоїдає, трансплантація печінки; Сандстрем, 1993, 300 хворих на хірургічну травму. У цьому мета-аналізі парентеральне харчування не впливало на смертність порівняно зі стандартним доглядом, а натомість було пов’язано з більшою частотою ускладнень та перебування в лікарні.
Цим пацієнтам важливо знати основне захворювання через метаболічні зміни, які воно може спричинити; проведене лікування, оскільки потреби в калоріях можуть відрізнятися; та харчовий статус, щоб він не заважав імунній системі, а пацієнт міг реагувати на адекватну реакцію на стрес.
Харчовий внесок у пацієнта, що переживає критичний стан, повинен бути ретельно оцінений, щоб не недоїдати пацієнта; останні можуть посилити втрату сухої маси, ускладнити виведення вентиляції, затримати загоєння, змінити захисні сили і, отже, збільшити кількість інфекцій. Навпаки, якщо пацієнт переплачує понад калорійні потреби, це також може спричинити такі ускладнення, як азотемія, стеатоз печінки, гіперкапнія, гіперглікемія, гіперліпідемія, перевантаження рідини та електролітні розлади.
Споживання калорій та глюкози
Коли вирішено розпочати дієтичну підтримку у цих пацієнтів, необхідно визначити, скільки калорій забезпечити. Оптимальним було б використання непрямої калориметрії, але це не проста техніка, оскільки вона вимагає навченого персоналу, займає час і обговорюється, чи слід проводити вимірювання безперервно протягом 24 годин, чи це еквівалентно виконувати в період 10 або 15 хвилин.
На практиці формули використовуються для оцінки потреб у калоріях; Загалом використовується формула Гарріса Бенедикта, яка дає величину витрат енергії в спокої (GER); Традиційно вважається, що на 50% слід забезпечувати витрати енергії в стані спокою, а 1,5 ГЕР еквівалентно приблизно 36 ккал/кілограм/добу.
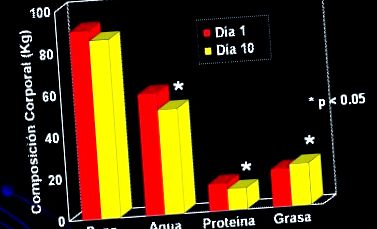
На малюнку 1 показано, що сталося зі складом тіла у невеликої групи пацієнтів, які отримували харчову підтримку за допомогою парентерального харчування протягом 10 днів, після чого відбулися значні зміни у складі тіла, головним чином за рахунок збільшення маси.
Щодо споживання глюкози, у дослідженні, проведеному на 62 пацієнтах із середнім віком 62 років, з аналогічним споживанням енергії, що перевищує 32 ккал/кілограм на добу, було виявлено, що відсоток пацієнтів з рівнем глюкози в крові перевищує 200 мг/дл значно збільшився, коли було забезпечено навантаження більше 5 мг/кіло/хв (Рисунок 2).
Фігура 1. Критичні пацієнти (n = 8), які отримували 10 днів PN, 34 ккал/день + 1,8 г/кг/день білка (Streat et al. J Травма 1987; 27: 262).
Малюнок 2. Оптимальне споживання глюкози при парентеральному харчуванні (Rosmarin et al. Nutr Clin Pract 1996; 11: 151).
Непрямою калориметрією вважається Золотий стандарт Для визначення потреби в енергії та в літературі застосовуються різні формули для оцінки цього значення, серед них - Харріса Бенедикта; аналіз Фіка, який використовує інші змінні, такі як серцевий викид та концентрація гемоглобіну; формула Іретона-Джонса, яка є спеціальною для пацієнтів, які перебувають на штучній вентиляції легенів, і включає інші змінні, такі як наявність сепсису тощо; та рівняння Франкенфілда та Фуско.
Кажуть, що всі ці формули мають дуже хорошу кореляцію з непрямою калориметрією; Однак у дослідженні, проведеному на великій групі критично хворих, у яких непряму калориметрію проводили усім, було виявлено, що ці формули значно занижують калорійність потреб пацієнтів і що їх коефіцієнти кореляції з калориметрією, такі як як видно з таблиці I, вони були досить низькими.
Таблиця I. Розрахунок енергетичної потреби у пацієнта, що перебуває у критичному стані.
В іншому дослідженні, проведеному за допомогою непрямої калориметрії, сформульованої для того, щоб відповісти, чи відповідає введене харчування вимогам до калорій, виміряним непрямою калориметрією, порівняно зі значенням, оціненим за рівнянням Гарріса Бенедикта, було виявлено, що 48% пацієнтів були гіперметаболіками (Малюнок 3). Однак захворювання спричинило зменшення потреби у 20% пацієнтів; 31% залишався нормально-метаболічним (McClave et al. JPEN 1998; 22: 375-81).
На малюнку 4, з вимірюванням витрат енергії на кілограм ваги, спостерігається, що 66% критичних пацієнтів реанімації потребують менше 25 калорій/кілограм на добу, а 33,3% з них мають потреби більше 25; Тому те, що використовується традиційним способом, тобто понад 35 калорій/кілограм/день, не відповідає вимогам.
Малюнок 3. Харчування критично важливих пацієнтів. Її вводять відповідно до калорій?
Малюнок 4. Харчування критично важливих пацієнтів. Витрати енергії на кілограм ваги.
У класичній роботі з доопераційного харчування пацієнти були розділені на дві групи: одна група отримувала 1280 калорій, а інша - майже 3000 калорій. Значне збільшення відсотка інфекційних та неінфекційних ускладнень (рис.5), особливо частоти рівня глюкози в крові понад 300 мг/дл, у групі, яка отримала найбільший внесок (Buzby et al. N Engl J Med 1991; 325: 525).
Малюнок 5. Ускладнення гіпокалорійного парентерального харчування проти звичайний.
Існує ще два дослідження у пацієнтів з важким хворим щодо частоти ускладнень низькокалорійного харчування порівняно зі звичайним харчуванням. В одному з них Чобан працював з 13 пацієнтами із ожирінням реанімації (1997), а в іншому МакКоуен робив те саме з 48 пацієнтами на ШВЛ (2000). Обидва спостерігали значну різницю в інфекціях між обома способами (29% проти 53% у другому згаданому дослідженні). На сьогоднішній день недостатньо даних про недоїдання, тому ці наближення не є дійсними для пацієнтів із хронічним недоїданням.
У дослідженні пацієнтів із ожирінням порівнювали парентеральне споживання їжі 22 ккал/кг/день проти 36 ккал/кг/день. Результати видно на малюнку 6; Зелені смуги показують залишки азоту, які відповідають кінцевій цілі і які були подібними в обох; при більш високому споживанні калорій суттєво зростала потреба в інсуліні (Choban et al. Am J Clin Nutr 1997; 66: 546).
Малюнок 6. Гіпокалуричне парентеральне харчування проти звичайний. Різниця в потребі в інсуліні.
Можна стверджувати, що більший запас глюкози призведе до збільшення виробництва СО2. У дослідженні, опублікованому в 1992 р., Пацієнти були розділені на дві групи: одна з вищим споживанням глюкози, а друга - з більшим споживанням калорій (рис. 7). Зі збільшенням споживання глюкози виробництво СО2 не збільшувалось, але коли було забезпечено на 50% більше, ніж оцінював Харріс Бенедикт, ця змінна значно зросла (Talpers et al. Грудна клітка 1992; 102: 551).
Малюнок 7. Гіпокалуричне парентеральне харчування проти звичайний. Виробництво CO2, спричинене харчуванням.
Щодо внесків та парентерального харчування у критичних пацієнтів, варто нагадати класичне дослідження щодо використання інсуліну у хірургічних хворих на реанімацію. Відомо, що у 75% пацієнтів реанімації рівень глюкози в крові натще перевищує 120 мг/дл; У цьому дослідженні групу пацієнтів (n = 783) випадковим чином розподіляли на звичайне лікування з додаванням інсуліну лише в тому випадку, якщо глікемія перевищувала 215 мг/дл і з цільовою глікемією від 180 до 200 мг/дл; інша група (n = 765) отримувала інтенсивне лікування інфузією інсуліну, якщо глікемія перевищувала рівень 110 мг/дл, при цільовій глікемії від 80 до 110 мг/дл. Смертність була значно нижчою як у всіх пацієнтів, так і в групі, яка отримувала парентеральне харчування або змішану підтримку (рис. 8).
За цими результатами можна констатувати, що при рівні глюкози в крові знижується смертність від 80 до 110 мг/дл; Крім того, це дослідження зменшило сепсис, гостру ниркову недостатність, полінейропатію та переливання крові; і важливим фактом є те, що переваги інтенсивної інсулінотерапії не залежали від способу харчування. Слід зазначити, що у великому відсотку пацієнти перенесли серцеву операцію; Така сувора мета може бути не рівнозначною для інших груп пацієнтів (Ван ден Берге. N Engl J Med 2001; 345: 1359).
Малюнок 8. Смертність за даними управління глікемією в хірургічній реанімації.
Інші доречні спостереження полягають у тому, що у цих пацієнтів оцінка APACHE була не такою високою, і, отже, їх стан був не дуже серйозним. Крім того, вони отримували високі споживання глюкози і в більшості випадків (60%) отримували загальне парентеральне харчування. На завершення цього дослідження у хірургічних хворих, особливо серцевих, слід проводити суворий глікемічний контроль з метою від 80 до 110 мг/дл.
В іншому дослідженні було показано, що еволюція групи важкохворих пацієнтів на ШВЛ була кращою при споживанні енергії 18 ккал/кг/день, ніж при менше 10 або більше 25 ккал/кг/день. У цих двох останніх випадках еволюція була гіршою, і було важче відучити пацієнтів (Грудна клітка 2003,124: 297-305).
Висновки
- В даний час можна стверджувати, що у добре харчується критичного пацієнта його потреба в калоріях становить від 22 до 25 ккал/кг, а у пацієнтів з недостатнім харчуванням - 30 ккал/кг/день.
- Незважаючи на обмежену кількість доступної літератури, не існує хвороби, яка значно покращується при тривалому голодуванні (і лише 15% медичних рішень базуються на суворих доказах).
- Харчову підтримку у важкохворих пацієнтів слід розпочати, якщо пацієнт не збирається приймати їжу протягом 5-10 днів.
- Ентеральне харчування пов'язане з меншою кількістю інфекційних ускладнень, і оптимальний прийом передбачає 25 ккал/кг та 1,5-2 г білка/кг.
Керівні принципи ASPEN (Американське товариство парентерального та ентерального харчування), в якому 200 спеціалістів працювали понад три роки, містять 322 рекомендації. Лише 62 з них засновані на перспективних рандомізованих та контрольованих дослідженнях (докази типу А); 199 походять з менш суворих даних, таких як ретроспективні дослідження; і 68 відповідають думці експертів.
Таким чином, парентеральне харчування найкраще працює тоді, коли воно проводиться у формі дозвільного недоїдання, яке має такі характеристики:
- він гіпокалуричний (більше 15 і менше 30 ккал/кг/добу);
- внесок азоту високий (1,5-2 г/кг білків);
- проводиться суворий контроль глікемії;
- в деяких підгрупах імуноживлення вважається корисним.
- ВІДПОВІДІ ТА СИНТЕЗ ПІДТРИМКИ ХРАНЕННЯ ДОРОСЛОГО ХВОРОГО
- Мотиваційна техніка інтерв'ю для розмови зі своїм пацієнтом із зайвою вагою та ожирінням в
- Свідчення пацієнта з надмірною вагою та стійкістю до інсуліну
- Харчова терапія у пацієнтів із ожирінням з резистентністю до інсуліну та серцево-судинним ризиком
- Туберкульоз гортані без ураження легенів у некомпетентного молодого пацієнта Insight Medical