Предмети
Резюме
Вступ
Ожиріння є глобальною проблемою охорони здоров’я як у розвинутих, так і в країнах, що розвиваються, що не є ефективною стратегією заборони його поширеності. За даними Всесвітньої організації охорони здоров’я (ВООЗ), якщо індекс маси тіла (ІМТ) дорівнює або перевищує 25 кг/м 2, він вважається надмірною вагою, тоді як якщо він дорівнює або перевищує 30 кг/м 2, вважається ожирінням 1. За останнє десятиліття популяційні тенденції свідчать про збільшення на 40% надмірної ваги або ожиріння до вагітності та вдвічі більше захворюваності на ожиріння до вагітності у жінок 2. Для репродуктивної системи людини високий ІМТ негативно впливає на фертильність ендокринних порушень 3, ановуляцію 4 та зниження якості ооцитів 5, до сприйнятливості ендометрія, що може спричинити швидкість спонтанного аборту 6. Тому все більше і більше жінок з високим ІМТ доводиться звертатися до допоміжних репродуктивних технологій (АРТ), щоб вирішити своє безпліддя.
Жінки з високим ІМТ мають подібні характеристики до жінок із СПКЯ, такі як нижчий рівень прогестерону. Якщо протокол PPOS у поєднанні з FET може стати адаптивною терапією для жінок з високим ІМТ, це здається дуже надійним та значущим. Зокрема, розглянемо сучасні методи лікування жінок з високим ІМТ, більшість із них - це стандартний довгий протокол агоністів GnRH, протокол спалаху мікродози GnRH, протокол антагоністів GnRH, протокол конвертів. - довжина або вдосконалений протокол надмірної довжини 26, 27, 28, 29 у поєднанні з ЕТ, які завжди демонструють зменшення вагітності та результатів живонародження. Тому ми провели цей ретроспективний аналіз для дослідження результатів ооцитів та вагітності PPOS у поєднанні зі стратегією лікування FET у жінок з високим ІМТ.
Результати
Клінічні характеристики та результати ЕКО у двох групах ІМТ за технологією FET.
У таблиці 1 наведено базові характеристики та результати ЕКО за допомогою технології FET у пацієнтів двох груп ІМТ. Було 2212 жінок з нормальним ІМТ та 320 жінок з високим ІМТ (21,28 проти 27,13; с 26, 27, 28, 29, базовий рівень ФСГ (5,00 проти 5,66, с 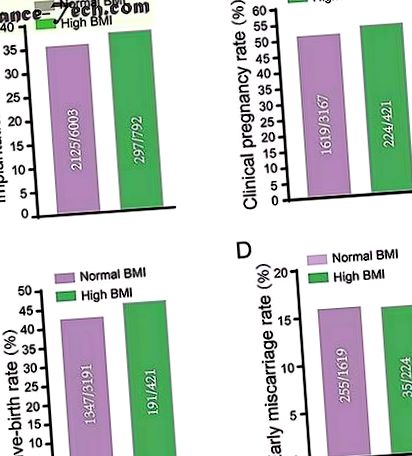
Нормальний ІМТ та групи з високим ІМТ не мали різниці у швидкості імплантації ( ДО ), клінічний рівень вагітності ( B ), рівень народжуваності ( C. ) і частота викиднів на ранніх термінах ( D ) після FET. Неопрацьовані дані були показані на малюнках та проаналізовані за допомогою критерію хі-квадрат. Різниці вважали статистично значущими, коли значення р було менше 0,05.
Повнорозмірне зображення
Характеристика циклів ооцитів та результати в трьох групах стимуляції яєчників відповідно до ІМТ жінки.
У поєднанні з технологією FET ми проаналізували результати ЕКО наших трьох різних груп стимуляції яєчників: звичайних коротких, hMG + MPA (4 мг/добу) та hMG + MPA (10 mg/d) окремо при нормальному ІМТ. 24,9 кг/м 2) та високим індексом маси тіла (≥25 кг/м 2) групи жінок. Базові характеристики, гормональні профілі та характеристики циклу пацієнтів були представлені в таблиці 2. Спочатку ми проаналізували результати ЕКО тих самих жінок з ІМТ за допомогою трьох різних груп стимуляції яєчників у таблиці 2. Для У групі жінок з нормальний ІМТ, тривалість hMG була значно більшою у групі hMG + MPA (10 мг/добу), ніж у короткій звичайній групі та hMG + MPA (4 mg/d) (8,94 проти 8,14 проти 6,87, p
Існують також обмеження нашого дослідження. По-перше, це дизайн ретроспективного дослідження, який у майбутньому повинен бути підтверджений рандомізованим контрольованим випробуванням. По-друге, у групі з високим ІМТ у нашому дослідженні була лише одна група (ІМТ ≥ 25), що краще, якщо розділити їх точніше, якщо вона має достатню кількість циклів, таких як надмірна вага (ІМТ 25,0-29,0), ожиріння (ІМТ 30,0) - 49,9) та надмірна вага (ІМТ> 50). Хоча дві групи hMG + MPA покращили клінічні результати вагітних у цій групі з високим ІМТ та збільшенням використання MPA, найкращі результати ЕКО. Ці дві групи hMG + MPA (4 або 10 мг/добу) мають послідовний та дозозалежний терапевтичний ефект у групі з високим ІМТ, допомагаючи підтвердити ефект AMP у жінок з високим ІМТ. По-третє, у нас не було контролю ЕТ у групі з високим ІМТ, що могло б допомогти нам зрозуміти поліпшення результатів вагітності у жінок з високим ІМТ, які спочатку мали менший вихід ооцитів, ніж у жінок з нормальним ІМТ. . Однак багато попередніх досліджень показують, що при застосуванні ЕТ жінки з високим ІМТ досягали б таких несприятливих показників під час вагітності, як і в ооцитах.
На закінчення можна припустити, що протокол стимуляції яєчників hMG + MPA (4 або 10 мг/добу) у поєднанні з технологією FET може бути ефективним та прийнятним лікуванням для жінок з високим ІМТ (≥25) порівняно із звичайним короткочасним протоколом, а для жінок з високим ІМТ hMG + MPA (10 мг/добу) є найбільш ефективною стратегією лікування у трьох з них. Результати дозволяють припустити, що протокол hMG + MPA (4 або 10 мг/добу) може мати кращу ефективність із багатьма теоретичними перевагами, наприклад, FET може дозволити яєчнику та оголеному ендометрію краще відновлюватися від стимуляції яєчників, уникаючи несприятливого ефекту високого рівня естрадіолу при імплантації, а МФК може частково покращити компетентність розвитку ооцитів, крім того, МРА (10 мг) значно доповнює дефіцит прогестерону у жінок з високим ІМТ і має більш високі шанси на успішне ЕКО.
Методи
Оцінка індексу маси тіла
Вага та зріст використовувались для обчислення ІМТ за стандартною формулою: ІМТ = вага/зріст 2 (кг/м 2). Відповідні суб'єкти дослідження були розділені на дві групи на основі ІМТ пацієнтів та відповідно до стандартів Всесвітньої організації охорони здоров'я: нормальна ІМТ (18,5 кг/м 2 ≤ ІМТ 2) та висока ІМТ (ІМТ ≥ 25 кг/м 2) 1 . А дані ІМТ базувалися на інформації про зріст і вагу, виміряну в медичній картці кожного пацієнта.
Протоколи стимуляції яєчників
Звичайний короткий протокол стимуляції яєчників.
В якості контрольної групи використовували короткостроковий стандартний протокол. Пацієнтам вводили 0,1 мг триптореліну щодня з менструального циклу на 2-й день (MC2) до часу введення хоріонічного гонадотропіну (HCG) людини, а екзогенний hMG (150–225 МО) вводили щодня з MC3. Через 4–5 днів введення hMG було проведено трансвагінальне ультразвукове дослідження та дослідження рівня гормонів у сироватці крові, а доза hMG була оптимально відрегульована залежно від кількості та розміру фолікулів, що розвиваються. Кінцева стадія дозрівання ооцитів була індукована внутрішньом’язовою ін’єкцією hCG (Lizhu Pharmaceutical Trading Co., Чжухай, Китай) після того, як домінантні фолікули досягли діаметру 18 мм. Якщо у пацієнта було більше трьох домінантних фолікулів, вводили 2000 МО ХГЧ, тоді як для пацієнтів з не більше трьох домінантних фолікулів для активації використовували 5000 МО ХГЧ. Через 34-36 год пізніше проводили трансвагінальне ультразвукове дослідження ооцитів.
Протокол PPOS
Оцінка результатів ЕКО
Пацієнти проходили лікування ЕКО, яке проводили згідно з рутинними лабораторними процедурами в день вилучення ооцитів, як описано раніше 55, 56. Коротко, для вилучення ооцитів використовували середовище для промивання (Origio Medical Company, Данія), а в якості - людську трубну рідину (HTF; Irvine Scientific, CA, USA) з 10% сироватковою добавкою (SSS; Irvine Scientific, CA, USA). збір ооцитів та середовище осіменіння. Ембріони вирощували в безперервному одноразовому культуральному середовищі, доповненому 10% SSS (CSC; Irvine Scientific, CA, USA).
Ембріони з 3-го дня кожного циклу лікування ЕКО досліджували на кількість та регулярність бластомерів та ступінь фрагментації ембріона згідно з критеріями Каммінса 57. Ембріони I і II ступеня, які вважалися високоякісними, були кріоконсервовані; Ембріони III та IV ступенів поміщали в розширену культуру до досягнення стадії бластоцисти, і лише морфологічно добрі бластоцисти заморожували на 5-й день або 6-й день. Процедуру витрифікації для заморожування ембріонів та бластоцист стадії висічення проводили за допомогою системи Cryotopcarrier Co.), як повідомлялося раніше 58. Для склування використовували кріотопсистему із сумішшю 15% (об./Об.) Етиленгліколю (ЕГ), 15% (об./Об.) Диметилсульфоксиду (ДМСО) та 0,5 М сахарози у вигляді кріозахисного розчину. Для розморожування використовували розчини сахарози 1, 0, 5 та 0 М для поетапного розведення кріопротекторів.
Підготовка ендометрію та перенесення заморожених ембріонів
Підготовка ендометрію до кожного циклу переносу проводилась у природний цикл, цикл м’якої стимуляції або замісна гормональна терапія, як описано в нашій попередній статті 19, 21. Наш метод синхронізації ембріонів та ендометрію в ТЕФ був наступним: для природних циклів ТЕФ ріст фолікулів контролювали за допомогою сироваткових гормонів та ультразвуку з 10-го дня циклу. Коли товщина ендометрію була> 8 мм, а діаметр домінантного фолікула> 16 мм. з Е2> 150 пг/мл та Р 8 мм, Femoston (Solvay Pharmaceuticals BV) розпочато 8 мг/добу. Перенесення ембріонів визначали на третій день після введення Фемостону.
У всіх циклах FET один або два розморожені ембріони передавались відповідно до наміру пацієнта. Як тільки вагітність була досягнута, екзогенні добавки естрогену та прогестерону продовжувались до 8-10 тижнів вагітності.
Статистичний аналіз
Висловлення подяки
Автори дякують безплідним жінкам-учасницям, а також усім лікарям, медсестрам та лабораторному персоналу, зайнятим у відділі допоміжної репродукції Дев'ятої народної лікарні Шанхайської школи університету Цзяотун. Дякуємо, що РГ допомагає переглянути англійські орфографічні та граматичні помилки в рукописі. Цю роботу підтримали гранти Фонду природничих наук Китаю (номер гранту: 31400970 LW, 15411953000, 81571397до YK) та Фонду природничих наук Шанхаю (номер гранту: 15ZR1424900 QL).
Коментарі
Надсилаючи коментар, ви погоджуєтесь дотримуватись наших Умов та правил спільноти. Якщо ви виявите щось образливе або не відповідає нашим умовам чи інструкціям, позначте це як неприйнятне.
- Як розморожувати їжу - чи закінчується термін дії заморожених продуктів?
- Як правильно розморозити їжу - Заморожений Микола
- Як довго зберігається заморожена їжа - Ecoviand de Brugarolas
- Як уникнути відновного ефекту дієт; Я більше не жируватиму
- Як уникнути ефекту відскоку за допомогою Herbalife - рослинні продукти
