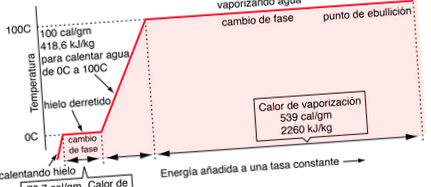
Переходи між твердою, рідкою та газоподібною фазами зазвичай включають велику кількість енергії порівняно з питомою тепловою енергією. Якщо до маси льоду, ми додаємо тепло з постійною швидкістю, щоб проводити його через фазові зміни, спочатку до рідини, а потім до пари, енергії, необхідні для здійснення фазових змін (так звана прихована теплота плавлення і прихована теплота випаровування), призведе до плато, які ми спостерігаємо на графіку температури проти часу нижче. Тиск на графіку приймається рівним 1 стандартній атмосфері.
| Температурні шкали | Зміни фази води | Точка кипіння |
| Вода |
Дані зміни фази випаровування беруться під тиском 1 стандартна атмосфера.
Вивчаючи енергію фазових змін у воді, ми виявляємо, що потенційна енергія розглядається як від’ємна величина. Аналогія з механічною системою, яка має гравітаційну потенційну енергію та кінетичну енергію, може допомогти нам зрозуміти логіку такої кількості негативної енергії. Ми завжди вільні у виборі нуля потенційної енергії, і представляється логічним вибрати цей нуль потенційної енергії, щоб вільна молекула в спокої мала нульову енергію. Зв’язана частинка в стані спокою має негативну потенційну енергію.
| Зміни фази води |
Відомо, що ми повинні додати 100 калорій енергії, щоб підвищити температуру 1 грама води з 0 ° до 100 ° C. Частина цієї енергії збільшує кінетичну енергію молекул, а інша частина додається до потенційної енергії.
Розміри блоків, що представляють кінетичну енергію молекул при 0 ° C і при 100 ° C, дають нам наочну ілюстрацію значення температури та природи абсолютної шкали або шкали температури Кельвіна. З визначення кінетичної температури видно, що розмір блоку пропорційний температурі, а відношення висот блоків ЕС (кінетичної енергії) є відношенням температур. Але кінетична температура за своєю суттю є абсолютною температурою, тому відношення висот блоків становить 373 К/273 К. Тому абсолютна температура насправді пропорційна кінетичній енергії перекладу молекул, тоді як температури Цельсія вибираються для зручності.
У процесі нагрівання води від 0є до 100є С. додавали 100 калорій енергії. Частина цієї енергії збільшувала кінетичну енергію молекул, а частина додавала до потенційної енергії. Для оцінки кількості, доданої до кінетичної енергії, молекулярні швидкості при двох температурах слід оцінювати за допомогою розподілу швидкостей Больцмана.
Чистий приріст кінетичної енергії при нагріванні води від 0 ° до 100 ° С становить 16,7 калорій/грам. Решта енергії послабить силу притягання між молекулами води. Це ослаблення міжмолекулярних сил проявляється у зменшенні поверхневого натягу гарячої води.
У процесі випаровування води потрібно додати велику кількість енергії, щоб подолати залишкові сили зв’язку між молекулами. Додаткова частина цієї енергії перетворюється на роботу PdV для розширення газу з дуже малого обсягу рідини до об'єму утворюється пари.
Якщо теплота випаровування води при 100 ° С становить 539 калорій, то, віднімаючи робочу складову 41 калорію, можна припустити, що фактичне споживання енергії зв'язку молекул води при 100 ° С становить 539-41 = 498 калорій.
Чому, теплота випаровування вища в організмі людини?
Цікавою особливістю процесу охолодження людського тіла шляхом випаровування є те, що тепло, що виділяється випаровуванням одного грама поту з шкіри людини при температурі тіла (37 ° С), в книгах з фізіології вказано як 580 калорій/г., замість номінальних 540 калорій/г. при нормальній температурі кипіння. Питання в тому, чому вона вище температури тіла.
Основна частина відповіді полягає в тому, що енергія зв’язку молекул води вища при цій нижчій температурі, а отже, їй потрібно більше енергії, щоб розділити їх і привести в газоподібний стан. Зміна теплоти випаровування може бути розрахована більш-менш, використовуючи те, що ми знаємо про воду (питома теплота води, 1 калорія/гм ° С). Щоб нагріти грам води від 0 ° C до 37 ° C, потрібно 37 калорій, але зміна кінетичної енергії набагато менше, ніж:
Раніше було показано, що при нагріванні води від нуля до 100 ° С кінетична енергія молекул води збільшується лише на 61,7 - 45 = 16,7 калорій/р. Але ми знаємо, що для прогрівання потрібно 100 калорій. Отже, внесок у послаблення водних зв'язків становить 83,3 кал/г. Використовуючи результат води при температурі 37 ° С, очевидно, що для випаровування води при температурі 37 ° С потрібно подати 52,4 калорії додаткової енергії.
У моделюванні тепла випаровування при температурі тіла є додатковий елемент - робота PdV, необхідна для доведення води до газоподібного стану, становить трохи менше 37 ° C. За аналогією з розрахунком роботи вище, ця робота виявилася 34,2 калорій/г, на 6,8 калорій/г менше, ніж при 100 ° C.
Отже, ця модель передбачає теплоту випаровування при 37 ° C.:
Теплота випаровування при температурі тіла = 539 кал/г + 52,4 кал/г - 6,8 кал/г = 585 кал/г.
Отже, ця проста модель досить гарна згідно з цитованими 580 кал.
- Natrol, Carb Intercept with Phase 2 Carb Controller, 1000 mg, 60 Veggie Caps - iHerb
- Класичне очищення обличчя - Центр краси Ніни Мерлі
- Персональний тренер для схуднення в Доностях Сан Себастібн
- Madero виходить із заходу PAN зі стриптизерками
- Персональне тренування з фітнес-та спортивним харчуванням - Orthos
- 6 прийомів, щоб запобігти псуванню фруктів та овочів
- Канело, Ковальов. Після перемоги Джейкобса ми вирішили піти на нього
- Дослідження в Нідерландах із застосуванням віагри припинено після смерті одинадцяти немовлят "Правда"
- Спеції, такі як куркума або кориця, можуть протидіяти дії жирів - Journal of
- На Хелловін у нас буде блакитний місяць, 2020 рік - це рік