реферат
Передумови/Цілі:
Скелетні м’язи відіграють важливу роль у регулюванні метаболізму всього організму. У скелетних м'язах збільшенню рівня циркулюючої глюкози та жирних кислот сприяють трансмембранні транспортери субстрату GLUT4 та FAT/CD36. Метою цього дослідження було визначити вплив харчового глікемічного індексу (ГІ) на експресію генів GLUT4 та FAT/CD36 у скелетних м'язах людини після одноразової атаки фізичних вправ.
Предмети/методи:
Вісім суб'єктів чоловічої статі проходили 60-хвилинну циклічну вправу при 75% максимального споживання кисню (VO2 max) і негайно годували ізоклоричною їжею, що містить або дієту з високим GI (HGI), або з низьким GI (LGI), з подібним співвідношенням вуглеводів, жири та білки у перехресному дизайні. Зразки м’язів з глибокого простору просторового простору відбирали за допомогою голкової біопсії відразу після тренування та через 3 години після фізичного навантаження.
результати:
Після фізичних вправ дієта HGI давала значно більші реакції на глюкозу та інсулін у порівнянні з дієтою LGI, як показано на більшій площі під кривими. Обидві дієти призвели до швидкого зниження вмісту жирних кислот у плазмі та гліцерину нижче рівня голодування. GLUT4 MRNA була знижена регуляцією як дієтами HGI, так і LGI у порівнянній мірі, тоді як рівень білка GLUT4 протягом цього короткого періоду не змінювався. Рівень мРНК FAT/CD36 і білка значно знизився при дієті HGI нижче базового рівня, але не при дієті LGI.
висновок:
У цьому дослідженні було виявлено значний дієтичний вплив на ШКТ на експресію гена FAT/CD36 після фізичних вправ у скелетних м’язах людини. Цей результат свідчить про те, що відмінності в дієтичному ГІ є достатніми для зміни обміну жирів.
Скелетні м’язи є основним місцем використання жиру та вуглеводів у всьому тілі (Zurlo et al., 1990) і виявляє надзвичайну пластичність у відповідь на зміни в метаболічному попиті та доступності субстрату. Метаболічні зміни в цій тканині можуть вплинути на обмін речовин у всьому організмі. GLUT4 та FAT/CD36 - два білки, відповідальні за транспорт циркулюючої глюкози та жирних кислот через плазматичну мембрану скелетних м’язів. У людини рівень мРНК GLUT4 може швидко зростати після одноразової атаки тривалих фізичних навантажень (Kraniou et al., 2006) і регулюється високовуглеводною дієтою (Cheng et al., 2005). У щурів скелетних м’язів добавки вуглеводів після тренування можуть індукувати тривалий білок GLUT4 протягом декількох годин, тоді як мРНК GLUT4 тимчасово падає нижче вихідного рівня протягом 90 хвилин (Kuo et al., 1999a).
Наявність внутрішньом’язової передачі сигналів глюкози та інсуліну регулює метаболізм жирних кислот шляхом регулювання експресії гена-транспортера жирних кислот FAT/CD36 (Civitarese et al., 2005). Рівні білка та мРНК для FAT/CD36 можуть бути збільшені в скелетних м'язах за допомогою ін'єкції стрептозотоцину (Luiken et al., 2002), лікування, яке погіршує вироблення інсуліну підшлункової залози і таким чином усуває засвоєння глюкози скелетними м'язами. Подібним чином інсулінорезистентність також збільшує експресію гена FAT/CD36 (Smith et al., 2007).
Як і білок GLUT4, було показано, що тренування підвищує рівень білка FAT/CD36 (Tunstall et al., 2002). У порівнянні з дієтою з високим вмістом жиру/низьким вмістом вуглеводів, встановлено, що дієта з високим вмістом вуглеводів та знежирених речовин знижує активність білка FAT/CD36 після фізичних вправ (Arkinstall et al., 2004). Однак дієта з високим вмістом жиру може також впливати на експресію гена FAT/CD36 у скелетних м'язах людини (Duplus et al., 2000; Cameron-Smith et al., 2003). На сьогоднішній день мало відомо, чи можуть різні значення глікемічного індексу (ГІ) із однаковими рівнями вуглеводів, жирів та білків спричиняти різницю в експресії генів білка FAT/CD36 та GLUT4. У цьому дослідженні були досліджені дві дієти з високим вмістом вуглеводів із ізоцилором із однаковим вмістом вуглеводів, жиру та білка, але різними значеннями ШКТ, щоб визначити експресію гена GLUT4 та FAT/CD36 у скелетних м’язах людини. Раніше ми виявили, що зміна рівня мРНК GLUT4 за допомогою вуглеводної дієти відбувається протягом 3 годин (Cheng et al., 2005). Таким чином, зразок м’яза людини брали на початку лікування (натщесерце) та через 3 години після дієтичного вживання після фізичних вправ після вищезазначених вимірювань.
Матеріали і методи
предметів
Зразки біопсії м'язів Vastus lateralis отримані у восьми здорових добровольців (вік 22,5 ± 0,3 року, зріст 174,2 ± 1,3 см, вага 69,1 ± 1,9 кг, індекс маси тіла (ІМТ) 22, 7 ± 0,5 кг/м2, максимальне споживання кисню (VO) ) 2) макс. 49,7 ± 0,9 мл/хв/кг). Цей протокол був схвалений Комітетом з етики християнської лікарні Чанхуа. Характер, мету та можливі ризики пояснювали кожному суб’єкту господарювання до отримання письмової згоди. Ця робота проводилась відповідно до керівних принципів Гельсінкської декларації.
вправа
За 2 дні до фізичних вправ вимірюється VO2 max усіх суб’єктів. У день експерименту випробувані звітувались у лабораторію о 08:00. Після нагрівання протягом 5 хвилин пацієнти виконували 60-хвилинну циклічну вправу при 75% VO 2max. Питна вода подавалася за бажанням під час та після тренування. Біопсію м’язів проводили на голодний шлунок (базовий рівень) і годували після фізичних вправ. В умовах голодування протягом 3 годин після фізичних вправ їжа не забезпечувалася. У стані годування випробовувані отримували дієти, що містять 70% вуглеводів з двома різними ГІ після фізичних навантажень. Кросовер відокремлювали протягом 1 тижня. Зразки біопсії м'язів отримували відразу після фізичного навантаження та через 3 години після прийому для проведення ПЗР із зворотною транскрипцією (RT-PCR) та Вестерн-блот-аналізу.
дитина
Відразу після фізичних вправ випробовувані отримували дієти з високим GI (HGI, = 76, 6) або низьким GI (LGI = 36, 1) та споживали протягом 10 хвилин вправи. Споживання енергії після фізичного навантаження в умовах HGI та LGI становило 678, 2 ± 18, 7 ккал (вуглеводи 138, 03 ± 0,8 г; білки 19, 4 ± 0,5 г та жири 5, 4 ± 0,1 г) та 682, 2 ± 18, 8 ккал (сахарид 137, 7 ± 3, 8 г; білок 18, 5 ± 0, 5 г і жир 6, 4 ± 0, 2 г). Дієта HGI включала кукурудзяні пластівці (60,2 г), знежирене молоко (245 мл), білий хліб (80,5 г), варення (20,3 г), воду з глюкозою (126 мл) і воду (560 мл).) Вміст LGI у раціоні включав усі висівки (61,6 г), знежирене молоко (329 мл), персики (280 г), яблука (210 г) та яблучний сік (164,5 мл).
Збір м’язової тканини
Біопсію м’язів проводили під місцевою анестезією (2% лідокаїну без адреналіну). Розріз довжиною 10 мм і глибиною вище коліна приблизно 20 см виконували на шкірі та м’язовій фасції за допомогою асептичної техніки. Біопсії Vastus lateralis (близько 50 мг) проводили з використанням методики черезшкірної біопсії Бергстрома (1962). Зразки витирали сухими і грубо нарізали без жиру та сполучної тканини, заморожували у рідкому азоті та зберігали при -80 ° C перед RT-PCR та Вестерн-блот-аналізом.
Забір крові та аналіз
Зворотна транскрипція-ПЛР
Вестерн-блот
М’язи гомогенізували в 20 мл крижаної 4- (2-гідроксиетил) -1-піперазинетансульфонової кислоти, 1 мМ етилендіамінтетраоцтової кислоти та 250 мМ сахарозного буфера (рН 7,4) з політроном (Brinkmann Instruments, Westbury, NY, USA) . ). Вміст білка в кожній пробі визначали кількісно за допомогою тесту Лоурі. Рівні кількості білків денатурували та розділяли на 7,5% гелі для електрофорезу в поліакриламідному гелі з додецилсульфатом натрію, а потім переносили на полі (вінілідендіфторид) мембрани (New Life Science Product, Inc., Бостон, Массачусетс, США). Неспецифічні місця зв'язування на мембранах блокували 5% сухого знежиреного молока в буфері, що містить 10 мМ Tris-HCl і 100 мМ NaCl, рН 7,5 і підтримували при 4 ° С протягом ночі. Потім ляпки інкубували послідовно з GLUT4 (1: 250, Chemicon, Billerica, CA, USA) або первинними антитілами FAT/CD3 (1: 5000, Santa Cruz, Santa Cruz, CA, USA) та антитілами, кон'югованими з пероксидазою хрону (1 ).: 5000, Перкін-Елмер, Бостон, Массачусетс, США). Комплекси антиген-антитіло візуалізували, виявляли та кількісно визначали за допомогою набору ECL для виявлення вестерн-блот (Amersham Pharmacia Biotech, Piscataway, Нью-Джерсі, США), аналізатора люмінесцентного зображення (Fujifilm, Японія) та нульової денситометричної Dscan (Scanalytics, Inc., FairFax, VA)., США).
Статистичний аналіз
Середню різницю всіх вимірювань порівнювали за допомогою двостороннього дисперсійного аналізу з повторними вимірами. Постійний тест Тукі, який передбачає, що значення помилки типу I становить 0,05 для кожного тесту, був використаний для розрізнення значущих відмінностей між парами дієтичних умов. Дані представлені як середнє значення ± Оцінка потужності SD була проведена для визначення обсягу вибірки. Для досягнення 80% успішності потрібно було принаймні шість предметів. У цьому дослідженні у нас було вісім випробовуваних, тому ми досягли розміру вибірки, необхідної для виявлення статистичних відмінностей.
результат
Пацієнти проходили 60-хвилинну циклічну реакцію при 75% VO 2max і отримували їх в умовах голодування, LGI та HGI. Під час відновлення брали проби крові кожні 30 хвилин до 3 годин для контролю кліренсу глюкози. На малюнку 1 показані результати рівня глюкози (а) та інсуліну (б) у плазмі після дієти. Концентрація глюкози та інсуліну в плазмі досягла піку через 30 хвилин після дієти, а потім знизилась протягом 3 годин. Концентрація глюкози та інсуліну в плазмі крові при дієті HGI була значно вищою, ніж дієта натще і LGI (P 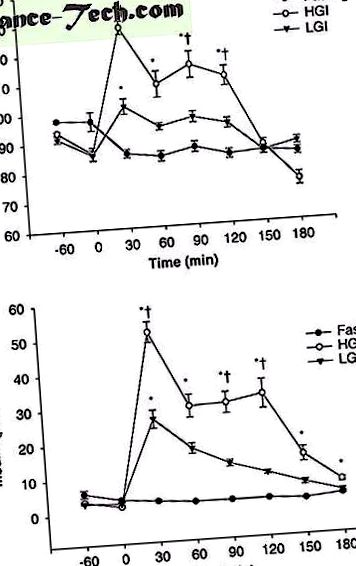
Концентрація глюкози в плазмі ( a ) та інсулін ( b ). * Значна різниця від рівня голодування (P † Значна різниця від низького глікемічного індексу (LGI)) (P
Плазмові концентрації неестерифікованих жирних кислот (NEFA) ( a ) і гліцерин ( b ). * Значна різниця від рівня голодування (P
Рівні мРНК GLUT4 у м’язі просторового латерального м’яза людини. * Значна різниця від рівня голодування (P † Значна різниця від відразу після тренування (P †
Рівні білка GLUT4 у м’язі просторового латерального м’яза людини.
Повнорозмірне зображення
Рівні мРНК FAT/CD36 і білка в м’язах показані на малюнках 5 і 6. Рівні мРНК FAT/CD36 та білків не відрізнялися між дієтою натще і LGI. Дієта HGI значно знизила рівень мРНК FAT/CD36 і рівень білка нижче вихідного рівня (P
Рівень мРНК FAT/CD36 у м’язі просторового латерального простору людини. * Значна різниця від рівня голодування (P † Значна різниця від відразу після тренування (P †
Рівень білка FAT/CD36 у м’язах великого простору людини. Значення повідомляються як середнє значення ± se (n = 6). * Значна різниця від рівня голодування (P † Значна різниця від відразу після тренування (P †
- Інок-дастерастерид для внутрішньопростатичного рівня дигідротестостерону у доброякісних чоловіків
- Інші магнітні бурі на симптоми людини та як зменшити вплив проблем зі здоров’ям на iLive
- Інок вірусу імунодефіциту людини за результатами ендодонтичного лікування British Dental Journal -
- Меню дитячого садка та дієтичні винятки - с
- Меню дитячого садка та дієтичні винятки - с
