Ятрогенний синдром Кушинга у немовляти через тривале застосування місцевих кортикостероїдів. Звіт про справу
Javiera Hansen S. A
Патрісія Лакур Р. Б
Відділ дитячої ендокринології, відділення педіатрії. Медичний факультет, Понтіфійський університет католицького де Чилі. перець чилі.
B Відділ дитячої ендокринології, лікарня педіатричної служби, доктор Сотеро Дель Ріо. перець чилі.
Синдром Кушинга (КС) є ендокринологічною патологією через надлишок глюкокортикоїдів, залежний або незалежний від гормону кортикотропіну (АКТГ). Основна причина - ятрогенна через надмірне вживання глюкокортикоїдів.
Продемонструвати зв'язок між тривалим застосуванням місцевих кортикостероїдів та розвитком КС.
Раніше здорове немовля старшого віку, яке отримувало місцеві кортикостероїди через себорейний дерматит. Через тривале вживання без нагляду у неї розвинувся синдром Кушинга, що характеризується ожирінням та порушеною швидкістю росту. Місцеве застосування було призупинено, а терапію розпочато із зменшенням фізіологічної замісної дози, досягаючи клінічного покращення.
Кортикостероїди місцевого застосування широко використовуються в клінічній практиці для лікування дерматологічних патологій. Вони доступні в різних презентаціях та сильних сторонах. Основними визначальними факторами його дії є: характеристики шкіри, діюча речовина препарату, потужність та техніка нанесення, завдяки чому побічні ефекти частіше спостерігаються при застосуванні при пелюшковому висипанні. Основним несприятливим ефектом тривалого застосування є розвиток синдрому Кушинга, який можна запобігти контрольованим застосуванням та поступовим зменшенням.
Раціональне та обережне використання місцевих кортикостероїдів має важливе значення, щоб скористатися корисними ефектами та уникнути появи побічних реакцій.
Ключові слова: Синдром Кушинга; місцеві глюкокортикоїди; Побічні ефекти; кортикостероїди
Синдром Кушинга є системним ендокринним розладом, наслідком аномально високого рівня кортизолу в плазмі. Захворюваність на КС є неточною, особливо у дитячого населення. Загалом, найбільш частою причиною є ятрогенність, яка є вторинною внаслідок надмірного екзогенного введення глюкокортикоїдів. Що стосується ендогенного КС, це може відбуватися залежно або незалежно від збільшення секреції гормону кортикотропіну (АКТГ). В межах ендогенного КС хвороба Кушинга (кортикотропна аденома) виявляється в 60-70% випадків у осіб старше 5 років, і при диференціальній діагностиці слід враховувати ектопічну продукцію АКТГ і, виключно, ектопічну продукцію кортикотропін-вивільняючого гормону (КРГ) . Що стосується випадків, що не залежать від АКТГ, хронічний гіперкортицизм пригнічує секрецію CRH та ACTH 2 через негативні відгуки. У цій групі пропонується оцінити наявність однобічного (аденома/карцинома) або двобічного (макро- або мікронодулярна гіперплазія надниркових залоз) ураження надниркових залоз, особливо у дітей віком до 5 років .
Застосування місцевих глюкокортикоїдів є важливим інструментом у дерматологічній терапії завдяки своєму потужному протизапальному та антипроліферативному ефекту. Однак тривалий вплив потужних місцевих кортикостероїдів може призвести до вторинних побічних ефектів, таких як шкірні прояви (кортикодермія), скомпрометована швидкість росту та пригнічення осі гіпоталамус-гіпофіз-наднирники (HHA) 3, особливо за відсутності належного медичного нагляду.
Мета цієї презентації - продемонструвати зв'язок між тривалим вживанням місцевих кортикостероїдів та розвитком побічних ефектів (синдром Кушинга та знижена швидкість росту).
Пацієнт чоловічої статі 1 рік 2 місяці направлений для оцінки на низький зріст із порушенням темпів росту з 6-місячного віку. Перша дитина батьків, які не є спорідненими, контролюється фізіологічна вагітність. 40-тижневий термін новонародженого, придатний для гестаційного віку (RNT AEG) з вагою при народженні 3195 г і довжиною 49 см, без патології в неонатальному періоді. Жодної відповідної патологічної історії не описано.
Під час першого оцінювання в поліклініці дитячої ендокринології виділився характерний кушингоїдний фенотип, саме тому прямо запитали про використання кортикостероїдів. Протягом третього місяця життя пацієнт проходив обстеження у своєму CESFAM через картину дерматиту, присутнього в шкірі голови та промежини, без попереднього атопічного дерматиту. Враховуючи це, було показано місцеве лікування 1% -ним кремом гідрокортизону ацетату, пов’язане з клотримазолом. Згодом у пацієнта спостерігалися дерматологічні симптоми, для яких показання було змінено на крем бетаметазону дипропіонату 0,05%. Завдяки хорошій початковій клінічній реакції на лікування, мати продовжувала використовувати крем у кожній линьці, досягаючи 10 місяців безперервного лікування, без нової переоцінки з боку медичної команди. У пацієнта не було жодної відповідної особистої чи сімейної історії.
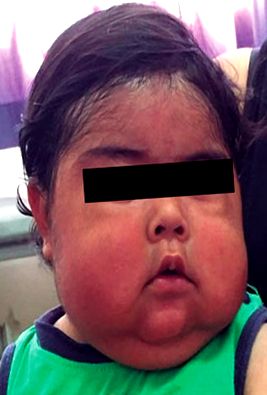
Під час фізичного обстеження пацієнт мав кушиноподібну фацію з маленькими очима, ротом коропа, опухлими щоками, бітемпоральним жиром, гіпертрихозом та подвійним підборіддям (рис. 1). В рамках його антропометричної оцінки виділялося зменшення відносин зростання/вік із оцінкою Z -4,26 та збільшення співвідношення вага/зріст із оцінкою Z + 2,93 (рис. 2). Так само досліджували підвищення артеріального тиску (АТ 108/64 мм рт. Ст.) З урахуванням 95-го процентиля (АТ 102/54 мм рт.ст.) відповідно до статі, віку та зросту 12. Решта обстеження без істотних змін, за винятком стійкості легкої еритеми промежини.
Рисунок 1 Перша амбулаторна консультація у віці 1 року та 2 місяців.
Рисунок 2 Крива зростання із початковим погіршенням темпів зростання.
Підвищували підозру щодо ятрогенного синдрому Кушинга, пов’язаного з ожирінням, вторинною гіпертонічною хворобою 1 стадії (НТ) та невисоким зростом із поганими темпами росту. На початковому етапі лікування було негайно припинено застосування місцевого кортикостероїду, а лікування гідрокортизоном розпочато перорально (перорально) у високому фізіологічному діапазоні доз (13,5 мг/м 2/добу), навчаючи себе щодо корекції дози в обличчя гострої патології. Щодо лікування гіпертонії, то тимчасово вводили гідралазин (1,5 мг/кг/день або фракціонували кожні 8 годин) відповідно до спільної оцінки з педіатричною нефрологією. Запрошено базове біохімічне дослідження, яке показало змішану дисліпідемію (загальний холестерин = 213 мг/дл і тригліцериди = 153 мг/дл), нормальну функцію щитовидної залози та затримку кісткового віку (ОС) 6 місяців для хронологічного віку 1 рік 3 місяці).
Пацієнт сприятливо еволюціонував із прогресивним зменшенням ознак Кушинга (рисунок 3), пов’язаним із поліпшенням швидкості росту та прогресивною втратою ваги. Після завершення 6 місяців замісного лікування пероральним гідрокортизоном (13 мг/м 2/добу) було розпочато поступове зниження до 10 мг/м 2/добу, і було запропоновано ранкове вимірювання базального кортизолу для оцінки можливої суспензії. Дослідження показало вихідний рівень кортизолу 7,3 мкг/дл, для якого підтримували фізіологічну дозу (8 мг/м 2/добу об.) І вимагали мікродозовий тест АКТГ (1 мкг). Цей тест був нарешті проведений після одного року лікування гідрокортизоном, отримавши в результаті корізол до АКТГ 6,32 мкг/дл і після АКТГ 24,2 мкг/дл (нормальне контрольне значення> 18 мкг/дл). лікування було припинено.
Рисунок 3 Спостереження через 3 місяці, 9 місяців та 1 рік лікування пероральним кортизолом.
Кортикостероїди для місцевого застосування широко використовуються в дитячій популяції для лікування різних дерматологічних патологій. Вони доступні в різних формах, концентраціях та потенціях, 4 класифікуючи їх за групами I - VII, відповідно до останньої характеристики 5-7 (Таблиця 1) 10. Клобетазол-пропіонат є найпотужнішим препаратом, пов’язаним із системними побічними ефектами, але будь-який кортикостероїд, застосовуваний у достатній кількості, тривалості та продовженні, може спричинити їх 5 .
Таблиця 1 Класифікація місцевих кортикостероїдів за потенцією та носієм. 6
Описано чотири визначальних фактори застосування місцевих кортикостероїдів, пов’язаних з більш високим ризиком розвитку побічних ефектів: шкіра (площа, розширення та відшкодування бар’єру), активний засіб препарату (потенція), носій (форма представлення) та техніка застосування (доза, частота та тривалість лікування) * 4, 9) .
Дітям рекомендується застосовувати топічні кортикостероїди з найнижчою можливістю (табл. 1), оцінюючи абсорбцію відповідно до вигляду препарату, враховуючи більшу абсорбцію у разі більшої роздратованості (мазь> крем> гель> лосьйон> аерозоль> порошок) . Що стосується шкіри, то діти особливо схильні до розвитку системних побічних реакцій через більшу частку поверхні шкіри щодо їх ваги (3, 5). Тонкість шкіри пов’язана з вищим ступенем всмоктування, особливо таких ділянок, як слизова оболонка, мошонка та повіки. З іншого боку, зволоження шкіри (попередня ванна), тертя та оклюзія сприяють проникненню ліків. У цьому контексті основними факторами ризику для більшої абсорбції є нанесення на запалену шкіру з втратою бар’єрної функції та анатомічну область, яку лікують на предмет схуднення у певних зазначених областях (слизова оболонка та мошонка) 4 .
Патологією, що характеризується наявністю обох факторів, є алергічний контактний дерматит підгузника. Цей стан слід диференціювати від подразнюючої висипки на пелюшках (90% випадків), оскільки лікування значно змінюється. Хоча алергічний дерматит можна лікувати місцевими кортикостероїдами та, зрештою, інгібіторами кальциневрину після оцінки фахівцем у дерматології, подразнюючий дерматит має пріоритет відновити шкірний бар’єр за допомогою загальних заходів, таких як часті зміни підгузників та лікування можливої інтеркурентної грибкової інфекції.
Зазвичай початкове введення місцевих кортикостероїдів обґрунтовується перевагами при лікуванні дерматологічної патології 9, і, крім того, їх належне застосування дає рідкісні помірні побічні ефекти, беручи до уваги вибір кортикостероїдів з найнижчою ефективністю для належного контролю захворювання спосіб 5. У зв’язку з вищесказаним, медична команда повинна проінструктувати пацієнта щодо правильного використання цих препаратів та проінформувати про можливі несприятливі наслідки 5 .
Побічні реакції при тривалому застосуванні місцевих кортикостероїдів включають придушення осі HHA та синдром Кушинга зі зниженою швидкістю росту. Придушення осі H-H-A, вторинне відносно екзогенних кортикостероїдів, є найпоширенішою причиною недостатності надниркових залоз 8 і може спостерігатися у 48% пацієнтів, які отримують сильні кортикостероїди. Ризик придушення зростає залежно від введеної дози та тривалості лікування. Аналогічним чином, період відновлення функціональності осі надниркових залоз пропорційний часу та інтенсивності придушення, і для активації може знадобитися тижнів чи місяців. Що стосується CS, характерний клінічний тип є частим, тоді як погіршення кривої росту менш описане. У разі клінічної підозри на ЦС необхідно підтвердити наявність гіперкортицизму біохімічним/гормональним шляхом. Потім, після підтвердження, пропонується провести дослідження, спрямоване на встановлення причини, вимірюючи АКТГ у плазмі крові та оцінюючи візуалізацію, за необхідності.
В контексті представленого випадку та більшої частоти ятрогенної причини, фундаментальним аспектом лікування є суспензія місцевого кортикостероїду та доповнення гідрокортизоном у фізіологічних дозах (9-12 мг/м 2/добу) у його ентеральних або па рентера. Подібним чином зменшення кількості добавок повинно здійснюватися поступово і поступово, щоб забезпечити реактивацію осі та правильну функціональність надниркової залози. Під час спостереження важливим аспектом, який слід врахувати, є навчання та профілактика гострої інтеркурентної патології через високий ризик спровокувати наднирковий криз, якщо дозу тимчасово не збільшити для реагування на стрес.
Нарешті, слід зазначити, що рекомендується оцінювати адекватну функцію надниркових залоз шляхом вимірювання базового рівня кортизолу та/або тесту ACTH, причому останній вважається золотим стандартом 4, 5 .
У нашого пацієнта були класичні клінічні ознаки надлишку кортикостероїдів. Під час дитинства антропометричний малюнок, що характеризується збільшенням ваги, пов’язаним із втратою темпів росту, повинен призвести до підозри на синдром Кушинга в рамках диференціального діагнозу. Раціональне та обережне використання місцевих кортикостероїдів приносить багато терапевтичних переваг і дозволяє уникнути появи важливих побічних реакцій.
Захист людей і тварин: Автори заявляють, що застосовані процедури відповідали етичним стандартам відповідального комітету з експериментів на людях, а також Всесвітній медичній асоціації та Гельсінській декларації.
Конфіденційність даних: Автори заявляють, що дотримувались протоколів свого робочого центру щодо публікації даних про пацієнтів.
Право на приватність та інформовану згоду: Автори отримали інформовану згоду пацієнтів та/або суб'єктів, зазначених у статті. Цей документ знаходиться у власності відповідного автора.
Конфлікт інтересів: Автори не заявляють конфлікту інтересів.
1. Ashish T, Manjusha G, Pankaj P, Poorva G. Актуальний стероїд-індукований ятрогенний синдром Кушинга у дитячій віковій групі: Повідомлення про рідкісні випадки. Індійський J Endocrinol Metab. 2013; 17 (Suppl1): S257-8. [Посилання]
2. Клінг М.А., Рой А., Доран А.Р. та ін. Цереброспінальна рідина імунореактивний кортикотропін-рилізинг-гормон та секреція адренокортикотропіну при хворобі Кушинга та великій депресії: потенційні клінічні наслідки. J Clin Endocrinol Metab 1991; 72: 260. [Посилання]
3. Pranab S, Nilendu S, Nilanjan S, Prashant S. Повітряний випадок синдрому Ятрогенного Кушинга, викликаний місцевим стероїдом з остеопорозом та гіпогонадизмом. Індійський J Dermatol. 2015 рік; 60 (4): 420. [Посилання]
4. Dhar S, Seth J, Parikh D. Системні побічні ефекти місцевих кортикостероїдів. Індійський J Dermatol. 2014; 59 (5): 460-4. [Посилання]
5. Casado-Verrier B, Sanz-Canalejas L, Gómez-Fernández C, Pagán B, López M, Casado-Jiménez M. Синдром ятрогенного Кушинга через місцеві кортикостероїди у двох дорослих. Med Cutan IberLat Am 2012; 40 (2): 58-61. [Посилання]
6. Інформація про призначення ВООЗ: препарати, що застосовуються при шкірних захворюваннях. 1999. [Посилання]
7. Decani S, Federighi V, Baruzzi E, Sardella A, Lodi G. Синдром Ятрогенного Кушинга та місцева стероїдна терапія: серії випадків та огляд літератури. J Дерматол лікує. 2014; 25: 495-500. [Посилання]
8. Мессазос Б, Захарін М. Уроки ятрогенного синдрому Кушинга у дітей. J Педіатр Здоров’я дитини. 2016; 52: 1106-10. [Посилання]
9. Motes M, Suárez E, Velázquez P, Cedeño Y. Синдром Кушинга, вторинний після лікування стероїдними кремами. Holguín Medical Scientific Mail 2008: 12 (5). [Посилання]
10. Hengge UR, Ruzicka T, Schwartz RA, Cork MJ. Побічні ефекти місцевих глюкокортикостероїдів. J Am Acad Dermatol. 2006; 54 (1): 1-18. [Посилання]
11. Лакруа А, Фелдерс Р, Стратакіс С, синдром Німана Л. Кушинга. Ланцет. 2015; 386 (9996): 913-27. [Посилання]
12. Flynn JT, Kaelber DC, Baker-Smith CM, et al. Керівництво з клінічної практики щодо скринінгу та управління високим кров'яним тиском у дітей та підлітків. Педіатрія. 2017; 140 (3): e20171904. [Посилання]
Отримано: 06 вересня 2017 р .; Затверджено: 24 січня 2018 року
- Лікування (MRKH) та перспективи синдрому Майєра-Рокітанського-Кюстера-Хаузера; Новини-Медичні
- Прогностичне значення метаболічного синдрому при вагітності для розвитку цукрового діабету та
- Що їсти, щоб полегшити ПМС
- Лікування синдрому Ретта та його ускладнень - Salud al día
- Синдром Альпорта MedlinePlus медична енциклопедія